大鼠腹膜源肥大细胞外泌体的分离、培养与鉴定*
王楷, 侯雨君, 廖晨希, 谭玉, 王路, 陈颖, 周思远
· 实验技术 ·
大鼠腹膜源肥大细胞外泌体的分离、培养与鉴定*
王楷, 侯雨君, 廖晨希, 谭玉, 王路, 陈颖, 周思远△
(成都中医药大学针灸推拿学院/第三附属医院,四川 成都 610075)
分离、培养及鉴定大鼠腹膜源肥大细胞外泌体。提取8~10周龄SPF级雌性SD大鼠腹腔灌洗液,使用Percoll密度梯度分离法分离灌洗液中的肥大细胞,通过甲苯胺蓝染色鉴定肥大细胞,在细胞培养板中加入白细胞介素3和干细胞生长因子诱导肥大细胞成熟,收集细胞上清液,采用超速离心法分离上清液中的外泌体,通过透射电镜,纳米流式细胞仪从外泌体形态、粒径和表面标志蛋白三个方面鉴定外泌体。分离得到的肥大细胞被甲苯胺蓝染成蓝紫色,分离的肥大细胞外泌体呈典型盘状,粒径分布范围为30~150 nm,平均粒径为75.33 nm,外泌体表面标志蛋白CD9和CD81呈阳性表达。Percoll密度梯度分离法联合超速离心法分离大鼠腹腔灌洗液中肥大细胞外泌体的方法是可行的。
肥大细胞;外泌体;超速离心
肥大细胞(mast cells, MCs)由骨髓中的CD34+/CD117+前体细胞分化而来,随血液循环迁移至外周组织中。MCs主要分布在皮肤、胃肠道和呼吸道等与外界环境直接接触的部位。MCs属于先天免疫细胞,同时参与调节适应性免疫,其表型和功能受周围环境和生长因子的影响[1],受到外界刺激时能分泌预先合成的组胺、蛋白酶及从头合成的细胞因子和趋化因子等,介导炎症、免疫和伤害性感觉等生理病理反应,同时也能分泌外泌体(exosomes)等微小囊泡。
外泌体是由细胞分泌的磷脂双分子膜包绕的胞外囊泡,直径约30~150 nm[2]。几乎所有细胞在生理及病理状态下均可释放和摄取外泌体。外泌体囊状结构内携带的微小RNAs(microRNAs, miRNAs)、信使RNAs(messenger RNAs, mRNAs)、蛋白质以及其降解片段,是细胞间以及细胞与邻近微环境之间传递信息的载体[3]。稳定的生物学特性以及可以携带生物信息的特点,使其既具有作为早期诊断依据的潜力,又有望成为治疗的靶点。
肥大细胞也能分泌外泌体,已有研究对骨髓源肥大细胞外泌体[4]和腹腔肥大细胞[5]的提取方法进行报道,这为相关疾病生理病理的深入研究提供了重要基础。腹腔灌洗液的细胞学检查已经在临床中广泛应用,是研究腹腔相关脏器病变机制的重要手段。目前尚无研究报道腹膜源肥大细胞外泌体的提取方法,本课题综合现有肥大细胞和外泌体的提取方法,通过多次实验,摸索出一种高效可行的大鼠腹膜源肥大细胞外泌体提取方法,以期为相关研究者提供参考。
材料和方法
1 实验动物
SPF级雌性SD大鼠[8~10周龄,(220±20) g,10只],购自成都中医药大学实验动物中心,生产许可证编号为SCXK(川)2020-030,饲养于成都中医药大学清洁级动物房,使用许可证编号SYXK(川)2019-049,自由饮食,温度(22±2) ℃,湿度50%,昼夜12 h/12 h,所有操作均获得成都中医药大学实验动物伦理审查委员会批准,伦理备案号为2021-15。
2 主要试剂与仪器
D-Hanks溶液购自Solarbio;Percoll细胞分离液购自Biosharp;NaCl购自天津市致远化工有限公司;无外泌体血清购自TransGen Biotech;超纯水(优普超纯水制造系统:型号UPH-II-10T);异氟烷购自RWD;红细胞裂解液购自天根生化科技(北京)有限公司;甲苯胺蓝染液购自Sigma;RPMI-1640培养液购自HyClone;干细胞生长因子(stem cell growth factor, SCF)重组蛋白购自Genscript;白细胞介素3(interleukin-3, IL-3)重组蛋白购自武汉云克隆科技股份有限公司;PBS购自Sangon Biotech; FITC Mouse IgG购自BioLegend;FITC Mouse Anti-Human CD9和FITC Mouse Anti-Human CD81购自BD;青、链霉素混合液购自Gibco。
0.45 μm过滤膜购自Millipore;HT-7700型透射电镜和CP100MX型超速离心机购自Hitachi;纳米流式细胞仪购自NanoFCM(型号N30E)。
3 方法
3.1大鼠腹腔灌洗液收集使用异氟烷与氧气的混合气体麻醉大鼠,将大鼠固定于无菌泡沫板上,并且将麻醉机调至维持剂量面罩维持麻醉,使用纱布蘸取75%乙醇对大鼠的腹部进行消毒,使用无菌手术剪剪开腹壁剑突至肚脐的上皮,充分暴露腹部肌肉层,用无菌齿镊提起腹中部暴露的肌肉层,注射器抽取10 mL D-Hanks溶液注射入腹腔内。如图1所示,双手轻轻振荡按摩腹部两侧,持续1 min,再用齿镊提起腹部肌肉层,用手术剪剪开一个小口,使用10 mL无菌注射器从腹腔内吸取6 mL以上的灌洗液,注入无菌带盖的15 mL离心管内,在4 ℃冰箱中临时贮存,大鼠脱颈处死。

Figure 1. Intraperitoneal injection of D-Hanks solution. After inhalation of 3% isoflurane with nasal mask to maintain anesthesia, the rats were intraperitoneally injected with 10 mL D-Hanks solution, and the abdomen was massaged for 1 min.
3.2腹膜源肥大细胞分离及上清液收集称取0.85 g NaCl与10 mL超纯水充分混合,得到浓度为8.5%的NaCl溶液,再将8.5%的NaCl溶液溶液10倍稀释为0.85% NaCl溶液;预先配制具有生理性渗透压的100% Percoll原液:按照9体积Percoll分离液与1体积的8.5% NaCl溶液进行充分混合;再用0.85% NaCl溶液稀释成75%和70%的Percoll分离液;取2 mL的75% Percoll分离液和2 mL的70% Percoll分离液分别依次沿离心管壁加入;将腹腔灌洗液样品于225×离心5 min,弃去上清,加入1 mL PBS重悬;将分离得到的细胞悬液沿管壁缓慢加入上述Percoll分离液中;然后放入离心机中,501×离心20 min;吸取位于75%和70% Percoll分离液之间的呈乳白色的细胞于1.5 mL EP管中,300×离心5 min,弃上清,吸取500 μL红细胞裂解液(过滤除菌)于EP管中,重悬细胞,静置约3 min后,306×离心5 min,弃去上清,以去除红细胞;加入1 mL PBS于EP管中,通过无菌移液器反复吹打混匀以洗涤细胞;将20 μL甲苯胺蓝染液加入20 μL细胞悬液,充分混匀染色2 min,鉴定肥大细胞;剩余的细胞悬液306×离心5 min,弃上清,加入1 mL由血清和DMSO按体积9∶1配制的冻存液,移液器吹打混匀后使用冻存管存放于-80 ℃冰箱。取肥大细胞常规复苏,添加含10%无外泌体血清、10 μg/L IL-3和20 μg/L SCF的RPMI-1640培养液继续培养,待细胞生长密度约90%时,收集细胞上清(共收集约50 mL),使用4 ℃、2 000×离心10 min,目的是去除细胞碎片用于提取外泌体。
3.3肥大细胞上清液外泌体分离将上述收集的细胞上清液放入37 ℃水浴锅中速融,然后将样品移至一个新的离心管内4 ℃、2 000 ×离心30 min,将上清液转移到另一离心管中,4 ℃、10 000×再次离心45 min,该步骤是为了去掉较大的细胞外囊泡;取上清,使用过滤膜(孔径0.45 μm)进行过滤,回收滤液;将过滤后的液体装入新的离心管中,改用超速离心机,4 ℃、100 000×离心70 min,去除上清;用10 mL预冷的1×PBS洗涤后,4 ℃、100 000×再次离心70 min;去除上清,再次用100 μL预冷的1×PBS重悬即为所要提取的外泌体。取10 μL外泌体用于外泌体形态观察,10 μL用于外泌体粒径检测,20 μL用于外泌体表面标志蛋白分析,剩余的外泌体置于-80 ℃冰箱保存。
4 外泌体鉴定
4.1外泌体形态观察使用Hitachi透射电镜观察外泌体形态。使用移液器吸取上述提取的外泌体样品10 μL小心滴入电镜铜网,经过1 min沉淀后,使用滤纸轻轻吸去铜网边缘的液体,再向铜网内滴加10 μL醋酸双氧铀,同样沉淀1 min,吸干铜网边缘多余的浮液,在室温下自然风干数分钟,选择100 kV进行电镜拍照,获得外泌体形态检测结果。
4.2外泌体粒径分析使用NanoFCM纳米流式检测仪分析外泌体粒径。将外泌体样品取出10 μL稀释到30 μL,检测前按照说明书先用标准品测试仪器性能,外泌体样品上机必须在仪器检测合格后方可进行,注意上样需根据说明书进行梯度稀释,以免造成进样针堵塞,待自动检测完成后即可获得外泌体的粒径和浓度检测结果。
4.3外泌体表面标志蛋白检测使用纳米流式检测仪评估外泌体表面标志蛋白浓度。将20 μL外泌体稀释至90 μL,取30 μL稀释外泌体分别与20 μL荧光标记的CD9、CD81和IgG抗体混合均匀,在无光环境中37 ℃孵育30 min,加入1 mL预冷的PBS,选择超速转子,4 ℃、110 000×超速离心70 min,小心去除上清,加入1 mL预冷的PBS,选择超速转子,再次4 ℃、110 000×超速离心70 min,小心去除上清,用50 μL预冷的1×PBS重悬,同样需提前用标准品校正仪器,测试合格后方可上样,注意需进行梯度稀释以免造成进样针堵塞,待样本完成检测即可获得仪器检测蛋白指标结果。
结果
1 大鼠腹膜源肥大细胞分离染色鉴定结果
使用Percoll密度梯度分离到的腹膜源肥大细胞呈白色云雾状,如图2所示。经甲苯胺蓝染色的肥大细胞呈蓝紫色,形态多呈圆形、椭圆形,如图3所示。复苏肥大细胞,继续培养14 d后,如图4所示,可见细胞布满细胞培养板。

Figure 2. Mast cells were isolated by Percoll density gradient separation.

Figure 3. Mast cells isolated were identified by toluidine blue staining.
Figure 4. Post-recovery mast cell culture for 14 d. Mast cells covered almost the entire cell culture plate.
2 外泌体鉴定结果
透射电镜下观察到外泌体呈边缘厚,中心薄的圆盘状,大小不一,边界清稀,结构完整,如图5A所示。外泌体的直径分布主要位于30~150 nm之间,平均粒径为75.33 nm,如图5B所示。外泌体表面表达标志蛋白CD9和CD81表达阳性,而同型对照IgG为阴性,如图5C所示。
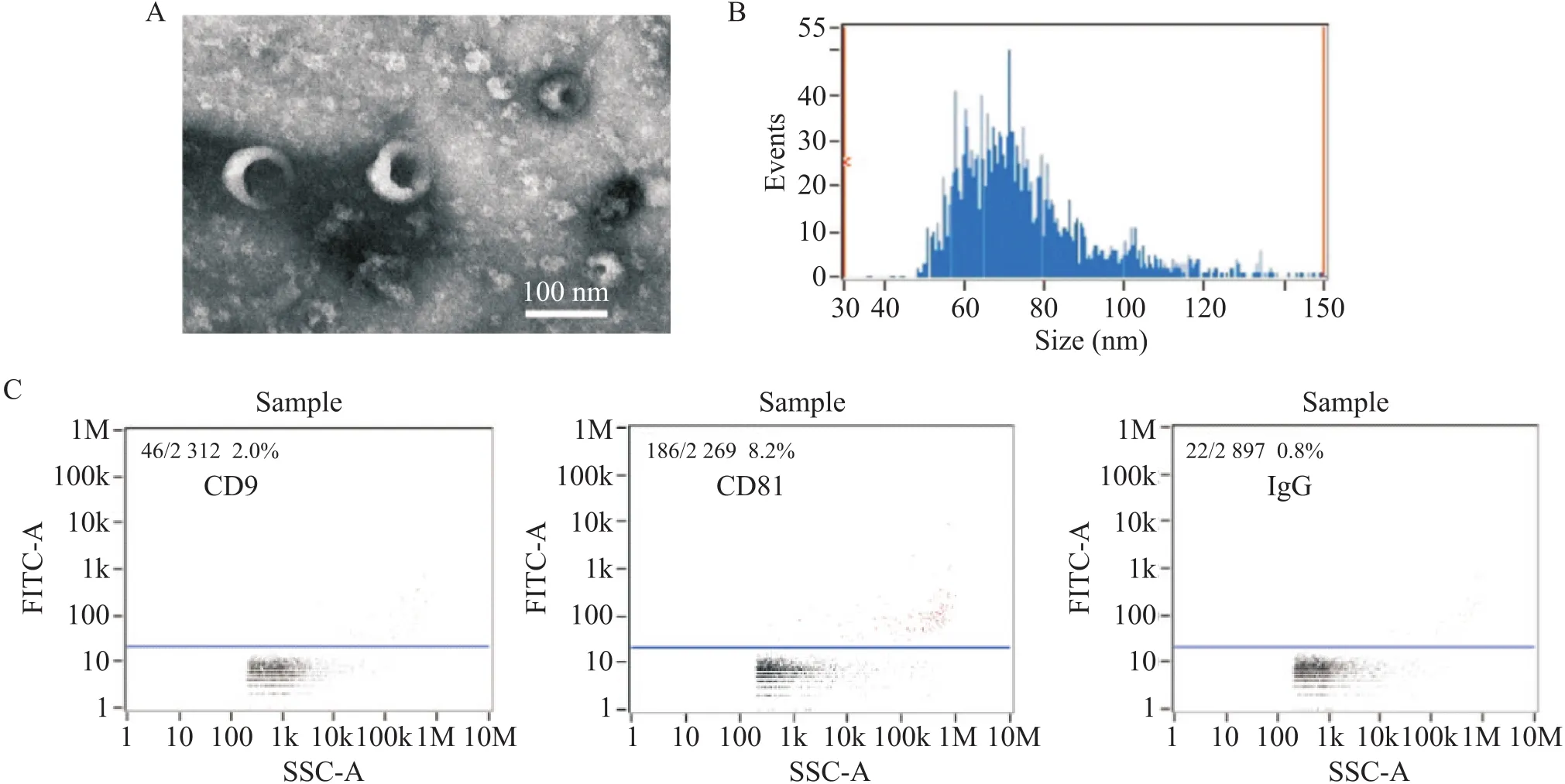
Figure 5. Identification of exosomes secreted by peritoneal mast cells. A: the exosomes observed under transmission electron microscope; B: particle size distribution was detected by nano-flow cytometry (NanoFCM); C: exosome-specific markers CD81 and CD9 were determined by NanoFCM. Red particles represent positivity.
讨论
本研究描述了一种成年SD大鼠的腹膜源肥大细胞外泌体提取方案,结果表明应用Percoll密度梯度分离法分离SPF级大鼠腹腔灌洗液中的肥大细胞联合超速离心法分离肥大细胞上清液中外泌体的方法是可行的。所获得的肥大细胞外泌体表现出典型特征,如杯盘状,表面标志蛋白CD9和CD81阳性等。大量文献多是研究对皮肤源[6]、骨髓源和腹膜源[7]肥大细胞的分离培养,或是对血液、尿液[8]和永生细胞[9]等外泌体进行提取,但是关于腹膜源肥大细胞分泌的外泌体研究甚少。本研究利用Percoll密度梯度离心,并采用细胞生长因子IL-3和SCF联合培养得到纯度较高的原代腹膜来源的肥大细胞,对收集的细胞上清液使用超速离心法分离外泌体,为后续研究肥大细胞外泌体在疾病中的作用机制奠定基础。
Percoll是一种硅胶颗粒混悬液,对细胞无毒性,可根据肥大细胞的密度(1.09~1.17)×103g/L调节分离液密度[10],既能保护细胞生物活性又可提取到高纯度细胞。值得注意的是,在本实验提取过程中关键的步骤是吸取腹腔灌洗液时,要尽可能避免样本的血液污染并尽量吸入最大量的灌洗液,这对于获得大量高纯度的腹膜源肥大细胞至关重要。
外泌体的分离方法主要包含超速离心、体积排阻色谱法、过滤法、免疫分离、隔离筛选法及密度梯度离心等,其中超速离心法是外泌体分离的金标准。研究证实超速离心法分离外泌体纯度高、回收率高,同时最大限度减少蛋白质聚集体和其他膜粒子的共纯化,有利于保护外泌体的功能,这对后续进行外泌体相关的研究至关重要。对提取到的外泌体鉴定方法一般从三个方面进行,即外泌体形态观察、粒径分析和标志蛋白检测。NanoFCM是从单颗粒水平检测粒径分布、浓度和荧光分析[11]。在检测外泌体的粒径方面,NanoFCM的分辨率较纳米颗粒跟踪分析(nanoparticle tracking analysis, NTA)方法更高,所检测的直径范围更广,能够覆盖完整的外泌体粒径范围,这使检测结果更精确。在检测外泌体蛋白标志物方面,NanoFCM与常用的Western blot相比,不仅可以从单颗粒水平对外泌体进行精确计数,还能对蛋白标志物进行双荧光标记。
综上所述,本研究通过Percoll密度梯度分离法联合超速离心法提取大鼠腹膜源肥大细胞外泌体,并对所提取到的外泌体进行形态学及生物学两个方面进行验证,为进一步研究腹膜源肥大细胞外泌体相关功能奠定基础。
[1] Tanaka S. Phenotypic and functional diversity of mast cells[J]. Int J Mol, 2020, 21(11):3835.
[2] Yao Y, Jiao D, Li Z, et al. Roles of bile-derived exosomes in hepatobiliary disease[J]. Biomed Res Int,2021, 2021(4):8743409.
[3] Yeh YY, Ozer HG, Lehman AM, et al. Characterization of CLL exosomes reveals a distinct microRNA signature and enhanced secretion by activation of BCR signaling[J]. Blood, 2015, 125(21):3297-3305.
[4]谢国钢. 肥大细胞来源的外泌体结合游离IgE抑制过敏反应的实验研[D]. 上海:上海交通大学, 2016.
Xie GG. Mast cell derived exosomes suppress allergic reaction by binding to free IgE[D]. Shanghai: Shanghai Jiao Tong University, 2016.
[5]幸晓燕,王青,周联,等. 一种大鼠腹腔肥大细胞分离方法[J]. 免疫学杂志, 2011, 28(7):615-624.
Xin XY, Wang Q, Zhou L, et al. A method for isolating rat peritoneal mast cell[J]. Immunol J, 2011, 28(7):615-624.
[6]韩秀萍,王颖,张悦,等. 胎鼠皮肤来源肥大细胞的分离培养和鉴定[J]. 细胞与分子免疫学杂志, 2017, 33(9):1187-1190.
Han XP, Wang Y, Zhang Y, et al. The culture of murine fetal skin-derived mast cells[J]. Chin J Cell Mol Immunol, 2017, 33(9):1187-1190.
[7]朱奕锜,邵亦心,王朵勤,等. 小鼠腹腔及骨髓源性肥大细胞的培养与鉴定[J]. 中华皮肤科杂志, 2018, 51(8):575-579.
Zhu YQ, Shao YX, Wang DQ, et al. Cultivation and identification of mouse peritoneal and bone marrow-derived mast cells[J]. Chin J Dermatol, 2018, 51(8):575-579.
[8]吕婕,李珉珉. 尿外泌体microRNAs在肾脏疾病中的研究进展[J]. 中国病理生理杂志, 2020, 36(2):378-384.
Lv J, Li MM. Progress of urinary exosome microRNAs in kidney diseases[J]. Chin J Pathophysiol, 2020, 36(2):378-384.
[9] Li M, Zhao J, Cao M. Mast cells-derived MiR-223 destroys intestinal barrier function by inhibition of CLDN8 expression in intestinal epithelial cells[J]. Biol Res, 2020, 53(1):12.
[10] Enerbäck L, Svensson I. Isolation of rat peritoneal mast cells by centrifugation on density gradients of Percoll[J]. J Immunol Methods,1980, 39(1/2):135-145.
[11] Arab T, Mallick ER, Huang Y,et al. Characterization of extracellular vesicles and synthetic nanoparticles with four orthogonal single-particle analysis platforms[J]. J Extracell Vesicles, 2021, 10(6):e12079.
Isolation, culture and identification of mast cell exosomes from rat peritoneum
WANG Kai, HOU Yu-jun, LIAO Chen-xi, TAN Yu, WANG Lu, CHEN Ying, ZHOU Si-yuan△
(,,610075,)
Isolation, culture and identification of mast cell exosomes.Peritoneal lavage fluid was extracted from 8-to-10-week-old female SD rats. The mast cells were isolated by Percoll density gradient separation method. Interleukin-3 and stem cell growth factor were added to induce mast cell maturation. Mast cells were identified by toluidine blue staining. Mast cell supernatant was collected, and exosomes were separated by high-speed low-temperature centrifugation. Transmission electron microscopy, particle size analysis and flow cytometry were used to detect the shape, diameter and marker protein of exosomes, respectively.Isolated mast cells were stained blue-purple with toluidine blue. The particle size distribution range was 30 to 150 nm, the average particle size was 75.33 nm. Expression of exosomal surface marker proteins CD9 and CD81 were detected.The complete mast cell exosomes were successfully isolated from the rat abdominal cavity.
Mast cells; Exosomes; Ultracentrifugation
R33-33; R363
A
10.3969/j.issn.1000-4718.2022.06.024
1000-4718(2022)06-1148-05
2021-12-29
2022-04-12
国家自然科学基金资助项目(No. 82074558)
Tel: 028-87689918; E-mail: zsy@cdutcm.edu.cn
(责任编辑:宋延君,李淑媛)
——外泌体与老年慢性疾病相关性的研究进展

