藜蒿总黄酮提取工艺优化及其抗氧化活性研究
肖恺灵 张媛媛 齐致源 付家敏 王琤韡
(江西科技师范大学生命科学学院,江西 南昌 330013)
藜蒿(Artemisia selengensis Turcz.)属桔梗目菊科,别名芦蒿、柳叶蒿、蒌蒿、水艾、水蒿等,为多年生草本植物,植株具清香气味[1]。藜蒿作为一种特色植物资源,遍生于江西省鄱阳湖附近区域[2]。民间多食其嫩茎叶,全株亦可入药,安全无副作用,其药用价值在古本草书中已有记载,明代李时珍的《本草纲目》中写道:“藜蒿味平甘,主五脏邪气,风寒湿痹,补中益气,长毛发令黑,疗心悬,少食长饥;久服轻身耳目聪明不老”[3]。研究表明,藜蒿富含黄酮类、多酚类等活性成分,能够清除多种自由基,具有良好的抗氧化活性[3-5]。因此藜蒿具有清火消炎以及治疗寒冷腹痛、急性肝炎等功效,也被发现可用于治疗黄胆型或无黄胆型肝炎[7]。
总黄酮(Flavonoids)是一类黄酮类化合物,属植物次生代谢产物,具有抗肿瘤、降血压、抗氧化及促进新陈代谢等功能[7]。现代研究表明,总黄酮因酚羟基上的氢原子与过氧自由基结合生成黄酮自由基,进而与其他自由基反应,从而终止自由基链式反应[8],因此总黄酮能够提高机体抗氧化及清除自由基的能力,且无毒无害,可作为绿色抗氧化剂。
目前,关于藜蒿总黄酮的抗氧化等研究较少,对于藜蒿这种特色植物的开发也处于起步阶段。相比于新兴的微波辅助萃取法和超临界流体萃取法,溶剂回流萃取法作为传统的醇提法虽然耗费时间长、步骤较多,但采用的乙醇溶剂具有低毒性、价格低廉、使用简单等优点,在工业方面提取藜蒿总黄酮时具有更大的优势。因此本实验采用溶剂回流萃取法,优化藜蒿提取工艺条件,为大规模提取藜蒿总黄酮提供参考依据。在单因素试验基础上结合正交试验优化提取工艺,提高总黄酮得率,以DPPH 自由基清除率、OH自由基清除率和还原能力为指标,对藜蒿总黄酮的体外抗氧化能力进行评价。研究为藜蒿资源有效开发提供了合理的数据,为藜蒿总黄酮提取的工业化生产提供了具体的工艺参数。
1 材料与方法
整株野生藜蒿(采摘自江西省鄱阳湖附近)。芦丁标准品(合肥博美生物科技有限责任公司);无水乙醇(北京化学试剂有限公司);亚硝酸钠、硝酸铝、AlCl3·6H2O、HCl、NaOH(西陇科学股份有限公司);DPPH(上海化成工业发展有限公司)。以上试剂均为分析纯。

ES2000 型电子天平(天津市德安特传感技术有限公司);DHG-9015A 型电热鼓风恒温干燥箱(上海一恒科学仪器有限公司);DK-S26 型电热恒温水浴锅(上海精宏实验设备有限公司);722N 可见分光光度计(上海佑科仪器仪表有限公司);RE-522AA 旋转蒸发仪(上海亚荣生化仪器厂);KL05A 型高速台式冷冻离心机(凯特实验仪器有限公司)。

1.3.1 黄酮标准液的制备
准确称取芦丁0.010 g,置于50 mL 容量瓶中,以60%乙醇溶解定容至刻度,取25 mL 定容后的溶液用蒸馏水稀释至50 mL,配制成浓度为0.1 mg/mL 的芦丁对照品溶液。准确量取芦丁标准液2、4、6、8、10 mL 分别加入5 支试管中,向每支试管中加入5 mL 30%乙醇溶液、0.3 mL 5%亚硝酸钠溶液,摇匀放置6 min,再加入0.3 mL 10%硝酸铝溶液,摇匀,放置6 min,最后加入4 mL 4%氢氧化钠溶液,蒸馏水稀释至25 mL,放置25 min。在可见分光光度计上设定波长510 nm,测定各试管中溶液的吸光度。以吸光度为纵坐标,溶液浓度(μg/mL)为横坐标,绘制标准曲线图。
1.3.2 藜蒿总黄酮提取工艺
取整株藜蒿在鼓风干燥箱内60 ℃下烘干至恒重,超微粉碎后过80 目筛得到样品粉末。准确称取经处理后的藜蒿样品粉末1.000 g 置于25 mL圆底烧瓶中,加入一定体积的70%乙醇溶液浸泡1 h 后,放入一定温度恒温水浴锅中回流提取一定时间,得到的提取液用滤纸过滤定容至25 mL。在见分光光度计上设定波长510 nm,测定试管中溶液的吸光度。
1.3.3 藜蒿总黄酮得率的计算
利用线性回归方程计算藜蒿中总黄酮得率:

式中:C 为样品中黄酮的浓度(g/L);V 为样品提取液的体积(mL);n 为样品提取液的稀释倍数;m 为藜蒿样品干粉的质量(g)。总黄酮得率r 的单位为mg/g。
1.3.4 藜蒿总黄酮提取工艺优化
1.3.4.1 单因素试验设计
在藜蒿粉末质量(1.000 g)不变的情况下,设置提取温度、提取时间、液固比三个变量,研究其对藜蒿总黄酮提取率的影响。设液固比15 mL/g、提取时间1.5 h 为不变量,研究分析5 个不同提取温度(50、60、70、80、90 ℃)对藜蒿总黄酮提取率的影响;设液固比20 mL/g、提取温度70 ℃为不变量,研究分析5 个不同提取时间(0.5、1、1.5、2、2.5 h)对藜蒿总黄酮提取率的影响;设提取温度70 ℃、提取时间1.5 h 为不变量,研究分析5 个不同液固比(10、15、20、25、30 mL/g)对藜蒿总黄酮提取率的影响。
1.3.4.2 正交试验设计
通过单因素试验,确定影响藜蒿总黄酮得率的主要因素和各因素参数范围,选择对得率影响较大的提取温度、液固比和提取时间3 个因素设计正交试验L9(33)。正交试验因素水平见表1。通过正交试验确定藜蒿总黄酮提取的最佳工艺组合。

表1 藜蒿总黄酮醇提法正交试验因素水平
1.3.5 体外抗氧化活性试验
1.3.5.1 总还原能力的测定
取上述优化条件下的提取物,减压浓缩成稠膏,使用70%的乙醇溶解并稀释,得浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.8 g/L 的黄酮溶液,使用相应浓度的VC 做对照试验。参照李冬梅等[10]的方法,并做相应修改。取1%的铁氰化钾2.5 mL 与0.2 mol/L 的磷酸盐缓冲溶液0.2 mL,加入待测样品溶液,50 ℃恒温放置30 min,加入2.5 mL 10%的三氯乙酸,离心取上清液1 mL,加入1 mL 的0.1% Fe Cl3、4 mL 蒸馏水混匀,静置10 min,于700 nm 处测吸光度。
还原能力计算公式为 还原能力=A1-A2(2)其中,A1为样品组吸光度;A2为样品本底吸光度(以等体积蒸馏水代替FeCl3溶液)。1.3.5.2 清除OH 自由基能力的测定
参照田建华等[11]的方法,并做相应修改。取2 mmol/L FeSO4溶液5 mL,6 mmol/L 水杨酸-乙醇溶液15 mL,再加入6 mmol/L H2O2溶液5 mL,摇匀混合。在37 ℃恒温水浴15 min,以蒸馏水为参照,于517 nm 处测定吸光度,计算清除率:
OH 自由基清除率=(A0-A1)/A0×100% (3)式中:A0为空白对照液的吸光度;A1为样品溶液的吸光度。
1.3.5.3 清除DPPH 自由基能力的测定
参照董玉玮等[12]的方法,并做相应调整。取不同浓度提取液3 mL,精确取0.4 mL/mg 的DPPH-乙醇溶液3 mL,试管暗置30 min,4000 r/min 离心10 min,使用无水乙醇做对照品试验。取上清液于517 nm 处测吸光度,并计算清除率:
DPPH 自由基清除率=[1-(A1-A2)/A0]×100%
(4)其中,A0为3 mL 无水乙醇+3 mL DPPH 溶液的吸光度;A1为3 mL 样品溶液+3 mL DPPH 溶液的吸光度;A2为3 mL 样品溶液+3 mL 无水乙醇的吸光度。
2 结果与分析

根据试验设计方法,在波长510 nm 处测定溶液的吸光度。以吸光度为纵坐标(Y),溶液浓度(X)为横坐标,绘制出标准曲线图1。求出回归方程:y=2.177x+0.0042,相关系数R2=0.999,说明芦丁浓度与吸光度呈线性关系。

图1 芦丁标准曲线

2.2.1 液固比对藜蒿总黄酮得率的影响
设置提取温度70 ℃、提取时间1.5 h、乙醇体积分数60%,以液固比为变量考察其对总黄酮得率的影响,结果如图2 所示。由图2 可得出,随着液固比增大,总黄酮得率在10、15、20 mL/g 范围内增高,在液固比为20 mL/g 时达到最大值,当液固比超过20 mL/g 时,总黄酮得率下降。原因可能是液固比较低时乙醇溶剂不足导致藜蒿黄酮提取不完全,而液固比较高时,乙醇溶剂过多影响藜蒿黄酮提取率。因此,20 mL/g 的液固比是藜蒿黄酮提取的最佳参数。

图2 液固比对藜蒿总黄酮得率的影响
2.2.2 提取温度对藜蒿总黄酮得率的影响
设置提取时间1.5 h、液固比15 mL/g、乙醇体积分数60%,在提取温度50、60、70、80、90 ℃范围内考察其对藜蒿总黄酮得率的影响,结果如图3 所示。由图3 可知,总黄酮得率随提取温度的变化而变化,在提取温度为80 ℃时达到得率的最大值,此时提取温度再升高,黄酮得率反而下降。原因可能是提取温度升高,分子运动更加剧烈,增大了黄酮提取率,但提取温度过高,破坏了分子结构导致藜蒿总黄酮提取率下降。所以,80 ℃的提取温度是藜蒿黄酮提取的最佳条件。
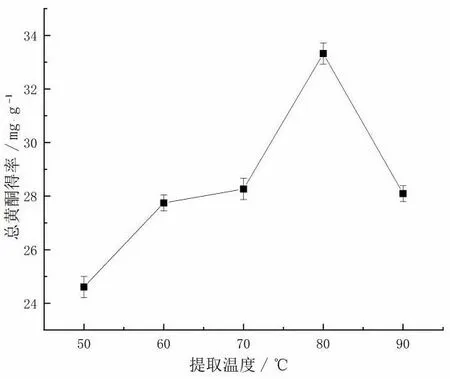
图3 提取温度对藜蒿总黄酮得率的影响
2.2.3 提取时间对藜蒿总黄酮得率的影响
设置提取温度70 ℃、液固比15 mL/g、乙醇体积分数60%,在0.5-2.5 h 范围内考察提取时间对藜蒿黄酮提取率的影响,结果如图4 所示。由图4 可知,在一定范围内藜蒿总黄酮得率随提取时间而变化,并在提取时间为1.5 时达到最大值。原因可能是提取时间过短,藜蒿黄酮溶出过少导致总黄酮得率低,而提取时间过长,藜蒿中的总黄酮会发生热分解损失,藜蒿黄酮提取率下降。因此,1.5 h 的提取时间是藜蒿黄酮提取的最佳条件。
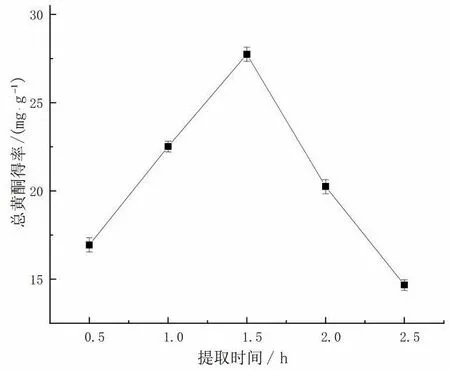
图4 提取时间对藜蒿总黄酮得率的影响

各因素对藜蒿总黄酮得率的影响并非单一线性,实际上总黄酮得率受到提取温度、提取时间、液固比、乙醇体积分数因素的交叉影响,而乙醇体积分数因素对藜蒿总黄酮得率影响较小,因此根据单因素考察试验结果,选取提取温度、提取时间、液固比三个因素设置正交试验的因素水平,对藜蒿总黄酮的提取工艺进行进一步的优化。正交试验结果和方差分析如表2、表3 所示。由表3 可知,各因素对提取藜蒿总黄酮的影响不同,在本研究中提取温度影响最大,其次是液固比,最后是提取时间。藜蒿总黄酮的最佳提取参数组合为A3B2C2,即最佳提取工艺条件是提取温度80 ℃、液固比20 mL/g、提取时间1.5 h。

表2 藜蒿总黄酮醇提法正交试验结果
用正交设计助手软件对试验结果进行方差分析,P<0.05 认为有显著性差异,P<0.01 则认为有极显著性差异。由表3 可知,因素A 在P<0.01水平上有极显著性差异,因素B 和因素C 在P<0.05 水平上有显著性差异。如表4,为验证试验结果,考察预测结果的可靠性,在优化的工艺参数下(提取温度80 ℃、液固比20 mL/g、提取时间1.5 h、乙醇体积分数60%),进行三次平行验证试验,所得藜蒿总黄酮平均得率为38.32 mg/g。

表3 藜蒿总黄酮醇提法正交实验方差分析

表4 验证实验结果

2.4.1 藜蒿总黄酮总还原能力
测定藜蒿总黄酮和VC 的总还原能力结果见图5。随着黄酮浓度和VC 浓度的增加,还原能力都出现较为明显的上升,当VC 的浓度达到0.8 g/L 时,吸光度值达到最大,为1.040;而总黄酮的浓度为0.8 g/L 时,吸光度为0.971。藜蒿总黄酮总还原能力随着总黄酮浓度的增加而提高,与同浓度VC 的还原能力相近。由此证明了藜蒿总黄酮具有一定的还原能力。

图5 不同浓度的藜蒿总黄酮总还原能力
2.4.2 藜蒿总黄酮对OH 自由基清除能力
由图6 可知,在总黄酮浓度为0.1-0.8 g/L 范围内时,藜蒿黄酮对OH 自由基有一定的清除作用,清除能力随着黄酮浓度的增加而增强,且略高于VC 的清除能力,当浓度达到0.8 g/L 时,黄酮对OH 自由基的清除率为91.12%,VC 对OH 自由基的清除率为90.68%,二者清除能力较为接近。结果表明藜蒿总黄酮具有良好的清除OH 自由基的能力。
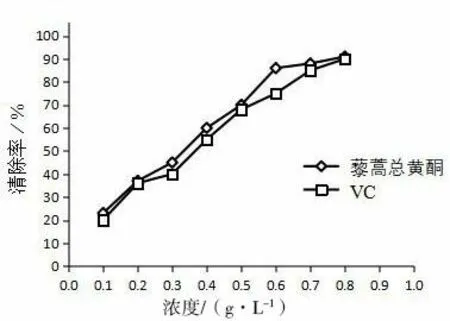
图6 藜蒿总黄酮对OH 自由基的清除率
2.4.3 藜蒿总黄酮对DPPH 自由基清除能力
图7 为藜蒿黄酮和VC 清除DPPH 自由基能力曲线。由图7 可知,藜蒿黄酮在浓度0.1-0.8 g/L 范围内,对DPPH 自由基的清除能力随着浓度的增加有所提高,在0.1-0.3 g/L 浓度范围内,曲线较平缓,在0.3-0.7 g/L 浓度范围内,清除能力增加较快,在浓度达到0.8 g/L 时,黄酮对DPPH自由基的的清除率为77.32%,VC 对DPPH 自由基的的清除率为86.44%,黄酮的清除能力略低于VC。说明藜蒿总黄酮有一定的清除DPPH 自由基的能力。
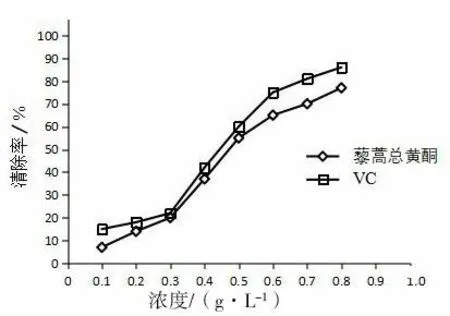
图7 藜蒿总黄酮对DPPH 自由基的清除率
3 讨论与结论
实验中通过单因素的考察与正交试验分析,发现提取温度对藜蒿总黄酮的提取影响较大。乙醇的沸点为78.31 ℃,因此采用乙醇为溶剂的萃取法的适宜温度应在乙醇的沸点左右。本实验得出最佳提取温度为80 ℃,这与其他植物总黄酮提取温度相近[9-11]。杨凌君等[12]同样采用醇提法研究了藜蒿叶中总黄酮的提取工艺优化,得到的最佳工艺参数为液固比15 mL/g、提取温度70 ℃、提取时间1.5 h,与本研究的结果相接近。此外,抗氧化活性结果显示:藜蒿整株提取的总黄酮对DPPH、OH 自由基具有良好的清除能力,并且具有一定的总还原能力,谢星等[13]和Zhang 等[14]的研究结果也证明了这一点。
藜蒿为药食两用新资源,富含多种对人体健康有利的营养活性成分,有望用作天然绿色的抗氧化剂。因此,有必要进一步研究其抗氧化的作用机制以及提取工艺,为藜蒿的开发利用提供依据。

