基于冠状动脉造影测定微循环阻力指数的研究进展
郑文 黄鑫 赵雪东
冠状动脉树由作为容量血管的心外膜动脉和作为阻力血管并调节冠状动脉血流和营养代谢的微循环(包括前微动脉、微动脉、毛细血管和微静脉,直径<500 μm)组成[1],所以即使心外膜动脉通畅,冠状动脉微循环的中断仍会导致心肌灌注受损[2]。目前,越来越多的研究认识到冠状动脉微血管功能障碍(coronary microvascular dysfunction,CMD)在心肌缺血和心绞痛中起着关键致病作用,与负性预后显著相关[3-4]。因此,准确识别CMD和定量评估微循环功能对疾病严重程度分层和治疗指导有重要意义。
由于微循环尺寸小和成像技术空间分辨率所限,对CMD的直接评估具有一定困难,临床上多通过测量冠状动脉血流储备(coronary flow reserve,CFR)、微循环阻力指数(index of microcirculatory,IMR)等指标来评估微循环功能。CFR是基于压力或多普勒血流测定的功能学定量指标,受到心外膜动脉和微循环的共同影响,任何部位造成的血流缓慢均可表现为该指标降低,且重复测量性差。仅在无心外膜动脉阻塞时,CFR降低是存在CMD的标志。与CFR不同,IMR仅为反映微循环阻力高低的“指数”,与冠状动脉真实微循环阻力有良好的相关性,内在变异性和受血流动力学影响小,测量重复性高,且不受心外膜动脉狭窄程度影响,可用于独立评估冠状动脉微循环阻力大小[5],是目前使用侵入性技术评估CMD的最客观的指标。但常规实践中,应用压力导丝测定IMR仍非常有限,这是由于需要额外的操作时间、成本和技术复杂性,且与充血剂的不良反应相关。因此,近期多项研究使用基于冠状动脉造影计算的IMR(本文称为IMRangio)以替代压力导丝测量[6-8]。本文将对这一技术原理和进展进行综述。
1 IMRangio的计算原理
1.1 定量血流分数(quantitative flow ratio,QFR)的测定
缺血是冠状动脉血运重建的最佳指标[9],血流储备分数(fractional flow reserve,FFR)是导管室中进行冠状动脉生理病变评估和缺血检测的金标准。尽管有大量的指南推荐和证据支持,FFR在冠状动脉疾病诊断评估中使用率很低。随着计算流体力学的发展,多个研究团队开发了基于冠状动脉造影计算FFR的方法,即QFR,无需使用压力导丝和充血剂,弥补了FFR应用中的不足[10]。QFR是基于三维定量冠状动脉造影分析,通过计算机快速计算得到冠状动脉压力差,其已被证明与FFR具有良好的相关性,且在评估冠状动脉狭窄的缺血性能方面似乎优于血管造影[11]。QFR测定方法包括离线和实时在线两种,以预设速度(如15帧/s或30帧/s)注射对比剂,获得病变部位两幅投射角度≥25°的图像,对该病变进行三维定量分析,计算管腔的狭窄百分比、病变长度、最小管腔直径、参考血管近端和远端直径以及面积狭窄百分比,再用相应的计算机软件模拟测定压力曲线,根据选取的管腔两端的压力,即冠状动脉远端压力(Pd)与冠状动脉近端压力(Pa)的比值来计算QFR的数值[10]。QFR是评估心外膜血管段缺血的一个指标,不能直接评估冠状动脉微循环。
1.2 IMRangio的测定
微循环阻力可以用微循环两端的压力差与微循环血流之比表示,当静脉端压力低,近似为零,当微循环血流约等于心外膜冠状动脉血流条件成立时,可以简化为心外膜(Pd)和心外膜血流的比,且心外膜血流速率与流经固定距离的耗时成反比,即微循环阻力与心外膜(Pd)和指示剂平均通过时间(Tmean)的乘积成正比。该乘积可作为反映微循环阻力高低的指数,即IMR。临床上通常采用冠状动脉内热稀释技术测定IMR,即在基础状态和最大充血状态下,分别向冠状动脉内注射3 ml室温生理盐水作为指示剂获得相应热稀释曲线,根据曲线记录液体两温敏感受器之间的时间(Tmean);导丝送达心外膜冠状动脉远端,记录压力感受器读数(Pd),即可得到IMR[12]。

2 IMRangio与IMR
2.1 相关性评估
在接受直接经皮冠状动脉介入治疗(p r i m a r y percutaneous coronary intervention,PPCI)的ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者中,IMR的评估可预测微血管损伤和左心室重构的程度[14]。De Maria等[7]纳入45例接受PPCI的STEMI患者。在支架置入前和PPCI完成时,测量梗死相关动脉(infarction related artery,IRA)病变段的IMR。同时,留取充血期间两幅投射角度≥25°的病变血管造影,以测量QFR并计算IMRangio。其中的15例患者,在非IRA中也测量了IMR和IMRangio。在总共92处病变中,IMR测量值与IMRangio计算值显著相关(r=0.85,P<0.001)。分别分析37个PPCI前的IRA(r=0.73,P<0.001)、40个PPCI后的IRA(r=0.88,P<0.001)及15个非IRA(r=0.64,P=0.009)病变时,IMR与IMRangio两者均显著相关。Scarsini等[6]在后续研究中入选了145例冠心病患者,包括STEMI 66例、非ST段抬高型急性冠状动脉综合征(non-ST-segment elevation acute coronary syndrome,NSTE-ACS)43例及稳定性冠心病(stable chronic coronary syndrome,CCS)36例,对其189支冠状动脉血管中进行了246次基于压力导丝的IMR测量,并测量QFR计算IMRangio,结果显示,IMRangio与IMR显著相关(总体r=0.78,P<0.0001;STEMIr=0.85,P<0.0001;NSTEACSr=0.72,P<0.0001;CCSr=0.70,P<0.0001)。Ai等[8]从三家中心入选了56例冠状动脉造影提示冠状动脉无显著狭窄的心绞痛患者(ischemia with no obstructive CAD,INOCA),对其57支冠状动脉血管进行了基于压力导丝的IMR测量和IMRangio计算,结果显示,IMR与IMRangio线性相关,IMRangio=0.590·IMR+13.4(r=0.746)。
2.2 IMRangio诊断性能
2019年欧洲心脏病学会慢性冠状动脉综合征专家共识认为IMR≥25 U是诊断CMD的标准之一[15],而无动脉粥样硬化患者的IMR常小于25 U[16]。IMRangio在预测IMR≥25 U方面具有良好的诊断性能,受试者工作特征曲线分析显示曲线下面积为0.919,最佳预测切点为IMRangio≥25 U(敏感度86.1%,特异度81.0%,阳性预测值88.6%,阴性预测值77.3%,诊断准确率84.2%)[8]。IMR>40 U与心力衰竭再住院及死亡风险增加相关[17],且PPCI时IMR>40 U与负性预后相关[18]。IMRangio在预测IMR>40 U方面具有良好的诊断性能[7],曲线下面积为0.96(95%CI0.92~1.00,P<0.001),最佳预测切点为40 U(敏感度83.0%,特异度100%,阴性预测值90.2%,阳性预测值96.8%,诊断准确率92.4%)。Choi等[13]发现Angio-IMR与IMR相关性良好(r=0.778,P<0.001),预测IMR>40 U的敏感度、特异度、准确性和曲线下面积分别为75.0%、84.2%、80.6%和0.899(95%CI0.786~0.949)。
3 IMRangio与微血管阻塞
对比剂延迟增强(late gadolinium enhancement,LGE)心脏核磁成像(cardiac magnetic resonance,CMR)通过钆对比剂流入及流出组织间隙过程中的对比度变化,对心肌组织定征,辨识CMD病理学进程中的微循环阻塞(microvascular obstruction,MVO)和心肌内出血[19]。MVO为LGE中高增强区域内的低信号区域,MVO>左心室质量的1.55%对预后有影响[20]。IMR能够预测晚期MVO,且随着IMR的增加,MVO指数增加[21]。在110例STEMI患者中,约三分之二患者的IMR与MVO一致[22]。49例接受PPCI的STEMI患者在出院前完善LGE,发现MVO>1.55%的患者较≤1.55%的患者IMRangio(41.0 U比27.4 U,P=0.008)更高,使用IMRangio预测MVO>1.55%的曲线下面积为0.76(95%CI0.61~0.91,P=0.007),具有可靠的诊断准确性[6]。
4 NH-IMRangio
4.1 NH-IMRangio与IMR的相关性
测量 IMR的过程中需要注射药物以达最大充血状态,为评估冠状动脉微循环的血管舒张能力及对药物的反应,Layland等[23]定义了一项描述冠状动脉微循环扩张能力的指标RRR(resistive reserve ratio),其计算方法为静息状态下的IMR/充血状态下的IMR。该研究发现STEMI患者的RRR显著低于稳定型心绞痛患者或非ST段抬高型心肌梗死患者,表明其血管扩张能力及对药物反应性更差。既然STEMI患者对腺苷等药物扩张反应差,是否可以在非充血状态下评估IMR?因此,Scarsini等[6]评估了NH-IMRangio与IMR的相关性,发现NH-IMRangio与IMR,在STEMI患者的IRA中显著相关(r=0.64,P<0.0001),在CCS患者中中度相关(r=0.33,P=0.018),在NSTE-ACS中无关(r=0.23,P=0.121)。在低RRR组(<2.18)中,NH-IMRangio与IMR具有良好的相关性(r=0.66,P<0.001),但在高RRR组中,两者相关性较低(r=0.36,P<0.001),而IMRangio与IMR在高、低RRR组中均保持良好的相关性。Kotronias等[24]在262例接受PPCI的STEMI患者中评估了NH-IMRangio(对比IMR>40 U)对CMD的诊断效应,曲线下面积为0.78(95%CI0.72~0.84,P<0.0001),最佳切点为43 U。Tebaldi等[25]评估的A-IMR的曲线下面积为0.76(95%CI0.61~0.88,P=0.0003)。见表1。
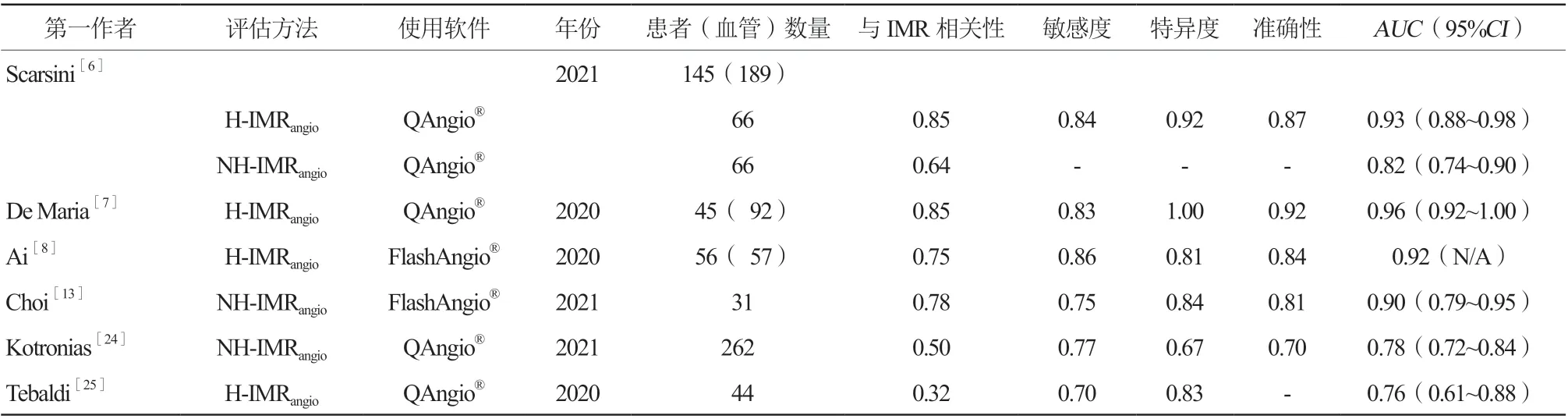
表1 不同研究中基于冠状动脉造影测定的IMR(对比基于压力导丝测定的IMR)的诊断效应比较
4.2 NH-IMRangio与IMRangio的联合评估
当NH-IMRangio<30 U时可排除IMR>40 U,阴性预测值达92.3%;当NH-IMRangio>90 U时可确定IMR>40 U,阳性预测值达93.3%。因此,可以使用NH-IMRangio与IMRangio联合评估IMR,即仅对NH-IMRangio值为30~90 U的患者评估IMRangio,可减少62%的腺苷使用[6]。
5 无创评估CMD方法
除了基于压力导丝的有创评估冠状动脉微循环功能方法,还可以通过无创方法(如核素、核磁、多普勒超声等)来评估冠状动脉微血管扩张功能,同时能够相对准确地测量心肌血流量(myocardial blood flow,MBF)。心脏正电子发射计算机断层成像技术(positron emission tomography,PET)通过静脉注射正电子示踪剂对整体和局部心肌血流量进行定量测量,示踪剂由心肌细胞主动提取(13N-氨和82Rb等)或在心肌中扩散(15O-水等),与血流量成比例。在CFR的测量中显示出与冠状动脉多普勒导丝结果的高度相关性(r=0.82)[26],但该技术存在空间分辨率低和辐射暴露等局限性。LGE-CMR使用钆作为对比剂测量MBF,可对整体和局部冠状动脉微血管扩张功能评估,与冠状动脉多普勒导丝测定结果高度相关(r=0.86)[27]。与PET相比,CMR无辐射,具有更高的空间分辨率,但数据处理较为复杂,因使用钆对比剂也不适于严重肾病患者。心脏PET和CMR是非侵入性CFR测量的最可靠方法,但由于耗时长、花费高,影响其临床大规模使用。心肌声学造影技术(myocardial contrast echocardiography,MCE)使用超声对比剂的分布来评估冠状动脉微循环灌注和MBF,其测定CFR与冠状动脉多普勒导丝结果高度相关(r=0.91)[28]。但到目前为止,该技术仅用于少数研究[29]。
6 小结
IMRangio是一种基于造影的无导丝IMR评估方法,是对基于压力导线测量IMR的一种可行替代,能够显著简化冠状动脉微循环功能评估流程,且在STEMI、NSTE-ACS及CCS患者中均与IMR具有较高的一致性和良好的诊断性能。对于STEMI的IRA,可以使用NH-IMRangio与IMRangio联合评估,节约评估时间,减少术中用药。对于INOCA患者,IMRangio可以作为一种可靠的评估诊断手段。
这种微创、可靠的微血管测量技术在缺血性心脏病的血运重建治疗策略选择中具有重要的临床意义和应用价值。此外,可能有助于推动CMD治疗手段的发展。目前该技术多集中在评估与压力导丝测量的一致性,缺乏预后研究,且多应用于STEMI患者,对于CCS患者证据有限。未来研究将会关注IMRangio与不良事件预后的相关性及INOCA人群的适用性等方向。
利益冲突 所有作者均声明不存在利益冲突

