新型鸭呼肠孤病毒动物感染模型的建立
罗 丹,刘 芮,高玉龙,李 凯,刘长军,祁小乐,崔红玉,张艳萍,潘 青,高 立*,王笑梅,2*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069;2.江苏省动物重要疫病与人畜共患病协同创新中心,江苏 扬州 225009)
2006 年在我国首次发现鸭脾坏死病(Duck spleen necrosis disease,DSND),该病是由新型鸭呼肠孤病毒(Novel duck reovirus,NDRV)引起的一种以鸭脾脏表面出血或坏死为病变特征的疾病[1-3]。自2017 年以来,DSND 在山东、江苏和河南等地区的养鸭场中时有暴发,有研究表明其致病性与先前报道的DSND 不同,呈不断变异和增强态势[4-6]。NDRV主要感染30 日龄以内的雏鸭,脾脏为其主要靶器官,感染日龄愈小,发病率和死亡率愈高。目前,该病已广泛存在于我国水禽饲养地区,给水禽养殖业带来严重经济损失[7-12]。
然而,目前尚无商业疫苗用于新型鸭呼肠孤病毒病的防控。随着NDRV 感染宿主范围和地理位置的不断扩大,NDRV 疫苗的研发愈发重要,而动物感染模型是评价疫苗效果的重要工具[13-18],但相关研究尚未见报道。本实验室前期流行病学调查和致病性研究表明,2019 年分离的以脾脏肿胀坏死为特征的SD19/6201 株为NDRV 流行代表株[7-8],因此本研究选用该病毒株建立了NDRV 的14 日龄和21 日龄雏鸭感染模型,确定了感染剂量、剖检时间及发病指标,为NDRV 疫苗免疫效果评价提供了实验依据。
1 材料与方法
1.1 主要实验材料NDRV SD19/6201 株(MT829205~MT829214)由本实验室保存。SPF 麻鸭购自国家禽类实验动物资源库,饲养于负压隔离器中,且本研究中涉及的所有动物实验均已获得黑龙江省动物实验伦理委员会批准,并按照科学技术部的《实验动物指南》以及动物道德准则和批准的规程操作。
TRIzol、Premix ExTaq(Probe qPCR)均购自宝生物工程(大连)有限公司;M-MLV Reverse Transcriptase 购自Invitrogen 公司。
1.2 NDRV 动物感染试验将120 只1 日龄SPF 雏鸭随机分成6 组(1~4 组为感染组、5~6 组为对照组),每组20 只,饲养于负压隔离器中。将SPF 雏鸭饲养至14 日龄时,组1 和组2 分别按105.0ELD50/0.1 mL/只和106.0ELD50/0.1 mL/只剂量经腿部肌肉接种NDRV SD19/6201 株,组5 对照组经腿部肌肉接种0.1 mL PBS;将SPF雏鸭饲养至21日龄时,组3和组4分别按105.0ELD50/0.1 mL/只、106.0ELD50/0.1 mL/只剂量经腿部肌肉接种NDRV SD19/6201 株,组6 对照组经腿部肌肉接种0.1 mL PBS。采用隔离器饲养,保证充足的饮水、采食和光照。
1.3 NDRV 感染SPF 鸭临床症状及剖检变化1.2中SPF 雏鸭感染后每天早晚各观察一次,记录发病和死亡情况,连续观察7 d。分别在感染后第5 d(5 dpi)、7 dpi 自各组中随机选取10 只雏鸭,颈静脉放血迫杀后剖检并观察脾脏有无肿胀、出血点(斑)或黄白色坏死灶等病理变化。
1.4 NDRV 感染SPF 鸭脾脏组织病理学观察将分别于感染后第5 d、7 d 采集的各组SPF 雏鸭的脾脏组织一部分按常规方法固定于福尔马林溶液,制作病理切片,进行组织病理学观察分析。另一部分-20 ℃保存备用,用于后续病毒载量的检测。
1.5 各组鸭脾脏指数的测定在5 dpi、7 dpi 分别取6 组各其余10 只,称重后放血剖杀,采集脾脏称重,计算脾脏比重和脾脏指数(脾脏比重=脾脏重/体重,脾脏指数=感染组脾脏比重/对照组脾脏比重)。试验数据以±s表示,采用GraphPad Prism 8 双因素方差分析方法(Two-way-ANOVA)进行统计学分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。
1.6 各组鸭脾脏病毒载量检测取1.4 中采集的各组雏鸭脾脏组织各1 g,研磨破碎后采用TRIzol 试剂进行病毒RNA 提取,利用M-MLV Reverse Transcriptase 反转录试剂盒将其反转录为cDNA,以其为模板,采用文献[19]中NDRV 荧光定量引物和探针,参照文献[20]中TaqMan 荧光定量RT-PCR 方法对各组雏鸭脾脏中的病毒载量进行测定,每个样品重复3次,并对其进行统计学分析。
2 结 果
2.1 NDRV 感染SPF 鸭临床症状及剖检变化将NDRV SD19/6201 株分别感染SPF 雏鸭后观察雏鸭临床症状及剖检变化。结果显示,感染组雏鸭均表现为喜卧、精神稍有沉郁等临床症状,无死亡,对照组无明显异常。剖检观察可见,各感染组发病鸭脾脏出现肿大、表面有出血斑或坏死灶等特征性病变,而其他脏器和对照组各脏器均无明显眼观病变(图1)。将脾脏出血或坏死等特征性病变作为NDRV 感染雏鸭的发病指标,各组发病比率统计见表1。

表1 NDRV感染鸭的发病率统计Table 1 Morbidity of animals infected with NDRV
14 日龄感染雏鸭,5 dpi 时低剂量感染组雏鸭剖检病变以脾脏出血点/斑为主,脾脏病变比率为70%(图1A);高剂量感染组所有雏鸭脾脏均出现黄白色坏死灶,脾脏病变比率为100%。7 dpi 时雏鸭脾脏病变更加严重,甚至个别脾脏完全坏死,低高剂量组脾脏的病变比率分别为80%和90%。
与14 日龄雏鸭相比,21 日龄雏鸭感染后脾脏剖检病变较轻(图1),低剂量感染组雏鸭在5 dpi 和7 dpi 脾脏出现肿大、出血或坏死的比率明显低于相同剂量的14 日龄雏鸭感染组;高剂量感染组雏鸭在5 dpi 和7 dpi 脾脏出现出血、坏死的比率均为80%,但7 dpi 脾脏黄白色坏死灶病变较5 dpi 更明显。各对照组雏鸭未见异常,剖检脾脏无任何病变(图1B)。
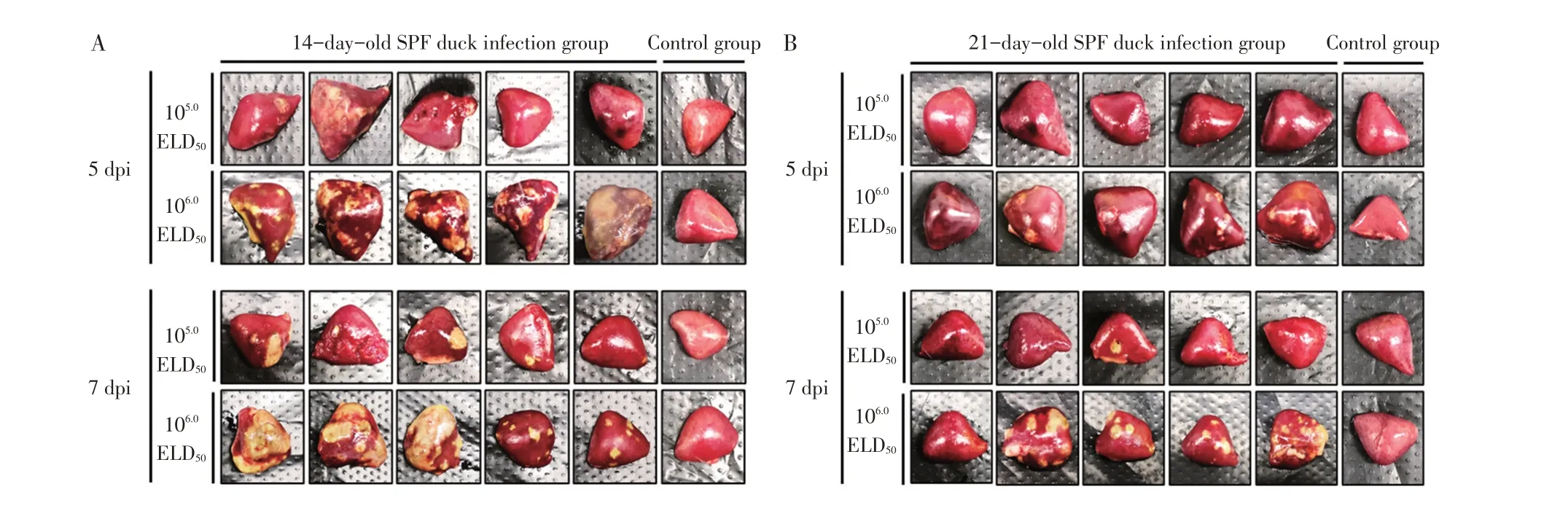
图1 NDRV感染雏鸭的脾脏剖检病变Fig.1 Spleen lesion of ducklings infected with NDRV
以上结果表明,NDRV 感染引起的脾脏病变程度与感染鸭日龄呈负相关,与21 日龄雏鸭感染组相比,14 日龄雏鸭对NDRV 更易感,表现为感染雏鸭脾脏发病率更高,脾脏眼观病变更严重。
2.2 NDRV 感染SPF 鸭脾脏组织病理学观察在5 dpi、7 dpi 采集各组SPF 鸭的脾脏组织,制作病理切片后观察组织病变,结果显示感染组鸭均可见脾脏红白髓界限不清,淋巴细胞数量减少,异嗜细胞浸润,呈局灶性坏死等。其中在7 dpi 时,高剂量感染组14 日龄雏鸭脾脏局部出现大面积坏死,伴随蛋白样渗出,巨噬细胞增生(图2B、图2C),21 日龄雏鸭脾脏组织内淋巴细胞大量减少,脾脏红髓可见异嗜细胞增生。对照组鸭脾脏组织正常。上述结果显示,与14 日龄雏鸭感染组相比,21 日龄雏鸭感染组脾脏组织病变更轻(图2E、图2F),这与剖检病变一致。表明以脾脏剖检病变作为NDRV 感染模型发病指标具有科学性。
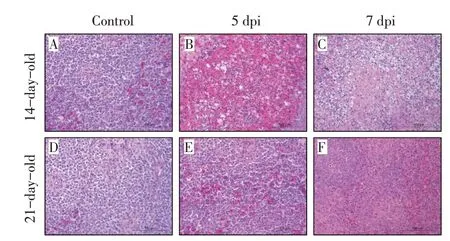
图2 高剂量NDRV感染雏鸭脾脏病理组织切片观察结果(标尺为100 μm)Fig.2 Results of histopathological section in spleen of the high dose NDRV infected ducklings(Scale is 100 μm)
2.3 各组鸭脾脏指数的测定结果各组鸭脾脏指数的测定结果显示,14 日龄和21 日龄感染雏鸭在5 dpi 脾脏指数显著或者极显著高于对照组(P<0.05 或P<0.001;图3A),在7 dpi 14 日龄雏鸭感染组脾脏指数与对照组脾脏指数无明显差异,但脾脏坏死症状并未恢复(图1A);在5 dpi 和7 dpi 时21 日龄感染雏鸭脾脏指数均显著或者极显著高于对照组(P<0.05,P<0.01 或P<0.001;图3B),但脾脏肿胀程度7 dpi 时较5 dpi 减轻。以上结果表明,NDRV 可引起感染雏鸭脾脏肿大,随着感染时间的推移脾脏肿大程度变轻,但其坏死症状并未恢复。
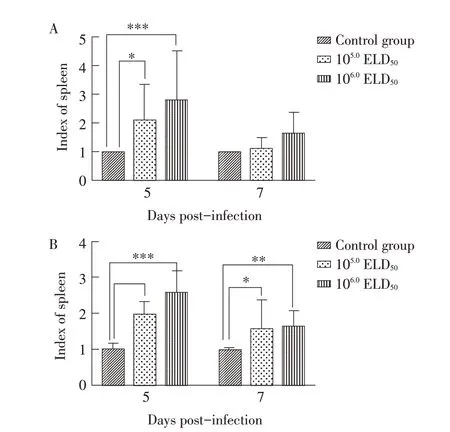
图3 NDRV感染后不同时间鸭的脾脏指数Fig.3 Index of spleen at different time points after NDRV infection
2.4 各组鸭脾脏病毒载量检测结果利用荧光定量PCR 检测方法对靶器官脾脏进行病毒载量的检测,结果显示,在5 dpi 即可在各组感染雏鸭脾脏中检测到大量病毒,且高剂量感染组雏鸭脾脏中病毒载量高于低剂量感染组雏鸭;在5 dpi 时14 日龄雏鸭(低日龄)各剂量感染组病毒载量明显高于21 日龄雏鸭(高日龄)各剂量感染组;在7 dpi,除21 日龄高剂量感染组雏鸭脾脏中病毒载量稍高于5 dpi 外,其余各剂量感染组脾脏病毒载量均明显低于5 dpi(图4)。

图4 NDRV感染雏鸭脾脏病毒载量的检测Fig.4 Detection of viral loads in spleen of the NDRV infected ducklings
以上结果显示,NDRV 在低日龄雏鸭脾脏中复制滴度明显高于高日龄雏鸭,表明NDRV 在低日龄雏鸭脾脏中的复制能力更强,这可能是造成NDRV在不同日龄雏鸭上致病性差异的原因,即随着雏鸭日龄的增大而对该病原易感性降低,抵抗力增强。
2.5 NDRV 动物感染模型评价指标的确定通过以不同剂量NDRV 感染不同日龄雏鸭,以雏鸭脾脏特征性出血或坏死作为NDRV 感染的发病指标,统计其发病率,确定了NDRV 对14 日龄雏鸭的最佳感染剂量为105.0ELD50/0.1 mL,对21 日龄雏鸭的最佳感染剂量为106.0ELD50/0.1 mL,最佳迫杀时间均为7 dpi,此时脾脏黄白色坏死灶明显,脾脏病变比率可达80%(8/10)。
3 讨 论
NDRV 感染是严重危害我国水禽业健康发展的重要传染病之一。近年来,针对该病原的疫苗研发是目前的关注点,但如何对相关疫苗效果进行评价,一直是限制该病疫苗研发的瓶颈,而NDRV 动物感染模型的建立是评价疫苗效果的关键。本实验室前期分离获得9 株NDRV,对其主要保护性抗原基因σC 的遗传进化分析表明,NDRV SD19/6201 株为当前流行代表株[7-8]。因此本研究以该病毒株建立动物感染模型具有普适性。
NDRV 对雏鸭的致病与其日龄呈负相关,即雏鸭感染日龄越大,病毒对其致病性越弱[21]。基于该病原特点,应尽量选择小日龄雏鸭进行动物感染试验。本实验室前期研究发现,NDRV 感染1 日龄雏鸭后的10 d~14 d 为抗体高水平期,之后抗体水平开始下降[8]。李静等将NDRV-SDYC 株作为疫苗株,制备油乳剂灭活疫苗免疫1 日龄雏鸭后5 d 开始产生抗体,14 d 和21 d 为抗体高水平期[22],这与本实验室前期研究结果基本一致。NDRV 主要侵害30 日龄以内的雏鸭,为了使其高峰抗体水平可覆盖整个易感期,所以常在1 日龄或7 日龄免疫NDRV 候选疫苗,免疫后14 d 或21 d 抗体水平较高,此时进行攻毒保护试验,评价疫苗免疫效果较合理。因此,本研究以不同剂量NDRV SD19/6201 株感染14 日龄和21 日龄雏鸭,建立了NDRV 对14 日龄和21 日龄雏鸭的感染模型。
有研究报道湖北地区的鸭呼肠孤病毒感染主要以脾脏和法氏囊坏死为主要特征[23];广西、山东、广东及江苏等地的NDRV 分离株主要引起雏鸭脾脏肿大和坏死[24]。由于靶器官脾脏是NDRV 检测和分离的首选脏器[25-26],因此,雏鸭脾脏的病理变化是该病原感染模型建立的主要依据,雏鸭脾脏出血或坏死的特征性病变可作为NDRV 感染雏鸭的发病指标。本实验室前期在1 日龄雏鸭上开展了NDRV 的动物感染试验,分别在1 dpi、3 dpi、5 dpi、7 dpi、10 dpi、14 dpi 对雏鸭进行剖检观察可见,在1 dpi~3 dpi 雏鸭脾脏病变以出血、肿胀为主,病变轻微;在5 dpi~10 dpi 雏鸭脾脏病变最严重,特别是在7 dpi和10 dpi,脾脏病变以黄白色坏死点、斑为主;在14 dpi 雏鸭脾脏坏死斑病变有所恢复,病变较轻微[8]。鉴于上述实验结果,在本研究选择5 dpi 和7 dpi 2 个迫杀时间点进行观察,最终确定了最佳迫杀时间为7 dpi,各感染组脾脏病变以黄白色坏死灶为主,能够保证发病率统计的准确性。与SD19/6201 株感染21日龄雏鸭相比,病毒感染14 日龄雏鸭脾脏出现出血或坏死的比率更高、病变更明显,且脾脏病理变化更严重。提示14 日龄雏鸭对NDRV 更易感。Li 等人将NDRV 接种21 日龄樱桃谷鸭的致病性试验结果显示,21 日龄樱桃谷鸭对NDRV 有很强的抵抗力[27]。本研究中21 日龄雏麻鸭对NDRV 的感染也呈现出一定的抵抗力,但106.0ELD50/0.1 mL/只的高接种剂量也能引起21 日龄雏麻鸭脾脏出现80%的病变比率,这可能与不同NDRV 分离株的致病力和被感染鸭的品种有关。本研究初期也曾尝试建立6 周龄麻鸭的NDRV 感染模型,但该日龄麻鸭感染NDRV 后无任何临床症状,各器官特别是靶器官脾脏也无任何剖检变化,进一步体现了该病原与鸭日龄呈负相关的致病特点,随着鸭子日龄的增大对该病原的易感性明显降低,抵抗力明显增强。
综上,结合NDRV 的致病特点,本研究确定了NDRV 对14 日龄雏鸭的最佳感染剂量为105.0ELD50/0.1 mL/只,21 日龄雏鸭最佳感染剂量为106.0ELD50/0.1 mL/只,最佳迫杀时间均为7 dpi,以脾脏出血、坏死为发病指标,病变率为80%(8/10)。本研究首次建立了NDRV 对不同日龄雏鸭的动物感染模型,该感染模型评价指标直观,可操作性强,也便于基层推广应用,为DSND 相关疫苗质量标准的研究提供重要依据。

