大肠杆菌噬菌体Bp4尾部蛋白在宿主识别中的作用研究
李兴健,孙蓉蓉,张 灿,刘文华,邹 玲,任慧英
(青岛农业大学动物医学院,山东 青岛 266109)
近年来,养殖业对抗生素过度依赖造成了抗生素的滥用,导致多重耐药性细菌的相继出现,已经严重威胁到行业的健康发展甚至人类健康。噬菌体作为细菌的天敌,可特异性杀菌,且其杀菌作用迅速、不受细菌耐药性的限制、无毒副作用,受到医学和兽医临床的普遍重视[1]。因此探究噬菌体感染细菌的机制,研制新型抗菌类药物刻不容缓。
根据形态可以将噬菌体分为3 大类:有尾噬菌体、丝状噬菌体和无尾噬菌体,其中有尾噬菌体占比96%[2]。根据噬菌体尾部结构的不同,又可以将有尾噬菌体分为长尾噬菌体、短尾噬菌体和肌尾噬菌体3 个科。不同噬菌体对同种宿主菌的吸附机制不同,同一噬菌体对同种细菌不同菌株的吸附机制也可能存在差异[3]。噬菌体尾部蛋白包括尾丝蛋白、尾刺蛋白、尾纤维蛋白等,负责对宿主细胞的识别和吸附[4],与噬菌体的吸附机制有关。
短尾噬菌体包括P22 类噬菌体、T7 类噬菌体和N4 类噬菌体等[5],本实验室分离的大肠杆菌短尾噬菌体Bp4 为N4 类噬菌体,经基因组注释发现其含有3 个尾部蛋白,即gp10(假定尾部蛋白)、gp11(尾丝蛋白)和gp13(尾刺蛋白),这3 个蛋白主要功能是负责对宿主受体的识别与吸附。但一般N4 类短尾噬菌体中无gp11和gp13基因[6]。研究结果显示, N4 类噬菌体中的gp65 是识别宿主菌受体所必需的,但在Bp4 中却未发现该类似基因[7]。这些结果显示噬菌体Bp4 和N4 类短尾噬菌体的尾部蛋白基因不同,表明噬菌体Bp4 具有与N4 类噬菌体不同的吸附机制,因此,明确该噬菌体在识别宿主菌过程中的主要吸附蛋白对研究噬菌体的裂解机制及改造噬菌体有重要的作用。
本实验室前期分离的多价噬菌体Bp4 为禽致病性大肠杆菌(APEC)的N4 类噬菌体,对该类细菌的裂解率达35%,可裂解O78、O88及O15等多种血清型的大肠杆菌[7],但其识别宿主受体的机制尚不明确。因此,本研究对噬菌体Bp4 的3 个尾部蛋白gp10、gp11 和gp13 进行相关研究,以明确Bp4 在宿主识别过程中起关键作用的尾部蛋白,为进一步研究噬菌体感染宿主的机制及拓宽噬菌体的宿主谱奠定实验基础。
1 材料与方法
1.1 主要实验材料噬菌体Bp4 及其宿主菌O78血清型大肠杆菌由青岛农业大学兽医微生物学研究室分离鉴定并保存。大肠杆菌BL21(DE3)菌株、原核重组表达载体pcoldTF 均由本实验室保存;未经免疫的家兔阴性血清由本实验室制备。
琼脂糖凝胶纯化回收试剂盒、高纯度质粒小提试剂盒购自康为世纪生物科技有限公司;DAB 试剂盒购自Biosharp 公司;牛血清白蛋白(BSA)、低分子量蛋白Marker 购自Solarbio 公司;T4 DNA Ligase、DL2000 DNA Marker、限制性内切酶NdeI 与EcoR I、HRP 标记羊抗鼠IgG(HRP-IgG)、鼠His 标签单克隆抗体(MAb)均购自宝生物工程(大连)有限公司;His标签蛋白纯化试剂盒购自碧云天生物技术公司。
1.2 尾部蛋白基因gp10、gp11、gp13的PCR 扩增按照文献[8],利用O78血清型大肠杆菌为宿主菌进行噬菌体Bp4 的增殖。参照GenBank 中噬菌体Bp4的全基因组序列(KJ135004.2),利用Primer Premier 5.0 软件设计分别针对尾部蛋白基因gp10、gp11、gp13的引物,并在其两端分别加入酶切位点NdeI和EcoR I(下划线表示)(表1)。
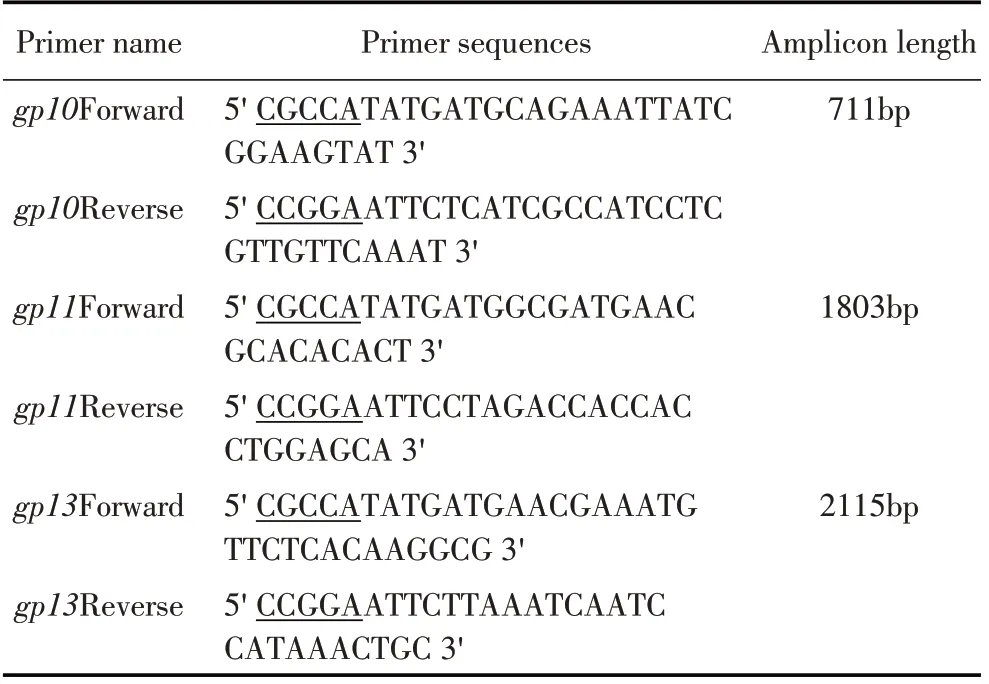
表1 噬菌体Bp4尾部蛋白基因的扩增引物Table 1 Primers of tail proteins of phage Bp4
1.3 重组表达质粒的鉴定及重组蛋白gp10、gp11、gp13 的表达以噬菌体Bp4 增殖液为模板,采用表1 中的相应引物,经PCR 扩增Bp4 尾部蛋白基因。扩增程序:94 ℃5 min;94 ℃1 min、55 ℃1 min、72 ℃1 min,30 个循环;72 ℃10 min。PCR 产物回收与纯化后分别克隆至经NdeI 和EcoR I 双酶切的表达载体pcoldTF 中,构建原核重组表达质粒pcoldTF-gp10、pcoldTF-gp11、pcoldTF-gp13,并分别经NdeI/EcoR I 双酶切和测序鉴定。将重组表达质粒转化BL21(DE3)感受态细胞,在含1%Amp的LB中培养至OD600nm约为0.6~0.8 时加入终浓度为0.01 mol/L的IPTG 诱导12 h,取上清经SDS-PAGE 检测后,以His 标签MAb(1∶1 500)为一抗,以羊抗鼠HRP-IgG(1∶3 000)为二抗,经western blot 鉴定各重组蛋白的表达,并设诱导后含空质粒的重组菌作为阳性对照。获得的重组蛋白分别命名为rgp10、rgp11 及rgp13。将各重组蛋白大量诱导表达并经His 标签蛋白纯化试剂盒纯化后,采用BCA 试剂盒分别测定各重组蛋白的含量。
1.4 各蛋白兔多克隆抗体的制备与效价的检测调整各重组蛋白浓度均为1.0 mg/mL,以201 油性佐剂与各重组蛋白混匀乳化后, 免疫家兔,2 mL/只。共免疫4 次,每次间隔一周。4 免后1 周采集各组家兔血清,采用琼脂免疫双向扩散试验[9]测定针对gp10、gp11、gp13 的抗体效价,选择效价达1∶4 以上的抗血清用于后续试验。将制备的gp10、gp11、gp13 的兔多克隆抗体分别命名为anti-gp10、antigp11 和anti-gp13。
1.5 尾部蛋白竞争吸附试验检测噬菌体Bp4 吸附宿主菌的关键蛋白利用双层平板法[6],将200 μL O78型大肠杆菌悬液(8×109cfu/mL)分别与200 μL 浓度为1.0 mg/mL 纯化的rgp10、rgp11 与rgp13 混合,对照组加入200 μL LB 肉汤,37 ℃孵育10 min 后,加入100 μL 9×1010pfu/mL的噬菌体Bp4增殖液,37 ℃孵育5 min,将其与5 mL 的上层培养基混合并吹打均匀,倒在事先铺好并已凝固的下层培养基上。37 ℃培养12 h 后检测并计算各组噬菌斑的数量,按照公式:噬菌体相对吸附率=实验组噬菌斑数/对照组噬菌斑数×100%,计算噬菌体对大肠杆菌的相对吸附率。利用GraphPad Prism 6 软件作图,分析噬菌体Bp4 吸附宿主菌的关键蛋白。
1.6 尾部蛋白抗体阻断吸附试验检测噬菌体Bp4 吸附宿主菌的关键蛋白取100 μL 9×1010pfu/mL 的噬菌体增殖液分别与100 μL 不同尾部蛋白的抗血清(anti-gp10、anti-gp11、anti-gp13)37 ℃孵育5 min,以阻断噬菌体对大肠杆菌的吸附。再加入200 μL 8×109cfu/mL 大肠杆菌菌增殖液,37 ℃作用5 min,以未免疫家兔的阴性血清为对照,参照1.5 中双层平板法检测计算,并分析噬菌体Bp4 吸附宿主菌的关键蛋白。
1.7 数据的统计分析1.5、1.6 试验中两组间的差异性通过Student's t-test 检验,P>0.05 表示差异不显著,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结 果
2.1 重组表达质粒的双酶切鉴定及重组蛋白的表达鉴定结果以噬菌体Bp4 的基因组为模板,PCR 扩增其尾部基因gp10、gp11及gp13,分别克隆至pcoldTF 载体中,构建原核重组表达质粒pcoldTFgp10、pcoldTF-gp11 及pcoldTF-gp13。重组质粒经双酶切鉴定结果显示,分别出现711 bp、1 803 bp、2 115 bp 的目的条带及5 733 bp 的载体条带(图1)。测序结果均与预期一致,表明正确构建了上述3 种尾部蛋白基因重组表达质粒。将重组菌pcoldTFgp10/BL21、pcoldTF-gp11/BL21 和pcoldTF-gp13/BL21经IPTG 诱导表达后,以鼠His 标签MAb 为一抗,羊抗鼠HRP-IgG 为二抗,经western blot 鉴定结果显示,上述重组菌分别在79 ku、117 ku和126 ku处出现与预期大小相一致的特异性条带(图2A、图2B),表明rgp10、rgp11 及rgp13 在大肠杆菌中获得了表达。通过BCA 蛋白浓度检测试剂盒测得纯化蛋白的浓度均为3 mg/mL。
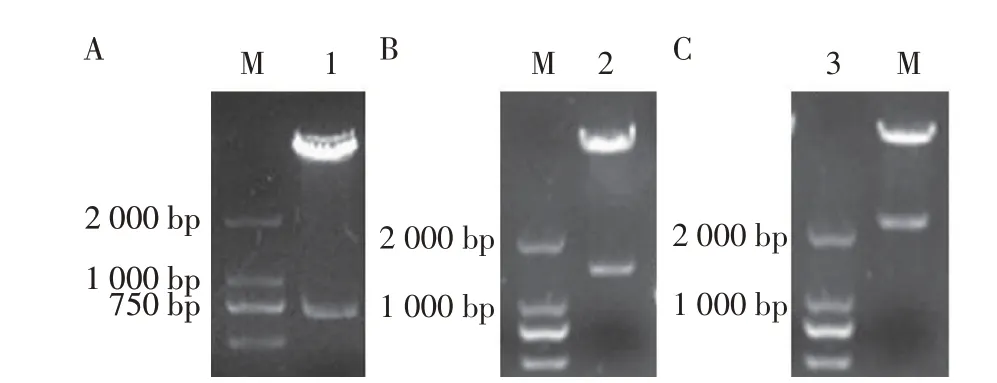
图1 重组表达质粒pcoldTF-gp10(A)、pcoldTF-gp11(B)及pcoldTF-gp13(C)的双酶切鉴定结果Fig.1 Double enzyme digestion results of pcoldTF-gp10(A),pcoldTF-gp11(B)and pcoldTF-gp13 recombinat plasmids(C)
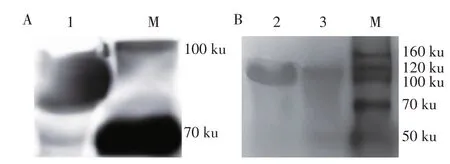
图2 重组蛋白的western blot鉴定(A、B)结果Fig.2 Western blot detection of recombinant protein(A,B)
2.2 各重组蛋白兔多克隆抗体的制备与效价的检测结果将各重组蛋白大量诱导表达并纯化后,将各重组蛋白免疫小鼠4 次后采血,采用琼脂免疫双向扩散试验检测各重组蛋白的效价。结果显示,获得的各重组蛋白兔抗血清anti-gp10、anti-gp11 和antigp13 的效价分别为1∶4、1∶8、1∶8,可以用于后续试验。
2.3 噬菌体尾部蛋白竞争吸附试验结果将O78型大肠杆菌分别与rgp10、rgp11 和rgp13 孵育10 min后,加入噬菌体Bp4 增殖液吸附5 min 后,经双层平板法检测并计数各组噬菌斑的数量,计算噬菌体对大肠杆菌的相对吸附率。结果显示,尾刺蛋白rgp13组中噬菌体对大肠杆菌的相对吸附率为0,与对照组差异极显著(P<0.01)。而尾部蛋白rgp10 组和尾丝蛋白rgp11 组中噬菌体对大肠杆菌的相对吸附率均为100%,均与对照组无差异(图3)。rgp13 在体外能够完全抑制噬菌体Bp4 对宿主菌的吸附,而rgp10、rgp11 不能抑制噬菌体Bp4 对宿主菌的吸附,表明rgp13 是噬菌体Bp4 吸附宿主菌受体的关键尾部蛋白。
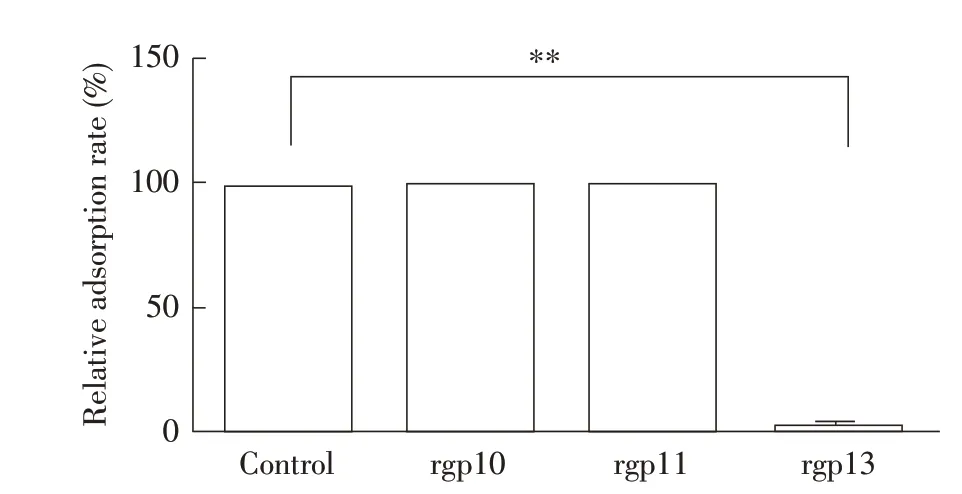
图3 各重组尾部蛋白对噬菌体Bp4的相对吸附率的影响Fig.3 Effect of recombinat tail proteins on the relative adsorption rate of phage Bp4
2.4 噬菌体尾部蛋白抗体阻断吸附试验结果分别利用制备的各重组蛋白抗血清与噬菌体Bp4 相互作用5 min 后,加入O78型大肠杆菌宿主菌吸附5 min,利用双层平板法检测并对各组噬菌斑计数,计算噬菌体对大肠杆菌的相对吸附率。结果显示,antigp11、anti-gp13组中的噬菌体对大肠杆菌的相对吸附率均为0,且与对照组相比差异均极显著(P<0.01)。而anti-gp10 组与对照组一样,其中的噬菌体对宿主菌的相对吸附率均为100%,即anti-gp10 不能够竞争噬菌体Bp4 对宿主菌的吸附(图4)。可见尾丝蛋白抗血清anti-gp11 和尾刺蛋白抗血清anti-gp13 在体外均能够完全竞争噬菌体Bp4 对宿主菌的吸附。这两种抗体与噬菌体尾部蛋白的特异性结合,使噬菌体尾部蛋白无法识别并结合受体,阻断了噬菌体对宿主菌的吸附,而尾部蛋白anti-gp10 则无该阻断作用。进一步表明尾刺蛋白gp13 是噬菌体Bp4 识别宿主菌的关键蛋白,而尾丝蛋白gp11 是影响噬菌体Bp4 识别宿主菌的重要蛋白。
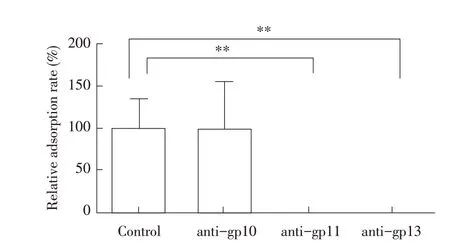
图4 各尾部蛋白的多克隆抗体对噬菌体相对吸附率的影响Fig.4 Effects of polycloned antibodies against tail protein gp10,gp11 and gp13 on the relative adsorption rate of phage Bp4
3 讨 论
噬菌体在对抗耐药菌感染中发挥越来越重要的作用。有尾噬菌体通过尾部蛋白与细菌表面受体的作用,引发噬菌体的感染及裂解过程[10]。噬菌体受体的特异性识别限制了噬菌体的裂解谱,目前主要利用噬菌体鸡尾酒扩大噬菌体制剂的裂解谱,以增强噬菌体临床应用的有效性[11]。通过噬菌体与宿主菌的相互作用研究,明确决定噬菌体感染细菌的主要尾部蛋白,将有利于改造噬菌体从而扩展其的宿主谱。本研究所用的噬菌体Bp4 为短尾噬菌体,属N4 类双链DNA 噬菌体,前期通过全基因组测序预测到其有3 个尾部蛋白,分别是假定尾部蛋白rgp10、尾丝蛋白rgp11 及尾刺蛋白rgp13,通过对噬菌体Bp4 这3 个尾部蛋白的研究,可以明确它们在噬菌体Bp4 吸附过程中的作用[12]。
本研究利用原核表达系统获得可溶性表达的噬菌体尾部蛋白rgp10、rgp11 和rgp13,纯化后,一方面用于尾部蛋白竞争吸附试验,检测噬菌体Bp4 吸附宿主菌的关键蛋白;另一方面将这3 种蛋白分别免疫家兔得到各蛋白的抗血清(多克隆抗体),用于尾部蛋白抗体阻断吸附试验中阻断噬菌体尾部蛋白与细菌的吸附[14],进一步确定噬菌体Bp4 吸附宿主菌的关键蛋白。根据噬菌体Bp4 的尾部结构及上述两个试验结果可知,宿主菌的受体与尾丝蛋白rgp13结合后,阻断了噬菌体对细菌的吸附,使噬菌体Bp4 无法与宿主菌结合;噬菌体Bp4 尾丝蛋白rgp11和尾刺蛋白rgp13 由于竞争性结合了制备的多克隆抗体(anti-gp11、anti-gp13),造成这两种尾部蛋白无法结合细菌受体,从而阻断了噬菌体Bp4 对宿主菌的吸附。而尾部蛋白rgp10 却不能影响噬菌体与宿主菌的结合,anti-gp10 也不能阻断噬菌体对宿主菌的吸附。这表明尾刺蛋白gp13 是噬菌体Bp4 关键的受体识别蛋白,尾丝蛋白gp11 是影响噬菌体与细菌结合的重要蛋白。综上所述,本研究确定了该噬菌体在与细菌结合的过程中,主要是由其尾刺蛋白gp13 识别吸附细菌受体。
不同类型噬菌体的感染机制不同,如本实验室前期分离保存的大肠杆菌肌尾噬菌体Bp7 为T4 类噬菌体,尾丝蛋白gp38 为其长尾丝末端的吸附蛋白,在噬菌体吸附宿主中发挥关键作用。而本研究证实尾刺蛋白gp13 是短尾噬菌体Bp4 吸附宿主的关键蛋白。可见,Bp4 和Bp7 虽均为大肠杆菌的噬菌体,其裂解谱有交叉,但各自也有许多特异的宿主菌。解析噬菌体的主要吸附蛋白及其关键位点和功能,将有助于改造噬菌体,扩大噬菌体的宿主谱。本研究在一定程度上弥补了大肠杆菌噬菌体对宿主菌裂解机制的空缺,并为噬菌体的临床治疗奠定基础。

