yihE对肠炎沙门菌生物学特性影响的研究
刘 畅,张雪佳,王利丽,白和平,王 苗,李 浩,刘勃兴,史秋梅,吴同垒,张志强
(河北科技师范学院河北省预防兽医学重点实验室,河北 秦皇岛 066004)
沙门菌(Salmonella)为革兰氏阴性肠道致病杆菌,常通过污染饮食引起人畜急性和慢性感染,临床症状主要表现为腹泻、伤寒、甚至败血症[1-2]。沙门菌主要通过消化道感染,在回肠远端经上皮细胞侵染黏膜下层的巨噬细胞、树突状细胞等具有吞噬活性的细胞,完成增殖并造成感染扩散。沙门菌感染的重要前提在于其能够抵御消化道极端pH 环境的杀伤、宿主细胞的活性氧杀伤以及机体极端的营养缺乏等环境应激[3],因此抗应激能力与沙门菌的致病性密切相关。沙门菌有多个毒力因子被证实与环境应激相关,其中yihE 是肠杆菌科细菌的一种丝氨酸/苏氨酸激酶[4]。在对大肠杆菌的研究中发现yihE 能够调控MazEF 毒素-抗毒素来保护细菌免受内环境微生物的侵袭,yihE 蛋白和细菌内部的活性氧(ROS)级联介导大肠杆菌耐受活性氧应激,yihE基因的缺失会导致细菌程序性死亡(PCD)[5];yihE 蛋白受到细菌内部双组分调节系统(CPX)的部分调节,该系统和MazEF 毒素、超氧化物一起对细菌产生保护或者破坏作用,yihE 蛋白在其中起主要的调节作用[6-10]。
有研究利用DNA array 方法研究yihE 功能,发现该蛋白能够调控沙门菌多达100 多种蛋白的表达,表明该蛋白是沙门菌重要的功能调控蛋白[4,8]。基于yihE 在抗环境应激和蛋白表达调控上的重要作用,推测该蛋白可能与沙门菌的致病过程密切相关,因此本研究通过构建肠炎沙门菌yihE基因缺失株和回补菌株分析yihE 对沙门菌的生物学特性的作用,为沙门菌致病机制的研究提供参考资料。
1 材料与方法
1.1 菌株、质粒及主要试剂质粒pKD3、pKD46、pCP20 由吉林农业大学康元环教授惠赠;肠炎沙门菌参考菌株C50336购自中国菌种保藏中心,由本研究室保存;pBR322质粒由扬州大学朱国强教授惠赠。
ID32E 试纸条为法国梅里埃公司产品。细菌RNA 提取试剂盒购自北京艾德莱生物科技有限公司;限制性内切酶及T4 连接酶均购自NEB 公司;刚果红、考马斯亮蓝、荧光增白剂、琼脂糖DNA 回收试剂盒均购自Tiangen 公司。
1.2λ-Red 同源重组引物的设计根据NCBI 中登录的肠炎沙门菌基因组序列(CP023475.1)设计引物(表1),P1/P2 用于扩增打靶片段,由两部分组成,5' 端加下划线的部分与待敲除基因序列同源,3' 端未加下划线部分与氯霉素抗性基因cat 两侧序列互补, P3/P4 引物位于yihE基因开放阅读框外侧,用于缺失株的鉴定。所有引物均由上海生工生物工程技术服务有限公司合成。

表1 PCR引物信息Table 1 PCR primer information
1.3 沙门菌C50336△yihE基因缺失株、回补株的构建参照文献[11],利用λ-Red 同源重组方法对yihE基因进行敲除。首先将pKD46 质粒电转入C50336后用(P1/P2)引物扩增pKD3质粒,将扩增产物电转入含pKD46 质粒的C50336,获得了含Cat 基因的缺失株,然后将pCP20 质粒电转入含Cat 基因的菌株中,以消除Cat 基因,获得了含pCP20 质粒的缺失株。然后将含pCP20 质粒的缺失株在42 ℃水浴5 h~6 h 后获得在LB 平板上生长,而不在含氨苄抗性的LB 板上生长的菌株,则为yihE基因缺失菌株C50336 ΔyihE(KO),对该菌株利用PCR 方法(P3/P4)鉴定。
利用煮沸裂解法提取C50336 的基因组作为模板,采用(P5/P6)引物,经PCR 扩增后的产物与pBR322 质粒同时进行双酶切并连接,构建重组质粒,转化至DH5α 感受态细胞,即获得含pBR322-yihE质粒的感受态细胞,经PCR鉴定的阳性重组子由上海生工生物工程技术服务有限公司测序验证无移码错位突变后,提取pBR322-yihE质粒,电转化至C50336ΔyihE菌株中,利用(P3/P4)引物进行PCR鉴定无误后即获得yihE基因回补株C50336ΔyihE/pBR322-yihE(RS)。
1.4 各菌株生长特性的检测参考文献[12],将C50336 菌株(WT)、KO 菌株、RS 菌株分别接种至LB、LBA液体培养基,37 ℃摇床中振荡培养过夜。次日将各菌株稀释至同一OD600nm值后,分别按1∶100 分别在LB、M9 液体培养基37 ℃振荡培养,每隔1 h吸取菌液,测定其OD600nm值,绘制其生长曲线,分析各菌株生长特性。
1.5 各菌株运动能力的检测参照文献[13]方法,分别将WT、KO、RS 菌株接种至LB 液体培养基,37 ℃振荡培养过夜。次日各取5 μL 菌液,穿刺接种半固体培养基平板的中心部位,避免剧烈晃动,37 ℃正置培养6 h 后,测量各菌株的运动直径,分析其运动能力,并重复试验3 次。
1.6 各菌株抗环境应激能力的检测参考文献[14],将WT、KO、RS 菌株分别在LB、LBA 液体培养基中培养至OD600nm值为1 时,按1∶100 的比例转接到具有酸性应激(pH4.0)、碱性应激(pH10.0)、氧化应激(10 mmoL/L H2O2)、热应激(42 ℃)、铁饥饿条件(200 μmmoL/L 2.2-联砒啶)、硝化应激(50 mg/L、100 mg/L、150 mg/L NaNO2)的条件下培养1 h,之后对其稀释、滴板计数,计算各菌株生存率,分析各菌株抗环境应激能力。
1.7 各菌株生化特性的检测分别将WT、KO、RS菌株接种至LB、LBA 液体培养基,37 ℃振荡培养过夜后PBS 洗涤两次,以每孔50 μL 加入ID32E 试纸条孔中,并在另外7 个孔内加入一滴矿物油,于湿盒内37 ℃培养24 h,在0.0 孔滴加JAMES 试剂,检测各菌株的吲哚反应。
1.8 各菌株生物被膜(BF)形成能力及其组分变化的检测参照文献[15],通过试管法和96 孔板微量法(OD570nm)分别检测WT、KO、RS 菌株的BF 形成能力。同时为了分析各菌株BF 的成分变化,将各菌株接种至刚果红(160 mg/L 刚果红、10 mg/L 考马斯亮蓝)培养基,28 ℃培养48 h,通过观察菌落状态和颜色来分析BF 的形成能力;另外参照文献[16],将各菌株分别接种于含有荧光增白剂(200 mg/L)的培养基,28 ℃培养48 h,在366 nm 的紫外线下比较菌落荧光强弱,分析各菌落BF 纤维素的含量。
1.9 各菌株耐药性检测参照CLSI 试验标准,利用K-B 纸片法检测WT、KO、RS 菌株对各抗生素的敏感性。
1.10 各菌株毒力因子的检测利用细菌RNA 提取试剂盒提取WT、KO 菌株的RNA 反转录为cDNA后作为模板,参照文献[23,24,25],利用RT-qPCR方法检测各菌株毒力基因invH、pipB、hflk、sopB、orf245、sipB、ompB、mrrl、rpos、ssrA、ssaV、qbcsa、sodC、tatA、rfbH、spvB、prot6E、fimD、mgtC、qcsgd、qcsga、sipA、flgG、XthA的转录水平。
1.11yihE基因缺失株致病力试验将55 只BALB/c小鼠随机均分为11 组,每组5 只,其中1~5 组为WT菌株感染组,6~10 组为KO 菌株感染组,第11 组为对照组。将37 ℃,180 r/min 振荡培养过夜的各菌株用等量的无菌PBS 洗涤后3 500 r/min 离心5 min,弃上清,PBS 洗涤3 次,平板计数,调整为同一浓度后梯度稀释,各稀释度按分组以200 μL/只感染,对照组小鼠注射等量的无菌PBS,记录14 d 实验组小鼠存活数量,无菌摘除死亡小鼠的肝脏和脾脏,分别在SS 固体平板划线验证,参照文献[17],利用寇氏法计算WT、KO 菌株的半数致死量(LD50),分析各菌株致病力。
1.12 突变后的yihE 的活性检测有研究结果显示,yihE 蛋白217 位天冬氨酸是其关键的活性位点,突变该位点的氨基酸有可能导致该蛋白酶失活[4]。因此本研究采用水煮法以肠炎沙门菌C50336 全基因为模板,分别利用P5/P7,P6/P8引物进行PCR扩增,产物后各取1 μL 为模板,采用引物P5/P6 进行PCR 扩增,扩增产物回收后与pET-28a 16 ℃过夜连接,转化E. coliDH5α 感受态细胞,经上海生工生物工程技术服务有限公司测序验证基因突变后,按常规方法诱导表达突变蛋白yihEA217G。将表达后的蛋白进行Ni柱纯化、透析后,利用蛋白质丝氨酸/苏氨酸激酶检测试剂盒进行蛋白激酶活性的检测。同时采用引物P5/P6 PCR 扩增C50336 菌株yihE基因,按上述方法鉴定并表达yihE 后作为阳性对照。
2 结 果
2.1 肠炎沙门菌C50336△yihE、 C50336△yihE/pBR322-yihE的构建利用同源重组的方法将肠炎沙门菌C50336 中的yihE基因缺失,获得基因缺失株C50336ΔyihE和基因回补株C50336ΔyihE/pBR322-yihE。各菌株PCR鉴定结果显示,野生株、基因缺失株和回补株扩增片段分别约为1 700 bp、1 100 bp 和1 700 bp,与预期一致(图1),表明已正确构建肠炎沙门菌缺失株C50336ΔyihE和回补株C50336ΔyihE/pBR322-yihE。
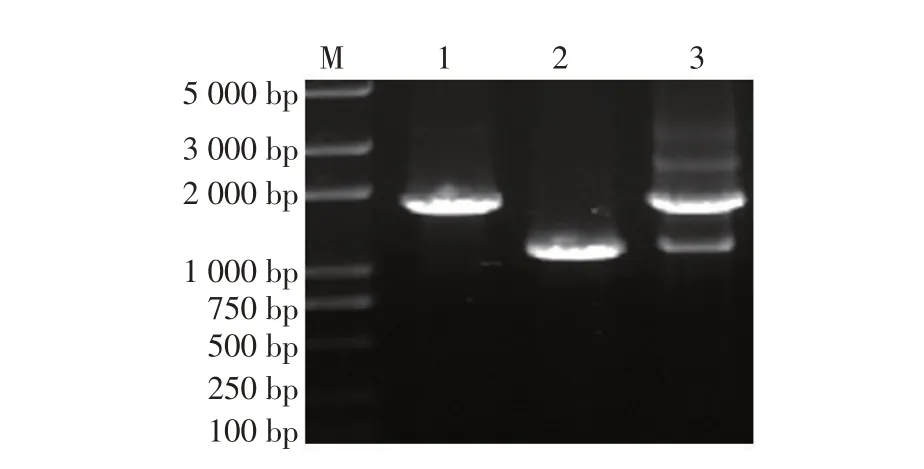
图1 肠炎沙门菌C50336ΔyihE及其回补株的PCR鉴定Fig.1 PCR identification of Salmonella enteritidis C50336 yihE gene deletion strain and complementary strain
2.2 各菌株生长特性的检测将WT、KO、RS 菌株分别在LB、M9液体培养基培养后检测OD600nm值,绘制生长曲线,结果显示,3株菌在LB(图2A)、M9(图2B)液体培养基中的生长速度均无明显差异。表明yihE的缺失对肠炎沙门菌的生长速率无影响。
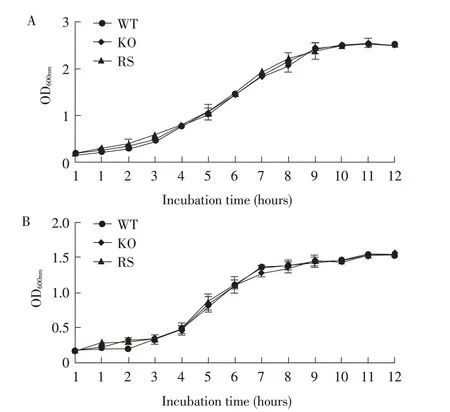
图2 各菌株生长曲线测定结果Fig.2 Test results of growth curves of strains to be tested
2.3 各菌株运动能力的检测将WT、KO、RS 菌株通过分别接种半固体培养基检测其运动能力,结果显示,WT、KO、RS 菌株的运动直径分别为1.8±0.2 cm、1.6±0.2 cm、2.2±0.2 cm,各菌株之间差异不显著(图3)。表明yihE基因缺失不影响肠炎沙门菌的运动能力。
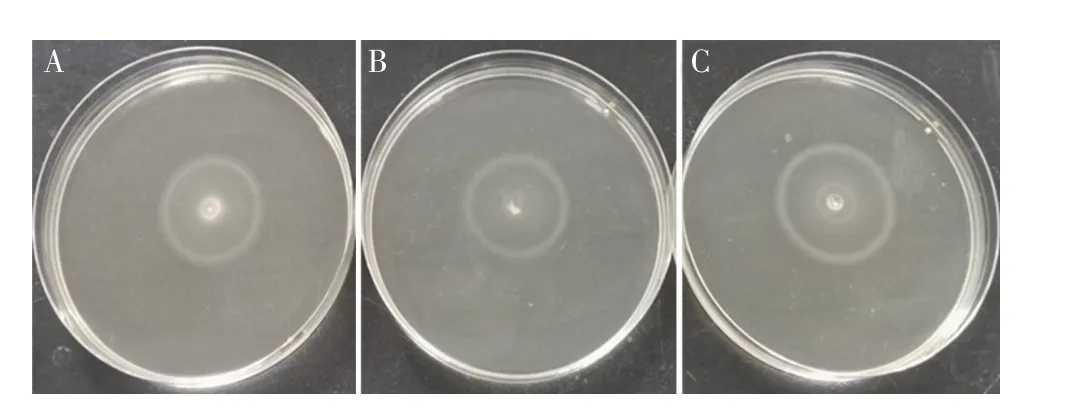
图3 各菌株运动能力的测定Fig.3 Determination of the motility of the strains to be tested
2.4 各菌株抗环境应激能力的检测将WT、KO、RS 菌株在各种应激条件下培养,检测各菌株生存率,结果显示,KO 菌株在各种条件下的耐受能力比WT、RS 菌株有极显著的下降(P<0.01 或P<0.001,图4),表明yihE 参与和调控沙门菌对抗酸性应激、碱性应激、铁饥饿条件、热应激、氧化应激、硝化应激。
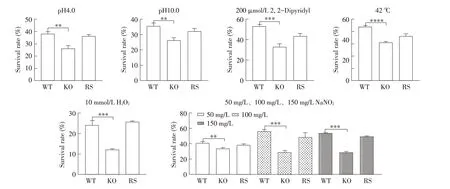
图4 环境应激对各菌株存活率的影响Fig.4 The influence of environmental stress on the survival rate of tested strains
2.5 各菌株生化鉴定结果利用ID32E 试纸条测定WT、KO、RS 菌株的生化特性,结果显示,与WT、RS 菌株相比,KO 菌株参与肠炎沙门菌对半乳糖酸盐的利用,影响沙门菌葡萄糖苷酶、葡萄糖醛酸酶的表达,这些生化指标均与生物体糖代谢相关。表明yihE 可能参与肠炎沙门菌的糖代谢过程。
2.6 BF 形成能力的检测将WT、KO、RS 菌株经试管法和96 孔板微量法检测BF 形成能力,试管法定性检测结果显示,相对于WT、RS 菌株,KO 菌株在气液交界处形成的BF 明显少于野生株(图5A);96 孔板定量检测(570 nm)结果显示,相对于WT、RS 菌株,KO 菌株的BF 的形成能力下降了约50%(图5B)。表明yihE 参与肠炎沙门菌的BF 形成机制。
将WT、KO、RS菌株接种刚果红琼脂板,观察菌落的生长形态和颜色,结果显示,WT、KO、RS 均能够在刚果红的琼脂板上形成粗糙的带有明显褶皱的红色菌落(图5C),表明yihE基因缺失不能降低肠炎沙门菌BF 成分中卷毛蛋白的形成。
将WT、KO、RS 菌株接种含荧光增白剂的琼脂板,在366 nm 的紫外线下观察菌落的荧光情况,结果显示,WT 和KO 菌株的荧光发光强度均一致(图5D),表明yihE基因缺失不能降低肠炎沙门菌BF 成分中纤维素的合成。
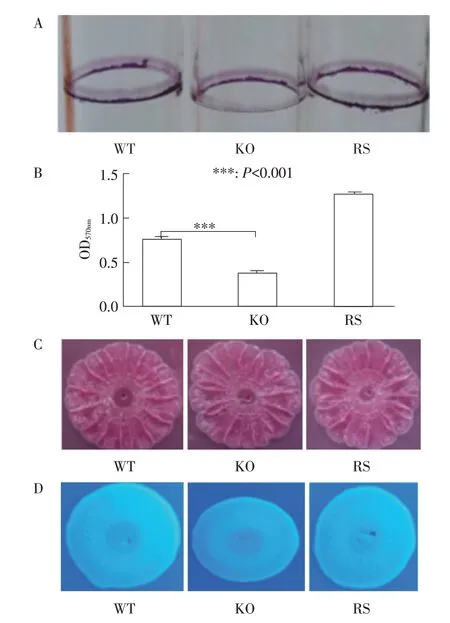
图5 各菌株BF的形成及成分分析Fig.5 The formation and composition analysis of the biofilm of the strain to be tested
2.7 各菌株耐药性检测利用K-B 纸片法检测WT、KO、RS 菌株的耐药情况。结果显示,在内酰胺类药物中,KO、RS 菌株对头孢曲松的敏感性增加,且抑菌圈直径也比WT 菌株的大;在喹诺酮类药物中,KO 菌株比WT、RS 菌株药物敏感性强,且抑菌圈直径也比WT、RS 菌株的大;而对于其他测试的抗生素的敏感性基本保持一致。表明yihE 能够影响肠炎沙门菌对喹诺酮类、头孢曲松药物的敏感性。
2.8 各菌株毒力因子的检测利用RT-qPCR 定量检测WT 和KO 菌株的毒力基因的转录水平,结果显示,在检测的24 个毒力基因中,KO 菌株与WT 菌株相比,大部分毒力基因的转录水平有所上升,小部分毒力基因的转录水平下降,二者上调程度的差异性均基本相同,其中csgA、bscA、flgG、sipB、sodc基因的转录水平上调或下调差异极显著(P<0.001),其他毒力基因的转录水平差异较小(图6)。可见yihE通过相对表达量的变化间接调控细菌的致病机制,表明yihE 是一种影响肠炎沙门菌毒力的多功能蛋白。
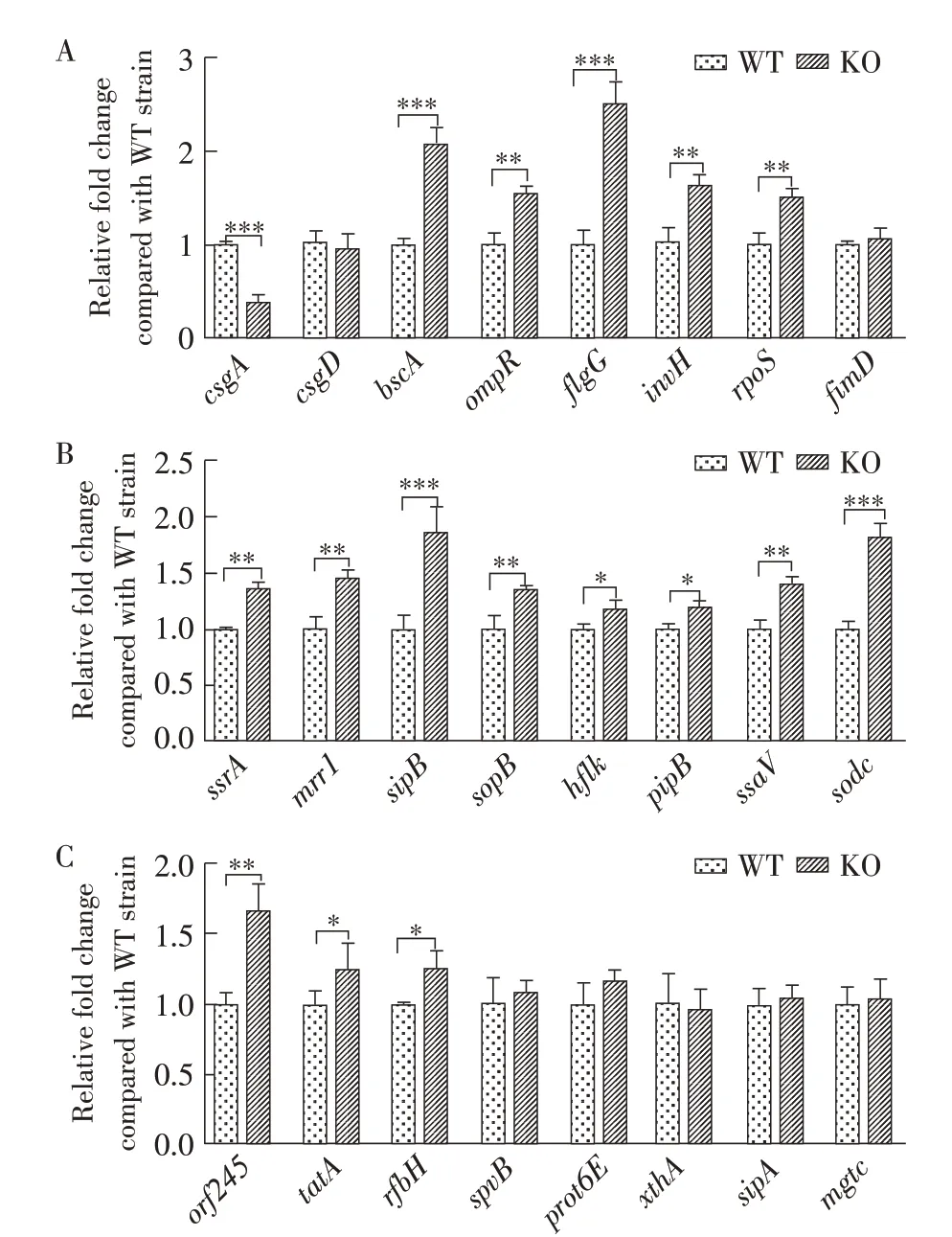
图6 RT-qPCR检测yihE基因缺失对肠炎沙门菌毒力基因的影响Fig.6 RT-qPCR detection of effects of yihE gene deletion on virulence factors of S.enteritidis
2.9yihE基因缺失株致病力试验将WT 和KO 菌株分别感染BABL/c 小鼠,观测记录14 d 内的死亡数量。结果显示,WT 和KO 菌株感染组均陆续出现死亡,而对照组未出现死亡。无菌采集死亡小鼠肝脏、脾脏样品于SS 平板上划线,呈现沙门氏菌典型菌落。根据寇式法计算各组LD50,WT 株LD50为1.2×105cfu,KO 菌株LD50为1.12×106cfu,与WT 株相比,KO 菌株毒力降低了约10 倍。表明yihE基因缺失后影响肠炎沙门菌致病力。
2.10 突变后的yihE 活性检测结果利用大肠杆菌表达系统分别表达yihE 及217 位天冬氨酸突变的突变体蛋白yihEA217G。利用商品化试剂盒对表达纯化的yihE及yihEA217G进行激酶活性分析,结果显示,与yihE比较,yihEA217G的激酶活性下降了约30%(图7)。表明将yihE基因突变后降低了其激酶活性。
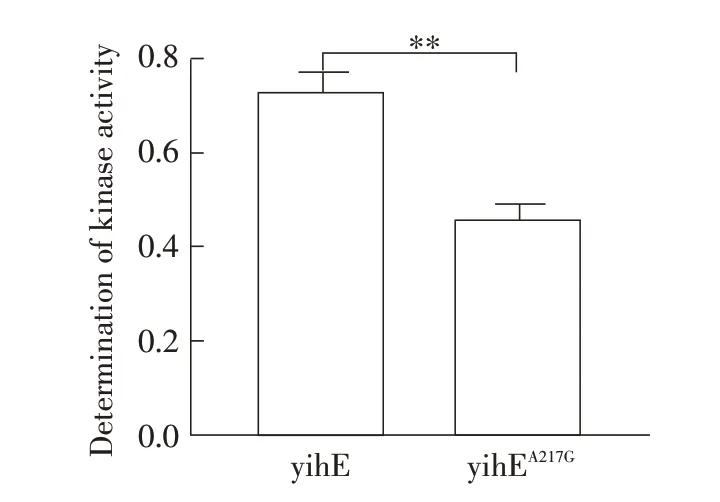
图7 蛋白激酶活性的检测Fig.7 Determination of protein kinase activity
3 讨 论
沙门菌难以控制的主要原因是其能够在细胞内寄生,使机体长期带菌,持续感染[18]。而沙门菌在胞外和胞内感染过程中要遭遇各种应激杀伤,对这些应激条件的抵御对于其感染至关重要。yihE 参与细菌的蛋白表达调控,因此本研究围绕其生物学特性进行研究,探索该蛋白在沙门菌致病中的作用。
本研究构建了肠炎沙门菌yihE基因缺失株、回补株,并对其生长特性进行研究,结果表明,缺失株在LB 和M9 液体培养基中并没有因缺失yihE基因而影响其生长,和野生株、回补株的生长曲线大致相当。说明yihE基因的缺失并不影响肠炎沙门菌的生长能力,这与已报道研究结果[19]相一致。
yihE 蛋白在大肠杆菌中参与调控能量代谢和应激反应相关的100 多个基因的表达[4],因此本研究模拟了酸性应激、碱性应激、氧化应激、热应激、硝化应激、铁饥饿等多种应激条件,评估yihE在肠炎沙门菌抗应激的作用,结果表明yihE基因的缺失使细菌抗应激能力均有不同程度的下降,证明了yihE基因能够调控细菌的应激能力。
在细菌侵入机体的过程中,细菌运动能力的强弱对沙门菌是否能够到达特定部位起着关键作用。但本研究发现野生株、yihE基因缺失株、回补株的运动能力没有下降,有可能该基因对细菌的运动能力影响很小,或者还有其他方面影响其运动能力,后续本研究室将进一步对其进行研究和确认。
细菌的BF 是细菌免受外界恶劣环境影响、侵入宿主细胞、并在机体内传播和能够持续性感染的一种重要的结构[20]。本研究发现yihE基因缺失后能够使肠炎沙门菌BF 的形成能力下降,但构成BF 的重要成分卷毛蛋白和纤维素未受影响,推测可能是因为yihE基因缺失后影响了沙门菌I 型菌毛的能力[21],继而影响了细菌BF 的形成能力。
同时通过对肠炎沙门菌野生株、缺失株、回补株进行耐药性检测,发现yihE基因缺失后能使肠炎沙门菌对喹诺酮类抗生素的敏感性增强。有研究发现许多致死性的抗菌药物,尤其是喹诺酮类药物,似乎是通过羟基的自由基作用杀死细菌[22],而羟自由基属于ROS,因此推测yihE可能通过调控ROS 来保护细菌。本研究发现缺失株、回补株对内酰胺类药物的头孢曲松敏感性均增加,且缺失株对其敏感性比野生菌株更高。同时通过对其生化指标分析发现,d-半乳糖酸盐同化(GAT)、β-葡萄糖醛酸酶(βGUR)、α-葡萄糖苷酶(αGLU)这3 种生化指标均与野生菌株有所不同,说明yihE基因缺失后有可能导致了肠炎沙门菌糖代谢能力改变,其具体作用机制有待进一步研究。
检测肠炎沙门菌野生株、缺失株菌株毒力基因的转录水平,发现yihE基因参与肠炎沙门菌的感染过程。在检测的毒力基因中,主要分为3 种:参与细菌生物代谢,调节群体感应系统且影响沙门菌胞内存活机制的基因有ssrA、rpoS、sopB、ssaV、bscA、tatA、prot6E、xthA和sipA[23];抵抗宿主防御机制、参与细菌聚集特性、抵抗高盐酸碱度和对环境胁迫抵抗力的调控且利于菌体在巨噬细胞内生存的基 因 有mrr1、ompR、sipB、orf245、hflk、pipB、rfbH、spvB和mgtC[24];参与细菌BF 的形成、运动性、粘附性且利于肠炎沙门菌在禽体内垂直传播的基 因有:invH、sodC、fimD、flgG、csgA、csgD[25],以上毒力基因除csgA、bscA、flgG、sipB、sodc外,其他毒力基因的转录水平差异均较小或基本一致。参与BF 形成的毒力基因sodC、flgG在KO 菌株中的转录水平有所提高,但csgA的转录水平下降。结合本研究前述缺失株BF 的重要成分卷毛蛋白和纤维素无变化,推测毒力基因invH、sodC、fimD、flgG、csgD影响着卷毛蛋白和纤维素,虽然sodC、flgG基因的转录水平有所提高,但对卷毛蛋白和纤维素的形成能力无影响。而csgA基因有可能影响BF 的其他组分或者有其他毒力基因、其他方面影响着BF 的组分;或者是由于刚果红平板和含荧光增白剂琼脂板测定BF 仅为定性检测,卷毛蛋白和纤维素的减少并不能从外观看出。bscA、sipB基因是影响沙门菌在胞内存活和在巨噬细胞内生存的毒力基因,其转录水平在KO 株中明显比WT 菌株高,推测yihE缺失有可能会影响其在胞内和巨噬细胞内的生存。此外,本研究还发现当肠炎沙门菌yihE基因缺失后,虽然大部分的毒力基因的转录水平有所上升,但yihE缺失株对小鼠的LD50上升了约10 倍,其毒力有所下降。
另外本研究通过测定yihE 蛋白和突变yihEA217G的激酶活性,发现突变蛋白yihEA217G的激酶活性下降了约30%。表明yihE通过其他毒力基因影响肠炎沙门菌致病力。在大肠杆菌的研究中,证实第217 位天冬氨酸是yihE 蛋白酶活性的关键位点[4],对比大肠杆菌和沙门菌yihE蛋白氨基酸序列,发现该蛋白在两种菌中高度保守,因此推测第217 位天冬氨酸对沙门菌yihE同样十分关键,本研究也证实了这一点。
综上所述,本研究首次验证了yihE基因参与肠炎沙门菌的生物学过程,并且证实yihE基因的缺失能够使肠炎沙门菌的毒力下降,该结果为进一步研究沙门菌致病机制奠定了基础。

