miR-143-3p通过SIRT2调控LPS诱导牙周膜细胞炎症、凋亡的研究*
刘 沛 王清芝
牙周炎是一种十分常见的慢性炎症性疾病,其特征为口腔微生物引起的炎症反应及牙齿周围结缔组织的破坏[1]。世界上重度牙周炎的发病率为11%[2],若不及时医治将导致牙周结构的破坏,最终导致牙齿脱落。因此,牙周炎的发病机制研究对该病的预防和治疗具有重要意义。微小RNA(microRNA,miRNA)是炎症的重要调节因子,参与牙周炎的发病机制[3]。miR-143-3p是近期发现的牙周炎相关新miRNA之一[4]。Sirtuins是一种从细菌到人类高度保守的去乙酰化酶类。乙酰化是一种蛋白质的翻译后修饰,它可影响蛋白质的催化活性、稳定性及与其它蛋白质或染色质的结合能力。Sirtuins有助于组蛋白、转录因子和胞质蛋白的去乙酰化,以调控蛋白的功能[5,6]。SIRT2多位于细胞质,其底物分为组蛋白和非组蛋白,其功能异常可能与多种疾病的发生和发展相关[7]。本研究旨在探究miR-143-3p在LPS诱导的hPDLCs细胞中的表达及调控细胞炎症反应和凋亡的作用机制,为牙周炎的医治提供理论依据。
1.材料与方法
1.1 材料 人牙周膜细胞(hPDLCs)来自本医院口腔科2021年2月接收的10-14岁正畸要求拔牙的健康患者1例;αMEM培养基购自广州展晨生物;人肿瘤坏死因子α(TNFα)ELISA检测试剂盒、人白细胞介素1β(IL-1β)ELISA检测试剂盒均购自北京索莱宝生物科技公司;膜联蛋白V-碘化丙锭(Annexin V-FITC/PI)细胞凋亡检测试剂盒购自上海Bestbio公司;荧光聚合酶链式反应(RT-qPCR)试剂盒购自日本Takera公司;双荧光素酶报告基因检测试剂盒购自美国赛默飞世尔公司;antagomiRNA、antagomiR-143-3p、pcDNA、pcDNA-SIRT2、si-NC、si-SIRT2及所有引物的设计、合成均委托上海吉玛完成。
1.2 方法
1.2.1 牙周膜细胞的培养与分组 手术拔除的牙用1%双抗的无血清αMEM充分冲洗,再放在10%血清的αMEM培养液。无菌手术刀刮取牙周膜组织块,充分剪碎,再用αMEM培养液洗涤5次,收集沉淀。再用Ⅰ型胶原酶,消化细胞1 h,中途查看要换3次。如此,重复用Ⅰ型胶原酶消化3次,收集细胞。开始用10%胎牛血清+1%双抗的αMEM培养液,37℃、5%CO2饱和湿度恒温培养箱培养,隔2 d更换一次培养液,至细胞爬出组织块。待细胞铺满底部,用0.25%胰酶消化,收集细胞,开始正常的传代培养,将此细胞记为原代hPDLCs,并鉴定。培养至第5代的细胞用于后续的实验研究。取对数期的细胞液氮冻存,备用。
将正常培养的3代hPDLCs细胞随机分为对照组、模型组;antagomiRNA组、antagomiR-143-3p组、pcDNA组、pcDNA-SIRT2组、antagomiR-143-3p+si-NC组、antagomiR-143-3p+si-SIRT2组细胞在脂质体转染至正常hPDLCs细胞后进行LPS的致炎损伤处理。RT-qPCR法检测转染的效果。
1.2.2 MTT法检测细胞活性 将正常培养的3代hPDLCs 细胞设为对照组;用LPS(1 ug/mL)处理hPDLCs细胞12 h,作为牙周膜细胞的炎症模型,设为模型组。收集培养48 h的细胞,浓度为0.5×105个/mL。1000个细胞/孔,分装至96孔板,37℃培养4 h,加入MTT溶液(5 mg/mL)10 ul,继续培养4 h。最后加入DMSO溶液,震荡使结晶溶解。最后在490 nm波长下检测细胞的吸光度(OD490)。实验重复3次,每次做3个平行重复,每个样本共重复9次。
1.2.3 RT-qPCR实验检测miR-143-3p、SIRT2、NLRP3、Caspase-1 的表达 使用脂质体将antagomiRNA、antagomiR-143-3p、antagomiR-143-3p+si-NC、pcDNA 组、pcDNA-SIRT2 组、antagomiR-143-3p+si-SIRT2 转染至细胞,antagomiRNA组、antagomiR-143-3p组、antagomiR-143-3p+si-NC组、antagomiR-143-3p+si-SIRT2组细胞,培养48 h时收集。TRIzol液提取上述各组细胞及对照组、模型组细胞的总RNA。使用反转录试剂盒将其合成cDNA,-20℃保存备用。qPCR试剂盒用于 检 测cDNA 中miR-143-3p、SIRT2、NLRP3、Caspase-1的表达。以U6、GAPDH为内参,2-△△Ct法计算检测指标的相对表达量。95℃反应5 min,60℃反应30 s,45个循环。引物信息:miR-143-3p,上游引物5′-TGAGATGAAGCACTG-3′,下 游引物5′-GTGCAGGGTCCGAGGT-3′;U6 ,上游引物5′-CTCGCTTCGGCAGCACA-3′,下游引物AACGCTTCACGAATTTGCGT;GAPDH,上游引物5′-CCAGTGCAAAGAGCCCAAAC-3′,下游引物5′-TCCCGTTTCACTTGTCTCGG-3′;SIRT2,上游引物5′-TCCACCAAGTCCTCCTGTTC-3′,下游引物5′-TGAAGGACAAGGGGCTACTC-3′;NLRP3,上 游 引 物5′-CCCTTGGAGACACAGGACTCA-3′,上 游 引 物 5′-TGAGGCTGC AGTTGTCTAATTCC-3′;Caspase-1,上游引物5′-TTTCCGCAAGGTTCGATTTTCA-3′,下游引物5′-GGCATCTGCGCTCTACCATC-3′;GAPDH,上游引物5′-CCAGTGCAAAGAGCCCAAAC-3′,下游引物5′-TCCCGTTTCACTTGTCTCGG-3′。实验重复3次,每次做3个平行重复,每个样本共重复9次。
1.2.4 ELISA实验检测细胞上清TNFα、IL-1β的含量 收集细胞培养液,分别按照TNFα 、IL-1β的双抗体夹心ELISA法检测TNFα、IL-1β的含量。详细的操作步骤,按照试剂盒中的说明书操作步骤要求操作,加入终止液后均在450 nm 波长下检测TNFα、IL-1β的吸光值,判定样本中TNFα、IL-1β的含量。颜色越深,上清中TNFα、IL-1β的含量越高,OD450吸光值越高。实验重复3次,每次做3个平行重复,每个样本共重复9次。
1.2.5 Annexin V-FITC/PI双染检测细胞凋亡率 收集antagomiRNA组、antagomiR-143-3p组、antagomiR-143-3p+si-NC组、antagomiR-143-3p+si-SIRT2组培养48 h的细胞及对照组、模型组培养48 h的细胞。4℃的PBS洗涤,500 ul结合缓冲液制成105个细胞的重悬液。再加入Annexin VFITC、PI,混匀,避光孵育。结束后将细胞置于冰上,尽快上流式细胞仪检测凋亡情况。细胞总凋亡率(%)=早期凋亡率+晚期凋亡率。实验重复3次,每次做3个平行重复,每个样本共重复9次。
1.2.6 WB实验检测细胞SIRT2蛋白表达 收集antagomiRNA 组、antagomiR-143-3p 组、antagomiR-143-3p+si-NC组、antagomiR-143-3p+si-SIRT2组培养48 h的细胞及对照组、模型组培养48 h的细胞,RIPA冰上裂解30 min,超声裂解2 min,12000 rpm/min离心5 min,收集总蛋白。定量变性后,行SDS-PAGE蛋白电泳、转膜及封闭。将膜进行一抗孵育:1000倍稀释的兔抗SIRT2多抗溶液孵育,4℃,12 h。二抗孵育:将膜浸入500 倍稀释的HRP标记的山羊抗兔溶液,孵育,37℃2 h。显色:ECL发光液显色,曝光。Image J 软件处理分析蛋白灰度。实验重复3 次,每次做3 个平行重复,每个样本共重复9 次。
1.2.7 双荧光素酶报告实验检测细胞荧光强度 Starbase(https://starbase.sysu.edu.cn/)预测miR-143-3p的下游靶基因,发现SIRT2为其中之一。根据预测到的结合靶点化学合成含有结合位点的SIRT2 核酸片段(SIRT2-WT)、不含结合位点的SIRT2 核酸片段(SIRT2-MUT),插入荧光载体,构建荧光报告基因载体。将其分别与agomiRNA、agomiR-143-3p、antagomiRNA、antagomiR-143-3p 共转染至hPDLCs 细胞。使用双荧光素酶报告基因检测试剂盒操作说明书要求操作,检测hPDLCs细胞的荧光活性。
1.2.8 统计学处理SPSS 26.0分析实验数据。均数±标准差(±s)表示数据,行t检验或F检验比较差异,P<0.05表示有统计意义。
2.结果
2.1 LPS 诱导的hPDLCs 细胞模型的建立及miR-143-3p的表达 取第3代培养48 h的hPDLCs细胞,在显微镜下观察细胞的形态,如图1A所示。与对照组相比,模型组细胞TNFα、IL-1β升高,细胞活性低,细胞凋亡率升高(图1B),miR-143-3p表达升高(P<0.05),见表1。
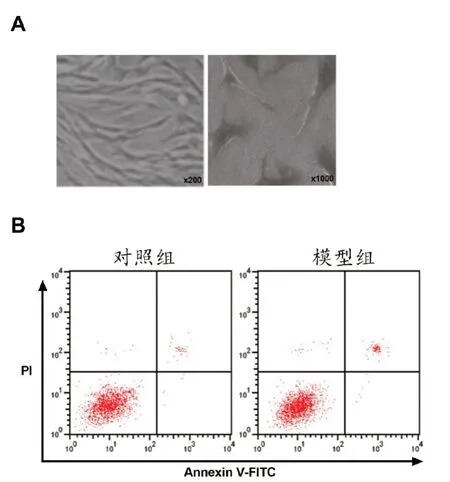
图1 hPDLCs鉴定图及模型细胞凋亡情况A:hPDLCs细胞鉴定图;B:LPS诱导的hPDLCs细胞凋亡图
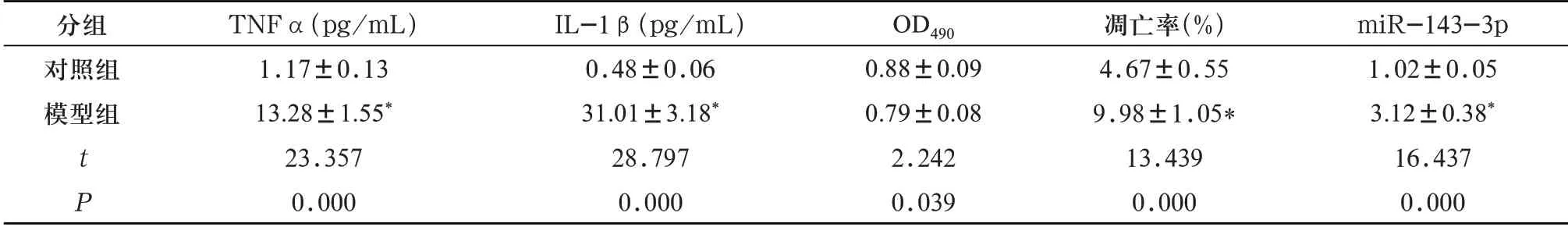
表1 LPS诱导hPDLCs细胞
2.2 抑制miR-143-3p对LPS诱导的牙周膜细胞炎症、凋亡的调控 结果如表2 和图2 所示,与antagomiRNA组相比,antagomiR-143-3p组细胞中miR-143-3p的表达显著降低,NLRP3、Caspase-1的mRNA表达均显著降低,TNFα、IL-1β的含量均显著降低,细胞凋亡率显著降低(P<0.05)。

图2 抑制miR-143-3p的LPS诱导的牙周膜细胞凋亡图

表2 抑制miR-143-3p对LPS诱导的牙周膜细胞炎症、凋亡的影响
2.3 miR-143-3p靶向SIRT2 Starbase靶点预测网站发现,SIRT2与miR-143-3p之间存在连续的靶向结合位点,如图3A。双荧光素酶报告基因检测实验结果如图3B所示,agomiR-143-3p组SIRT2-WT细胞的荧光活性显著的低于agomiR-143-3p 组SIRT2-MUT 细 胞、agomiRNA 组SIRT2-WT、SIRT2-MUT细胞(P<0.05);与agomiRNA组相比,agomiR-143-3p组SIRT2 的mRNA和蛋白表达均显著降低,与antagomiRNA组相比,antagomiR-143-3p组SIRT2的mRNA和蛋白表达显著升高(P<0.05),如图3C、D、E。
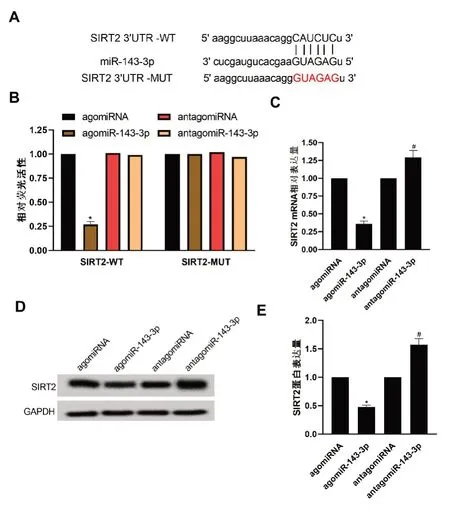
图3 miR-143-3p与SIRT2之间的靶向关系A:miR-143-3p与SIRT2之间存在连续的6个互补结合位点;B:双荧光素酶报告实验结果;C:miR-143-3p调控SIRT2 mRNA表达;D、E:miR-143-3p调控SIRT2蛋白表达与AgomiRNA组比较,*P<0.05;与AntagomiRNA组比较,#P<0.05
2.4 过表达SIRT2抑制LPS诱导的牙周膜细胞炎症、凋亡 与对照组相比,模型组细胞SIRT2蛋白表达降低,与pcDNA 组相比,pcDNA-SIRT2 组细胞SIRT2 表达升高(图4A、B),NLRP3、Caspase-1、TNFα、IL-1β、细胞凋亡率(图C)均升高(P<0.05),见表3。

表3 过表达SIRT2对LPS诱导的牙周膜细胞炎症、凋亡的影响
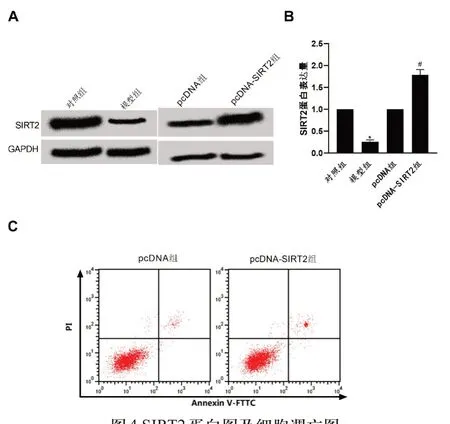
图4 SIRT2蛋白图及细胞凋亡图A:SIRT2蛋白电泳图;B:SIRT2蛋白相对表达量;C:牙周膜细胞凋亡图
2.5 敲减SIRT2部分转抑制miR-143-3p对LPS诱导的牙周膜细胞炎症、凋亡的作用 结果如表4和图5 所示,与antagomiR-143-3p+si-NC 组相比,antagomiR-143-3p+si-SIRT2组miR-143-3p表达显著升高,NLRP3、Caspase-1的mRNA表达均显著升高,TNFα、IL-1β的含量均显著升高,细胞凋亡率显著升高(P<0.05)。

表4 敲减SIRT2部分逆转抑制miR-143-3p的抗LPS诱导的牙周膜细胞炎症、凋亡作用
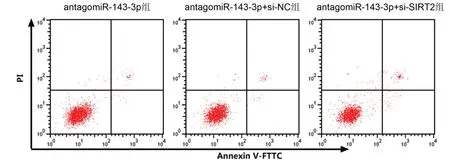
图5 敲减SIRT2联合抑制miR-143-3p的LPS诱导牙周膜细胞凋亡图
3.讨论
miR-143参与心血管疾病、神经系统疾病及自身免疫性疾病的发展过程[8-10]。随着医疗技术、科研水平的不断提升,其在其他疾病中的功能逐渐被发掘。Wang等[11]发现,过表达miR-143-3p抑制人牙周膜细胞的成骨分化和矿化,这与其靶向KLF5抑制Wnt/β-catenin信号通路的活性紧密相关。Dong等[12]发现,miR-143-3p在LPS诱导的PDLCs中升高,抑制miR-143-3p削弱LPS对PDLCs细胞增殖的抑制、凋亡促进和炎症反应,抑制AKT/IKK通路活性,并且MEG3为miR-143-3p的上游调控因子,揭示MEG3通过下调miR-143-3p失活AKT/IKK通路,从而抑制LPS诱导的PDLCs损伤。在本研究中,miR-143-3p在LPS诱导hPDLCs细胞中表达升高,且抑制miR-143-3p明显的减弱了LPS对hPDLCs细胞NLRP3、Caspase-1、TNFα、IL-1β及细胞凋亡的促进作用,发挥保护作用。这也说明miR-143-3p在牙周炎中扮演致病作用。这与前人关于miR-143-3p在牙周疾病中的研究结果相吻合。深入研究发现,miR-143-3p靶向负调控SIRT2,于是推测SIRT2可能参与了miR-143-3p在牙周炎中的致病作用。
Sirtuins是NAD+依赖性蛋白脱乙酰酶,在哺乳动物中,存在7种亚型SIRT1-SIRT7,其中SIRT1和SIRT3研究最为广泛,而SIRT2是新的研究焦点[13]。Zheng等[14]报道,烟酰胺通过上调miR-22-3p诱导PDLSC增殖和分化,SIRT1作为miR-22-3p的下游靶点之一,调控PDLSC细胞炎性细胞因子TNF-α、IL-1β和IL-8的表达水平。Pérola报道[15],在牙周炎患者的治疗过程中,血清SIRT1的表达从(1.06±1.03)至(1.66±1.64)ng/mL,血清甘露糖结合凝集素(MBL)、C 反应蛋白的浓度均发生降低,这暗示SIRT1对牙周炎患者的潜在保护作用。近期,Chen及其团队[16]研究发现NLRP3可以在巨噬细胞中被去乙酰化酶sirtuin 2(SIRT 2)去乙酰化,导致产生IL-1β的能力减弱,推测SIRT2抑制NLRP3炎症小体的活性。有研究报道,SIRT2作为细胞溶质NAD依赖性脱乙酰酶,可通过自主抑制造血干细胞(HSC)中NLRP3炎性小体的激活,用于维持老年HSC及再生。随着年龄的增长,SIRT2表达的降低和线粒体应激的增加导致HSC 中NLRP3 炎症小体的异常激活。SIRT2过度表达、NLRP3失活或Caspase-1失活可改善老化HSC的维持和再生能力[17]。此研究结果显示,SIRT2 低表达,而过表达SIRT2 抑制了LPS 对hPDLCs 细胞炎症、凋亡的促进,减轻了LPS 诱导hPDLCs损伤。深入研究发现,敲减SIRT2明显的削弱了抑制miR-143-3p对受损hPDLCs细胞的保护作用。
综上所述,miR-143-3p 加重LPS 诱导的hPDLCs细胞发生炎症和凋亡,这种致病作用的潜在机制与SIRT2有联系,为牙周炎的治疗提供新思路。

