miR-206通过IGF1对人牙周膜干细胞的成骨分化能力的影响及机制研究*
周瑞平 由 林 刘 鑫 李凯雄 郭 丽 梁又德
牙周膜干细胞(periodontal ligament stem cells,PDLSCs)来源于牙周膜组织,具有强大成骨能力,能够在体内形成骨组织、牙周韧带等结构[1]。已有研究证实,PDLSCs 在体外诱导培养条件下和动物模型中都表现出成骨潜力,可产生牙周膜样组织,促进缺损部位修复、再生及重建[2,3]。有报道称,miRNA 在PDLSCs 成骨分化过程中发挥重要调节作用[4]。骨髓间充质干细胞外泌体来源的miR-206可通过调节相关基因表达,促进骨关节炎中成骨细胞的增殖和分化[5]。基于以上研究,推测miR-206 可能参与调控PDLSCs 的成骨分化。本研究通过过表达/敲降PDLSCs 中miR-206 表达水平,探讨其对PDLSCs 成骨分化的影响及可能作用机制,旨在为促进PDLSCs 介导的骨再生研究提供新的思路和方法。
1.材料和方法
1.1 样本收集 经本院伦理委员会批准,志愿者知情同意,收集其拔除的正畸牙或第三磨牙,收集的离体牙需满足以下条件:(1)年龄14~18岁;(2)牙根完整,无牙周炎、根尖周炎、龋齿等疾病;(3)无其他全身系统疾病。将牙齿置于含有5%双抗、10%胎牛血清的α-MEM 培养基中,2 h 内进行牙周膜组织取材及原代细胞培养。
1.2 主要试剂和仪器 碱性磷酸酶(alkaline phosphatase,ALP)染色试剂盒、茜素红S染色液购自碧云天公司;MTT 溶液购自美国Thermo Fisher Scientific公司;α-MEM培养液购自美国Hyclone公 司;Anti-CD34 PE、Anti-CD45 PE、Anti-CD105 FITC、Anti-CD90 FITC、Anti-CD73 FITC、购自美国eBioscience公司;miR-206拟似物(mimics)和mimics阴性对照(negative control,NC)及miR-206抑制剂(inhibitor)和inhibitor-NC、胰岛素样生长因子-1(insulin-like growth factors-1,IGF-1)过表达和NC序列及载体质粒由广州锐博生物科技有限公司合成;地塞米松、β-甘油磷酸钠、抗坏血酸购自美国Sigma公司;兔抗人Runt相关转录因 子2(Runt-related transcription factor 2,RUNX2)、骨桥蛋白(osteopontin,OPN)、ALP、IGF-1一抗及山羊抗兔IgG均购自英国Abcam公司。
IX-70 倒置相差显微镜购自日本Olympus 公司;LightCycler480 II 实时荧光定量PCR 仪购自美国Roche公司;FACSCalibur流式细胞仪购自美国BD 公司;EXL-808 酶标仪购自美国Bio-Tek公司。
1.3 PDLSCs 的培养和传代 将牙齿用PBS 冲洗数遍,清理干净杂质,放入培养液中,刮取根中1/3 的牙周膜,切成约1 mm3大小组织块,1000 r/min 离心5 min,加入Ⅰ型胶原酶,37℃5%CO2培养箱中消化,再次离心、重悬,接种,细胞长出后每3 d更换一次培养液。之后采用有限稀释培养法挑选单克隆续进行培养,长至80%时传代、消化、离心,继续培养。
1.4 PDLSCs 的鉴定 取第三代PDLSCs,消化、离心,PBS 重悬,调整为5×105个/mL 的密度,分装至流式管(100 μL/管)。分别添加FITC 偶联 的 鼠 抗 人CD90、CD73、CD105 和PE 偶 联 的CD45、CD34 单抗,避光反应30 min;对照管加入等量PBS,离心、重悬,流式细胞仪鉴定。
1.5 RT-qPCR 检测成骨诱导前后miR-206表达 第三代PDLSCs 以5×105个/mL 接种于6 孔板,随机分为空白组和诱导组,各设5个复孔。空白组正常培养,诱导组在细胞生长至80%时加入成骨诱导液(10% 胎牛血清、1 μmol/L 地塞米松、10 mmol/Lβ-甘油磷酸钠和50 μg/mL 抗环血酸),每2~3 d更换一次培养液,继续培养14 d后,收集细胞,TRIZOL 法提取总RNA,逆转录为cDNA,配制25 μL 反应体系:12.5 μL SYBR®Green Realtime PCR Master Mix,上下游引物各0.5 μL,模板cDNA 1 μL,双蒸水10.5 μL,混匀后,放 入PCR 仪:95℃ 60 s,95℃ 10 s,50℃ 45 s,72℃ 90 s,40个 循 环,72℃延 伸10 min。以U6 作为内参,采用2-△△CT法进行定量分析。所用引物:miR-206 F:CCGAGGCCCACATGCTTCTTTA,R:TTGCCGAAACCACACACTTC;U6 F:5′-GCTTCGGCAGCACATATACTAAAAT-3′,R:5′-CGCTTCACGAATTTGCGTGTCAT-3′。
1.6 细胞转染和分组 取第三代PDLSCs,接种于6孔板,细胞随机分为对照组、miR-206 mimics组、mimics-NC 组、miR-206 inhibitor 组 和inhibitor-NC组,各设5个复孔。对照组正常培养,不作转染;其余4 组24 h 后进行转染:将1 μL LipofectamineTM2000与50 μL Opti-MEM培养基混合均匀;另将1 μL 含有miR-206 mimics、mimics-NC、miR-206 inhibitor和inhibitor-NC的质粒与50 μL Opti-MEM 培养基混合均匀,静置20 min 后,将两种混合物均匀混合,分别加入miR-206 mimics 组、mimics-NC 组、miR-206 inhibitor组和inhibitor-NC组细胞中进行转染,每组各设5个复孔。6 h后,将各组培养基更换为成骨诱导液,继续培养21 d。
另取第三代PDLSCs,接种于6 孔板,随机分为miR-206 mimics+NC 组和miR-206 mimics+IGF-1 组,两组细胞在转染miR-206 mimics 后,分别转染IGF-1-NC 和IGF-1,转染6 h 后,进行成骨诱导,继续培养21 d。每组各设5个复孔。
1.7 MTT法检测PDLSCs增殖 将各组PDLSCs以1×105个/mL接种于96孔板,各设5个复孔,分别培养24、48、72 h后,按20 μL/孔加入MTT溶液孵育4 h,离心弃上清,按150 μL/孔加入二甲基亚砜,振荡10 min,酶标仪检测490 nm处吸光度值(OD)。
1.8 测定ALP活性 取各组细胞,PBS清洗,加入0.2% Triton-X100,12000 r/min离心10 min,4%多聚甲醛固定1 min,PBS清洗,使用ALP试剂盒进行染色,光镜下呈现紫色的为ALP阳性细胞,酶标仪记录405 nm波长OD值,计算ALP活性。
1.9 茜素红染色检测矿化能力 取各组细胞,PBS 清洗后,加入4%多聚甲醛固定30 min,使用茜素红染色试剂盒进行染色,光镜下呈现橙红色的为矿化结节,随机选取5个不重复视野,计数矿化结节数量。
1.10 RT-qPCR检测miR-206、IGF-1 mRNA表达RT-qPCR方法同1.5所述。IGF-1以GAPDH为内参,所用引物:IGF-1 F:5′-GGATTTCAA GCAGAACTGTGTTTT-3′;R:5′-CCTGGACCTTGAATTTTTTCTTTTT-3′;GAPDH F:5′-GAAGGTGAAGGTCGGAGTC-3′,R:5′-GAA GATGGTGATGGGATTTC-3′。
1.11 Western blot 检测蛋白表达 收集各组细胞,加入RIPA 裂解液,离心取上清。BCA 法测定蛋白浓度,100℃水浴变性,上样行SDS-PAGE电泳,转至PVDF 膜,封闭液室温封闭2 h,分别与稀释的RUNX2、OPN、ALP、GAPDH(均1∶800 稀释)一抗4℃孵育过夜,洗膜,与HRP 标记的二抗(1∶2000 稀释)室温孵育2 h,洗膜。ECL 显色,Image J软件分析,结果以与内参灰度值比值表示。
1.12 双荧光素酶报告基因系统验证miR-206与IGF-1 靶向性 根据Target Scan 生物学软件进行预测,IGF-1 为miR-206 的潜在靶基因,获取miR-206 与IGF-1 的3′非翻译区(3′untranslated region,3′-UTR)的 结 合 位 点,构 建IGF-1 3′-UTR 野生型(wild type,WT)和突变型(mutation type,MUT)双荧光素酶pmir GLO载体。将HPDLSCs 按1×105个/mL 接种到24 孔板,待细胞汇合至80%时,将miR-206 mimics/mimics-NC、miR-206 inhibitor/inhibitor-NC与IGF-1 3′-UTR WT/MUT使用LipofectamineTM2000 共转染细胞,转染48 h 后,加入裂解液裂解细胞,测量萤火虫荧光素酶活性和海肾荧光素酶活性。相对荧光素酶活性通过计算二者比值来表示。
1.13 统计学处理 实验所得数据采用SPSS 25.0 进行处理,以(±s)表示计量资料,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检测,以P<0.05为差异有统计学意义。
2.结果
2.1 PDLSCs 的分离培养 培养5~7 d 后可见细胞爬出,呈放射状。约14 d 后,细胞长至80%进行传代。传代后的细胞生长加快,呈长梭形,边缘整齐,胞核呈卵圆形,核仁清晰,排列紧密,在3~5 d可汇合至90%,排列致密,网状生长(图1)。

图1 PDLSCs形态学观察(А:第一代PDLSCs;В:第三代PDLSCs,×100倍,标尺=100 μm)
2.2 PDLSCs 的鉴定 流式细胞术结果显示,间充质干细胞标志物CD90 表达率为98.69%,CD105 表达率为99.61%、CD73 表达率为99.02%,均呈阳性;而造血干细胞标志物CD34 表达率为5.27%,CD45表达率为6.13%,均呈阴性(图2)。
2.3 成骨诱导对PDLSCs 中miR-206 表达的影响RT-qPCR 结果显示,诱导组miR-206 表达水平显著低于空白组(P<0.05)(图3)。
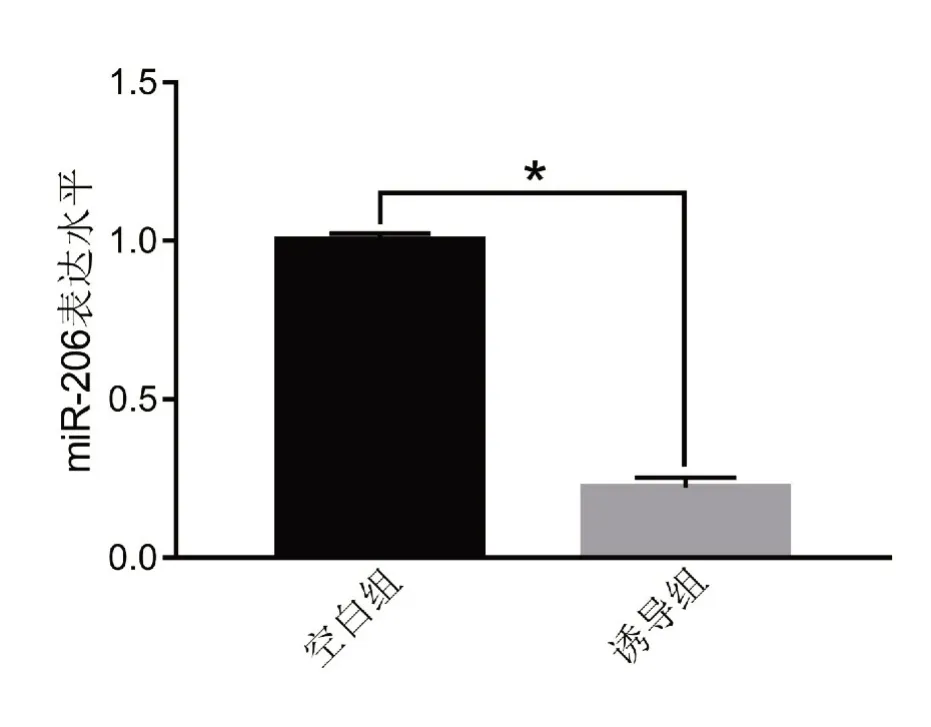
图3 成骨诱导前后PDLSCs中miR-206表达
2.4 miR-206对PDLSCs增殖的影响MTT结果显示,转染miR-206 mimics后细胞OD值减小,而转染miR-206 inhibitor 后,细胞OD 值增加(P<0.05)(图4)。表明过表达miR-206可抑制PDLSCs增殖,而敲降miR-206可促进PDLSCs增殖。
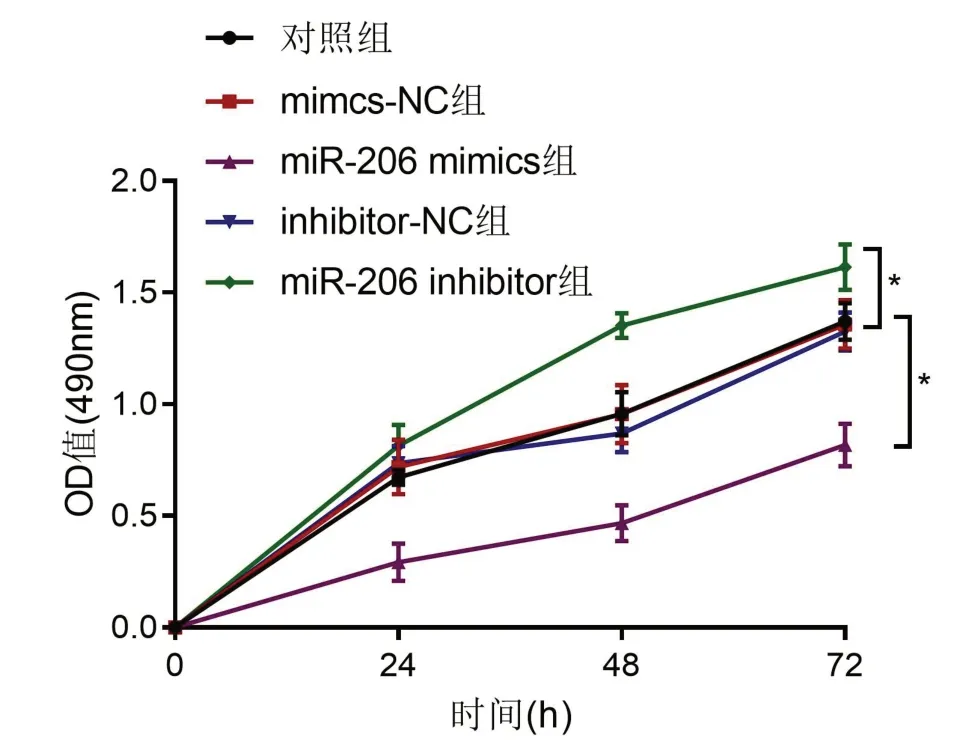
图4 MTT法检测各组细胞增殖情况
注:与空白组比较,*P<0.05
2.5 miR-206 对PDLSCs 中ALP 活性和矿化的影响 ALP 染色和茜素红染色结果显示,转染mi-206 mimics 后细胞ALP 活性降低,矿化结节数量减少;而在转染miR-206 inhibitor 后细胞ALP 活性升高,矿化结节数量增加(P<0.05)(图5)。表明过表达miR-206可抑制ALP 活性和细胞矿化,而敲降miR-206后作用相反。
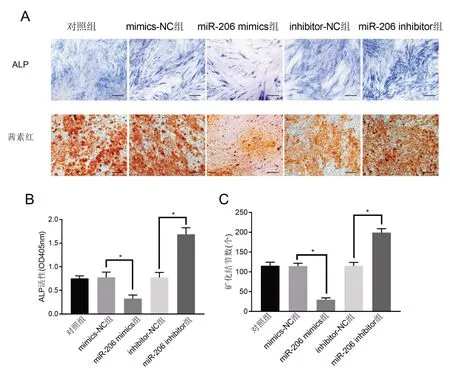
图5 miR-206对PDLSCs中АLP活性和矿化的影响(А:АLP染色和茜素红染色结果,×100倍,标尺=100 μm;В:АLP活性;C:矿化结节数)
2.6 miR-206 对PDLSCs 中成骨标志蛋白表达的影响Western blot 结果显示,转染miR-206 mimics 后,成骨分化标志蛋白RUNX2、OPN 和ALP 表达明显下降,而转染miR-206 inhibitor 后结果相反(P<0.05)(图6)。表明过表达miR-206可抑制PDLSCs 成骨分化,而敲降其表达可促进PDLSCs成骨分化。

图6 miR-206对成骨蛋白表达的影响(А:RUNX2蛋白表达量化;В:OPN蛋白表达量化;C:АLP蛋白表达量化;D:RUNX2、OPN、АLP蛋白表达电泳图)
2.7 miR-206对IGF-1表达的影响RT-qPCR结果显示,转染miR-206 mimics后,miR-206表达水平显著升高,而IGF-1 mRNA表达水平明显下降,转染miR-206 inhibitor后,上述结果与之相反(P<0.05)(图7A、B)。在Western blot中也得到相似结果,转染miR-206 mimics后,IFG蛋白表达明显下降,而转染miR-206 inhibitor后,IGF-1蛋白表达明显升高(P<0.05)(图7C、D),表明过表达miR-206可抑制IGF-表达,敲降其表达后可促进IFG-1表达。
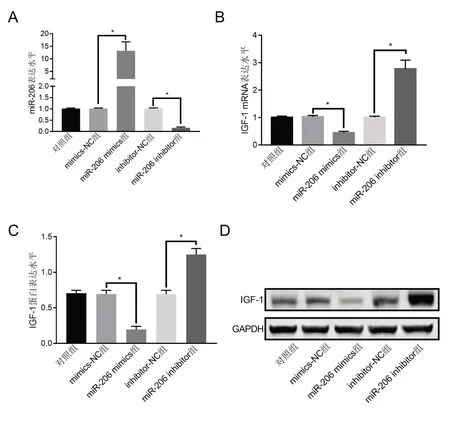
图7 miR-206调控IGF-1表达(А:miR-206表达量化;В:IGF-1 mRNА表达量化;C:IGF-1蛋白表达量化;D:IGF-1蛋白表达电泳图)
2.8 miR-206靶向调控IGF-1 TargetScan生物学软件显示,IGF-1的3′-UTR区域存在miR-206结合位点(图8A)。共转染miR-206 mimics可显著降低IGF-1 WT相对荧光素酶活性,而与miR-206 inhibitor 共转染后则相反(P<0.05);转染miR-206 mimics/inhibitor均对IGF-1 MUT相对荧光素酶活性无明显影响(P>0.05)(图8B)。

图8 miR-206靶向调控IGF-1表达(А:miR-206与IGF-1存在连续结合位点;В:相对荧光素酶活性)
2.9 过表达IGF1部分逆转miR-206对PDLSCs成骨分化的抑制ALP 染色、茜素红染色和Western blot 结果显示,与miR-206 mimics+NC 组比较,miR-206 mimics+IGF-1组PDLSCs中ALP活性显著升高,矿化结节数量显著增加,同时成骨分化蛋白RUNX2、OPN 和ALP 表达显著升高(P<0.05)(图9)。表明IGF-1 能部分减弱过表达miR-206 对PDLSCs成骨分化的抑制作用。
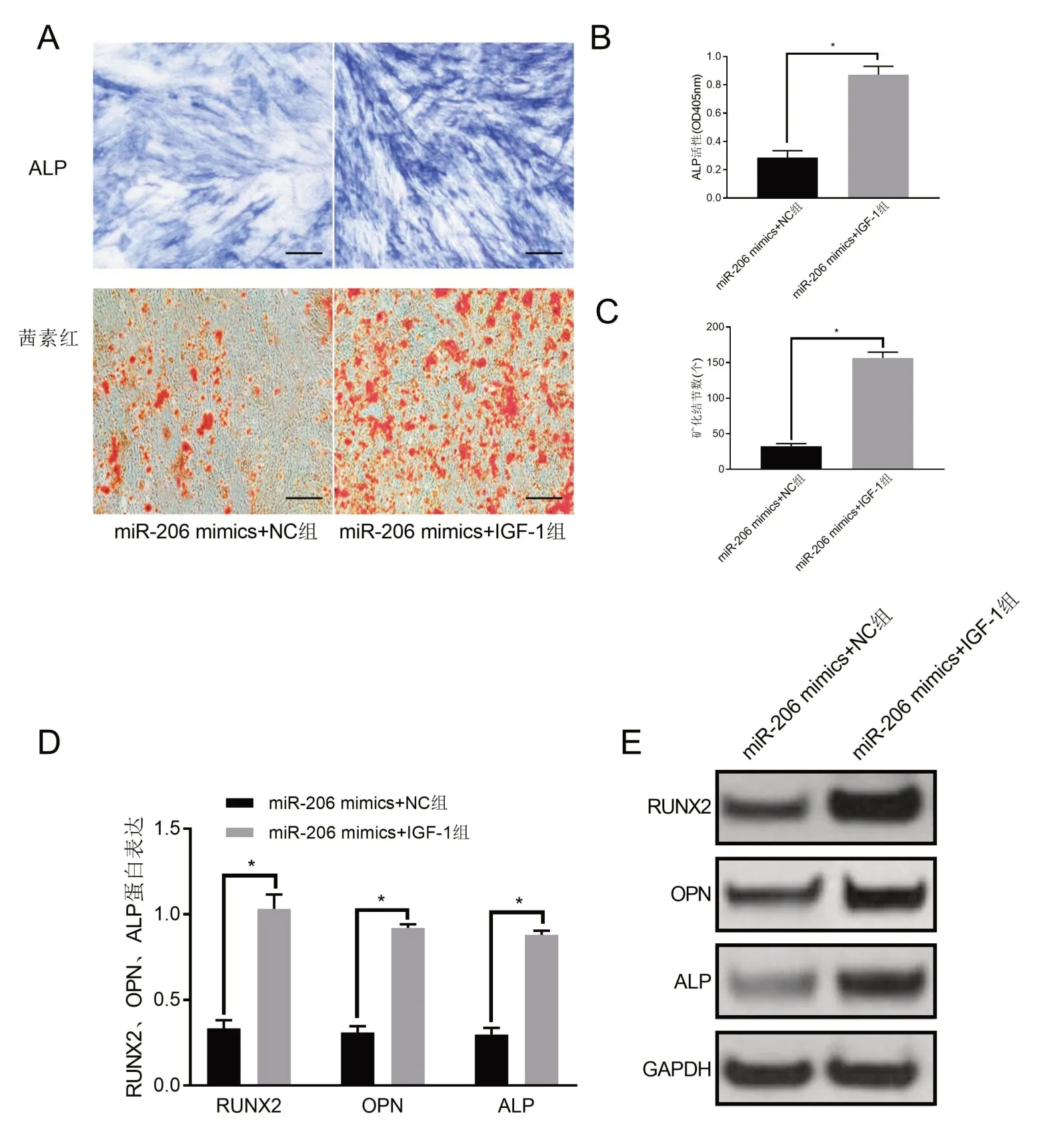
图9 过表达IGF-1逆转miR-206对PDLSCs成骨分化的抑制(А:АLP染色和茜素红染色结果,×100倍,标尺=100 μm;В:АLP活性;C:矿化结节数量;D:RUNX2、OPN、АLP蛋白表达量化;E:RUNX2、OPN、АLP蛋白表达电泳图)
3.讨论
正常情况下,牙槽骨维持骨吸收和修复的动态平衡,发生牙周炎等疾病时,牙槽骨的吸收大于其修复过程,可导致牙周组织缺损,最终造成牙齿松动甚至脱落。近年来牙组织工程逐渐成为重建丢失组织的新方法,PDLSCs具有多种分化潜能和强大自我更新能力,可以分化为成骨细胞和牙骨质细胞,在维持和再生中起关键作用,可作为种子细胞,在牙组织再生工程中具有广泛应用前景,如何提高PDLSCs的再生能力,对于促进牙周修复至关重要[6,7]。PDLSCs成骨分化受多种细胞因子的调控,其中miRNA具有潜在调控作用,本研究首次探讨miR-206对PDLSCs成骨分化的影响及其分子机制,结果显示,成骨诱导后细胞中miR-206表达较低,提示miR-206可能参与PDLSCs成骨分化过程,并在此基础上对其作用机制作了分析,对于牙周组织再生和修复具有重要临床意义。
miR-206参与细胞生长、分化、凋亡和代谢过程,其表达与牙齿发育过程有关,可通过调节相关信号通路调控牙齿形态发育过程[8]。王献刚等[9]报道,牙髓炎患者牙髓组织中miR-206的表达水平较健康人显著下调,表明miR-206与牙周疾病密切相关。此外,另有研究表明,人间充质干细胞来源的外泌体可通过调控miR-206促进骨关节炎中的软骨细胞增殖,有助于软骨组织修复[10]。由此,推测miR-206 或与PDLSCs 成骨分化有关,鉴于此,本研究提取培养PDLSCs并进了行鉴定,结果显示细胞间充质干细胞标志物和造血干细胞标志物分别呈现阳性和阴性表达,与之前的文献[11,12]报道一致,PDLSCs培养成功。为观察miR-206对PDLSCs成骨分化的影响,本研究在诱导前后检测细胞中miR-206表达水平,结果发现成骨诱导后细胞中miR-206表达水平明显降低,表明miR-206可能参与PDLSCs成骨分化。进而对PDLSCs分别转染miR-206 mimics和inhibitor,过表达miR-206可抑制PDLSCs增殖,降低ALP活性,减少矿化结节形成;而敲降其表达,上述结果呈相反趋势。成骨分化相关蛋白包括RUNX2、OPN和ALP等,RUNX2是骨形成的关键基因,参与成骨分化和骨形成过程;OPN可影响成骨细胞的粘附,常被用作标记蛋白,以测定成骨分化情况;ALP能促进骨基质矿化,对骨形成有积极作用。Western blot结果同样显示,过表达miR-206后,RUNX2、OPN和ALP蛋白表达明显降低,由此表明过表达miR-206 可抑制PDLSCs成骨分化能力。
在进一步的机制研究中,本研究发现miR-206对IGF具有调控作用,过表达miR-206可抑制IGF-1表达,敲降其表达后可促进IFG-1表达,推测miR-206可能通过调节IGF-1表达,进而影响PDLSCs成骨分化能力。IGF-1与胰岛素有相似结构,能够促进骨细胞和成骨细胞增殖、分化和成熟[13]。Feng等[14]报道,IGF-1可提高细胞中成骨标志物RUNX2、OPN蛋白和mRNA表达,促进骨髓间充质干细胞增殖和成骨分化。Yuan等[15]也证实,IGF-1能够促进MC3T3-E1成骨细胞分化和矿化,并能显著上调RUNX2、OPN等成骨相关基因表达,增加ALP合成。此外,还有研究显示,使用IGF-1处理小鼠前成骨细胞,可增加ALP活性,增加成骨基因表达,诱导骨形成[16]。以上研究均表明IGF-1可影响成骨相关基因表达,与细胞成骨分化关系密切。miRNAs 通过结合mRNA 的3′-UTR,参与调控转录后基因表达。本研究通过生物学信息分析显示,miR-206与IGF-1存在高度互补序列,IGF-1为miR-206的潜在靶基因,并经双荧光素酶实验证实miR-206 可通过结合IGF-1 的3′-UTR,导致IGF-1 mRNA发生降解,表达水平明显下降,表明IGF-1为miR-206的靶基因。进一步的共转染实验中,过表达IGF后miR-206 mimics对PDLSCs 的成骨分化抑制作用被减弱,由此推测miR-206通过靶向抑制IGF-1表达减弱PDLSCs成骨分化能力。
总之,本研究初步发现miR-206可抑制PDLSCs增殖,并降低其成骨分化能力,其作用机制可能与靶向抑制IGF-1表达有关。在进一步的牙组织工程中,通过敲降miR-206表达,加快PDLSCs成骨分化,进而促进丢失牙组织的修复和重建,可为临床治疗提供新思路和方法。当然,本研究仅在体外细胞水平进行,未来仍需进行体内动物实验验证上述结论。

