胃肠道炎性肌纤维母细胞瘤的CT影像学特征及临床病理分析
徐嫚嫚,孙晶晶(通信作者)
(1中国科学院大学附属肿瘤医院<浙江省肿瘤医院>放射科 浙江 杭州 310022)
(2中国科学院基础医学与肿瘤研究所 浙江 杭州 310022)
炎性肌纤维母细胞瘤(inflammatory myofibroblastic tumors,IMT)是一种罕见的由分化的梭形肌纤维母细胞、纤维母细胞组成,常伴浆细胞、淋巴细胞或嗜酸性粒细胞等炎性细胞浸润的中间型间叶源性肿瘤[1]。IMT可发生于全身各处,在腹部常见于肠系膜、网膜、腹膜后等,其他部位常见于肺,发生于胃肠道者较为罕见。本研究拟回顾性分析4例胃肠道IMT的临床、影像及病理表现,并结合以往研究报道进行总结分析,以提高对该病的认识。
1 资料与方法
1.1 一般资料
回顾性分析2011年11月—2018年4月于浙江省肿瘤医院经手术切除及术后病理确诊的4例胃肠道IMT患者的临床、影像及病理资料。4例IMT均原发于胃肠道,其中男性1例,女性3例,患者年龄为11~68岁,平均年龄37岁。
1.2 方法
手术前4例患者均进行CT检查,其中2例为CT平扫,另外2例为CT平扫及增强扫描。CT扫描采用Siemens Definition Flash 64排CT扫描机。扫描参数如下:管电压为120 kV,管电流为250 mAs,扫描层厚为5 mm,层间距为5 mm。对比增强扫描时,采用优维显对比剂,剂量为100~120 mL,注射速率为3 mL/s,分别获取注射后30 s和60 s增强CT图像,并传输至PACS系统。
1.3 图像分析
由2名具有5年以上工作经验的影像诊断医师进行CT图像阅片与分析,所有的不一致意见最终均进行协商达成一致。主要观察并记录的影像学特征如下:病灶的部位、大小、密度、边缘、强化方式、肠壁周围浸润、淋巴结及远处转移等情况。
2 结果
2.1 一般资料
所有4例胃肠道IMT中,1例病灶发生于胃窦,1 例发生于回盲部,另外2例发生于乙状结肠。临床表现为腹痛(2例)、排便困难伴腹痛(1例)、因月经紊乱(1 例)。血生化常规检查显示超敏C反应蛋白升高(2例);术前消化道肿瘤标志物检查:血清铁蛋白轻度升高(1例)、CA125轻度升高(1例)、CA19-9轻度升高(1例),
其余肿瘤标志物未见明显异常升高。
2.2 胃IMT CT表现
本例胃IMT病灶位于胃窦(图1),表现为胃窦壁全层增厚,密度均匀,平扫CT值为33 HU,动脉期CT值为59 HU,门脉期CT值为73 HU,表现为明显渐进性、持续强化特点。胃窦壁浆膜面清晰,胃周幽门下组可见小淋巴结,未见明显远处转移征象。
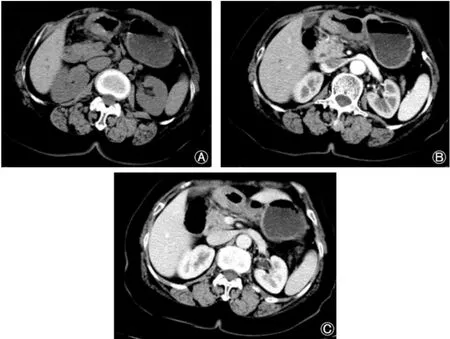
图1 胃IMT CT图像
2.3 回盲部及结肠IMT CT表现
3例病灶均为单发,1例发生于回盲部,2例发生于乙状结肠。2例表现为肠道表面外生性肿块,呈囊实性,增强扫描后实性部分表现为明显强化,病灶内囊性成分未见强化;位于回盲部者病灶周围脂肪间隙模糊,见条片状渗出,周围系膜区多发增大淋巴结,正常阑尾未见显影,术前该例病灶误诊为阑尾脓肿;位于乙状结肠者病灶边缘光整(图2),与右侧附件及乙状结肠分界不清,肠壁未见明显增厚,术前该例病灶误诊为卵巢肿瘤。1例表现为乙状结肠肠壁不规则增厚伴腔内软组织肿块、肠腔变窄(图3),密度均匀,其浆膜面模糊,肠周系膜区见多发肿大淋巴结。所有3例患者均未见远处转移征象。
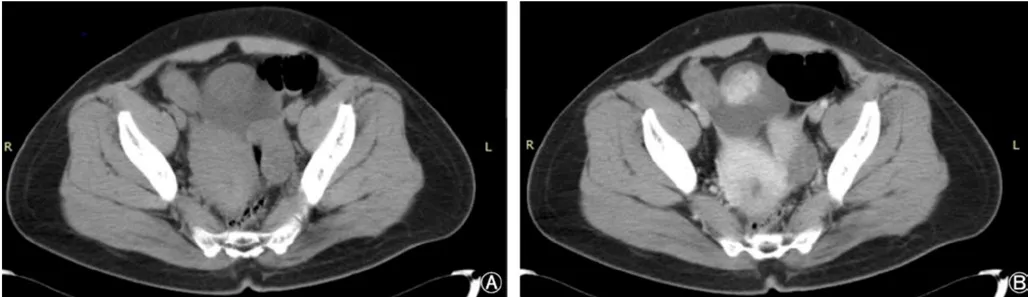
图2 结肠IMT CT表现之一
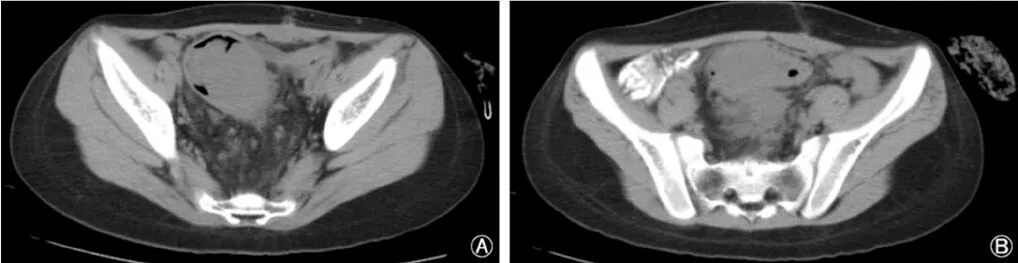
图3 结肠IMT CT表现之二
2.4 病理表现
所有4例患者均进行手术并完整切除肿瘤,术后均取得常规病理及免疫组化结果。免疫组化结果显示:CD34(+)4例、SMA(+)3例;S-100(+)2例、Ⅴim(+)3例、ALK(+)3例、Ki-67阳性指数约5%。
3 讨论
3.1 IMT的临床与病理学特征
IMT发病率低,其病因及发病机制目前还不明确,可能与外伤、手术、异常修复、自身免疫以及感染性因素等有关;有研究表明,间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排在IMT的发生中可能起到一定的作用[2]。IMT可发生于各个年龄,胃肠道IMT既往病例报道显示以年轻人多见[3-4]。其临床表现无特异性,因肿瘤发生部位不同可引起相应症状[5],常表现为腹痛、恶心、排便困难、发热等相应症状,部分患者也可因体检发现而无任何症状就诊。IMT生物学行为属于中间型,该肿瘤侵犯周围器官及远处转移少见,目前最有效的治疗方案以完整手术切除为主,大多数患者预后较好,但具有一定的复发倾向[4,6]。本组资料中1 例因肠周多发肿大淋巴结而转移;其余3例IMT未见周围侵犯及远处转移征象。
IMT镜下可见增生的肌纤维母细胞、纤维母细胞和炎性细胞浸润;其组织学形态因各组成成分比例不同表现多样,可分为富于黏液/血管型、富于细胞型和少细胞纤维型三种亚型[6]。富于黏液/血管型表现为肿瘤间质大量黏液样变,其内伴大量血管增生,并见炎性细胞浸润;富于细胞型表现为梭形肿瘤细胞大量增生,紧密排列,炎性细胞浸润穿插其中;少细胞纤维型,表现为肿瘤细胞排列稀疏,细胞间见瘢痕样增生的胶原纤维,炎性细胞浸润少。上述三种表现可单独存或混合存在。在免疫组化上,肿瘤细胞可不同程度表达SMA、MSA、部分可表达CKpan[5,7]。大约50%~60%病例表达ALK蛋白,免疫组化ALK蛋白表达与ALK基因重排具有很好的一致性[5,7];本组病例3例ALK蛋白表达阴性,1例未检测。
3.2 胃肠道IMT影像表现
胃肠道IMT以往影像相关文献以个案报道多见,笔者对本组资料进行回顾性分析,并结合此前相关文献报道,拟对胃肠道IMT CT表现进行总结。
胃肠道IMT CT直接征象大致可分为腔内型或腔外型。腔内型[3,8-10]:胃肠道壁局限性增厚伴局部软组织肿块形成,软组织肿块形态不规则,平扫密度均匀或不均匀,增强后病灶表现为持续性、渐进性强化,可见受累胃肠道壁浆膜面毛糙,灶周可见不同程度渗出,临近肠系膜区可见增大/肿大淋巴结影;部分可表现为受累胃肠道壁增厚;腔内型IMT可因胃肠道腔狭窄引起消化道梗阻。腔外型:胃肠道壁表面实性或囊实性肿块影[8,11-12],病灶形态不规则,边界清晰/不清晰,增强后实性成分呈持续性、渐进性强化,囊性成分无强化。IMT病灶CT表现因肿瘤各组成成分比例不同而各异。肿瘤纤维成分较多者,CT增强多呈轻中度持续、渐进性强化;肿瘤富于黏液、间质血管增生及炎症细胞浸润较多者,增强呈明显强化,本组资料中1例乙状结肠腔外型IMT(图2)CT表现符合,镜下呈富于黏液/血管型;肿瘤梭形细胞较丰富者,呈延迟、明显强化,本组中1例胃IMT(图1)和1例回盲部腔外型IMT表现符合,镜下呈富于细胞型;另1例乙状结肠腔内型IMT(图3)为混合型,镜下见大量梭形细胞增生、间质黏液变伴血管增生混合存在。
综上所述,CT表现为胃肠道壁腔内/外软组织肿块,病灶周围脂肪间隙清晰/不清晰,增强呈持续、渐进性强化时需考虑到胃肠道IMT的可能性;胃肠道IMT影像学表现多样,术前准确诊断困难,但具有一定的特征性;但IMT最终确诊仍需依赖病理、免疫组化检查。

