经颅多普勒、Rotterdam CT评分联合颅内压检测在重症颅脑损伤患者预后判断中的应用
范家权,杨建业,顾磊,霍健,杨先清
颅脑损伤(traumatic brain injury,TBI)虽然占全身创伤性疾病的比例不足20%,但由于TBI会引起大脑正常结构和功能的破坏,因此死亡率及重度残疾的发生率极高[1]。根据损伤部位及病理的分类方式无法明确显示TBI的严重程度及病情动态变化趋势,因此临床上以患者的格拉斯哥昏迷量表评分(Glasgow coma score,GCS)以及伤后原发昏迷时间来将患者分为轻型、中型、重型以及特重型,重型及特重型引起的高病死率及致残率成为临床的研究热点之一[2-3]。颅内压(intracranial pressure,ICP)升高作为引起TBI患者术后病情恶化、预后不良以及死亡的主要原因[4],随着ICP检测技术的推广及普及,可明显改善重型TBI患者的临床管理及预后[5];头颅CT则是TBI患者病情诊断及评估的主要手段,鹿特丹(Rotterdam)CT评分是基于TBI患者多个CT影像特征计算得到的评分,在不同背景、不同评分者之间的重复性较好,具有一定预测TBI患者预后的价值[6];经颅多普勒能够迅速、无创、实时地评估脑血管功能,在TBI患者的早期预警、指导治疗及改善临床预后中,发挥着重要的作用[7]。重症TBI患者的病理生理机制复杂,有创ICP检测存在颅内感染、继发再出血风险,颅脑CT无法进行动态连续监测,经颅多普勒结果受到脑血流及脑血管活性等影响,因此需要多种检测手段适当的结合来实现多模态、个性化精准治疗[8]。本研究纳入2017年6月—2020年1月六安市中医院收治的80例重症TBI患者,通过探讨经颅多普勒、Rotterdam CT评分联合ICP检测在重症TBI患者预后判断中的应用价值,旨在为此类患者的个体化精准治疗及预后评估提高临床依据。现报告如下。
1 资料与方法
1.1 一般资料 共80例患者,其中男56例,女24例;年龄23~60岁,平均(42.5±8.3)岁;高处坠落26例,车祸24例,摔倒18例,打击伤9例,其他3例;平均急性生理学和慢性健康状况II(APACHE II)评分(26.9±7.1)分;平均GCS评分(7.1±0.9)分。纳入标准:(1)闭合性重症TBI患者(GCS评分3~8分);(2)有明确TBI史;(3)年龄16~65岁;(4)接受手术治疗,且术后严格重症监护治疗≥7 d;(5)受伤至入院时间≤12 h;(6)接受脑室型颅内压探头植入术;(7)随访时间≥3个月。排除标准:(1)受伤至入院时间>12 h;(2)开放性TBI患者;(3)严重胸、腹部、四肢或骨盆骨折无法耐受开颅手术者;(4)近期内未接受过颅内占位病变切除手术;(5)双瞳散大、脑疝晚期;(6)合并严重心、肝、肺、肾等功能障碍者;(7)既往存在凝血异常或使用抗凝药物者。本研究经医院伦理委员会审核批准(批号:L2017-012)。
1.2 方法
1.2.1 ICP监测 利用Codman有创ICP检测仪(美国强生公司)对所有患者进行有创ICP检测。具体步骤:剃去患者头发,选择脑挫伤、脑内血肿对侧的侧脑室额角为穿刺部位,常规消毒、铺巾后于冠状缝前2.5 cm以中线旁开2.5 cm,利多卡因浸润麻醉钻孔,将脑室型ICP监测探头进行穿刺,注意保持穿刺方向与矢状面平行,穿刺成功后外部固定颅内ICP监测探头、连续记录ICP,注意患者生命体征、意识及瞳孔的变化,并根据ICP变化调整治疗方案。
1.2.2 颅脑CT评分 患者入院后尽快接受头颅CT扫描,所有患者均由同一放射科医师采用德国西门子SIEMENS 64排螺旋CT机进行检查,扫描层面与眦耳线平行,后颅窝每5 mm 1层,向上抑制到颅顶10 mm 1层,以入院7 d内基底池情况、中线移位、脑室受压情况最严重的头颅CT表现计算Rotterdam CT评分。具体计算方式:基底池正常、受压、消失分别记为0、1、2分;中线移位≤5 mm或>5 mm分别记为0、1分;不存在或存在血肿(占位性病变)分别记为0、1分;不存在或存在蛛网膜下腔出血分别记为0、1分;总分分值越高表示颅脑损伤越严重[9]。由两名高年资的放射科医师进行双盲法评估。
1.2.3 经颅多普勒检测 由同一放射科医师利用EMS-9U型超声经颅多普勒血流仪(德力凯公司)检测脑血流变化。患者保持仰卧位,头置正位,使用2 MHz 脉冲多普勒探头沿颧弓上方眼眶外缘与耳翼之间的颞骨鳞部采集数据,检测深度在50~70 mm之间,主要记录峰值收缩速度、舒张末期速度、平均最大速度及搏动指数(Pulsatility index,PI),连续监测7 d。
1.3 治疗 严格遵守中国颅脑创伤外科手术指南[10]进行治疗,患者入院后接受神经外科重症监护,密切观察病情变化,保持呼吸道通畅,降低ICP及神经影响,有手术指征时积极手术治疗。
1.4 预后指标 根据术后3个月时格拉斯哥预后量表评分(Glasgow outcomes scores,GOS)情况来判断患者预后:GOS 1分为死亡;2分为植物生存;3分为重度残疾,意识清楚但生活不能自理;4分为轻度残疾,生活能自理;5分为恢复良好,正常生活但有轻度神经障碍。以GOS 1~3分为预后不良;GOS 4~5分为预后良好。
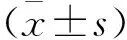
2 结 果
2.1 不同预后重症TBI患者的一般资料比较 80例患者中,有32例(40.0%)预后良好,48例(60.0%)预后不良。两组患者的性别、年龄、致病原因、APACHEII评分等比较无统计学差异(P>0.05),预后不良组患者的入院时GCS评分要低于预后良好组(P<0.05)。见表1。
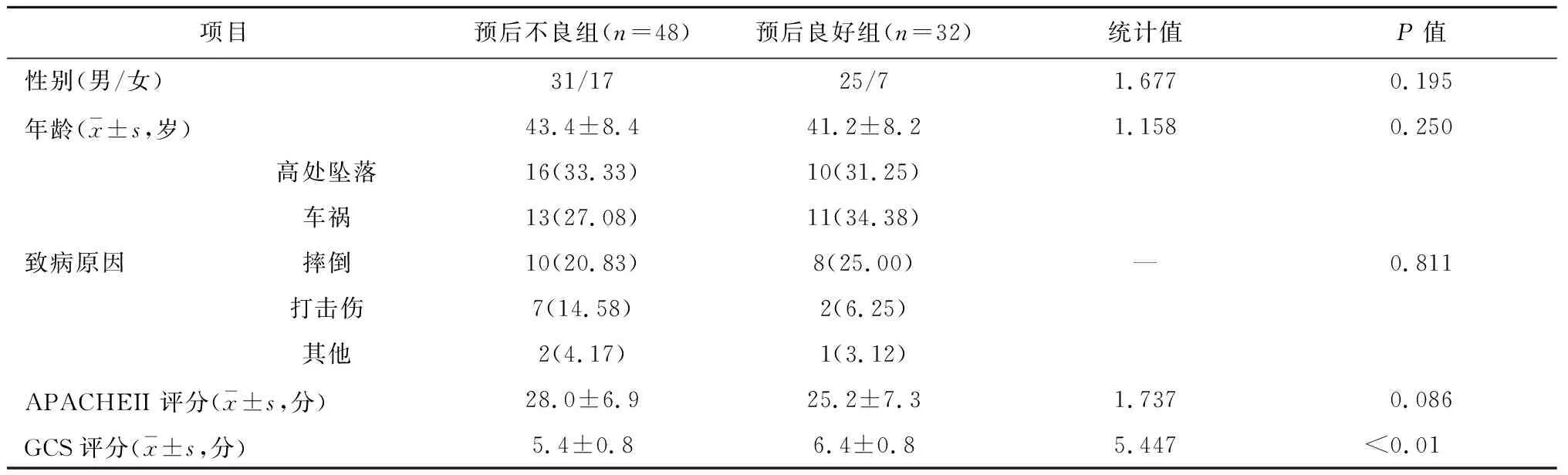
表1 不同预后重症TBI患者的一般资料比较
2.2 不同预后重症TBI患者入院后不同时间点PI、ICP变化分析 与术后1 d比较,预后良好组患者术后3、7 d时PI、ICP降低,预后不良组患者3、7 d时PI、ICP升高,且预后不良组术后1、3、7 d时PI、ICP均高于预后良好组,差异有统计学意义(P<0.05)。见表2、图1。

表2 不同预后重症TBI患者入院后不同时间点PI、ICP变化分析

A:入院后第1 d; B:入院后第3 d; C:入院后第7 d
2.3 不同Rotterdam CT评分患者的预后不良率及病死率分析 Rotterdam CT评分4~6分之间患者术后3个月病死率与预后不良率之间比较有统计学差异(均P<0.05)。见表3。
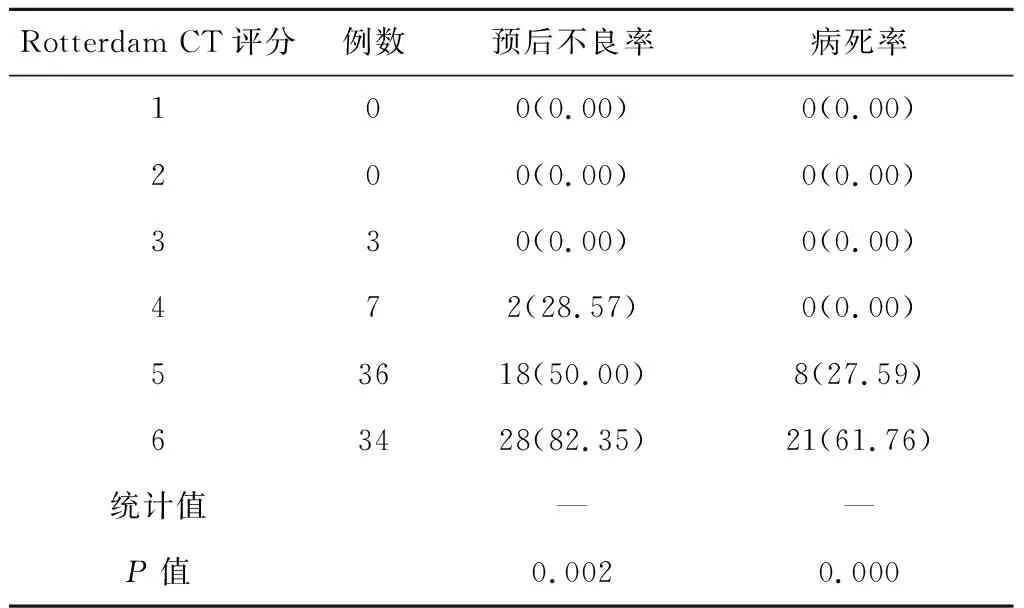
表3 不同Rotterdam CT评分患者的预后不良率及病死率分析
2.4 PI、ICP、Rotterdam CT评分与GOS评分的相关性分析 GOS评分与Rotterdam CT评分、PI、ICP均呈负相关(r=-0.682、-0.658、-0.309,P<0.01)。见图2。
2.5 PI、ICP、Rotterdam CT评分单独及联合判断重症TBI患者预后分析 PI、ICP、Rotterdam CT评分用ROC单独及联合判断预后的AUC分别为0.850、0.857、0.658、0.927,95%CI分别为0.752~0.920、0.761~0.926、0.543~0.760、0.847~0.973,联合判断的AUC均高于PI、ICP、Rotterdam CT评分单独判断的AUC(Z=2.182、2.359、4.658,P<0.05)。见图3。
3 讨 论
颅脑外伤后的损伤过程分为两个阶段,首先是在外力作用下导致脑组织结构损伤,也就是原发性脑损伤,而脑组织结构的破坏会导致脑血管及血液学的变化,导致脑组织血氧供应不足,最终引起神经元细胞、胶质细胞以及血管内皮细胞的死亡[3,11]。虽然ICP监测的普及能够让临床医师对TBI患者的病情判断更迅速、准确,并在一定程度上改善患者的预后[12],但由于重症TBI患者脑损伤的两个阶段可相继或同时出现,病情更为复杂,因此结合多种检测方式来更好地掌握患者病情,判断患者预后至关重要。
经颅多普勒通过监测颅内大动脉的血流图谱,来获取颅内相关血流动力学信息,从而用于评估远期预后以及诊断脑死亡[13]。经颅多普勒临床常用的血流动力学参数有峰值收缩速、舒张末期速度、平均血流速度、阻力指数、PI,PI能够反映脑血管的阻力,PI升高时表明远端血管阻力增加[14]。本研究结果显示,预后良好组患者入院后PI随时间而降低,而预后不良组入院后PI随着时间的增长而升高,持续升高的PI表明患者出现颅内压升高,脑灌注压力降低,血流速度降低,可能会导致脑死亡。通过对PI与GOS评分的相关性分析发现,PI与GOS评分呈显著负相关,表明较高的PI可能提示患者预后不良。利用ROC分析发现,PI用于预后判断的AUC为0.850,具有较高的判断价值。但由于PI的测量受到脑血流速度的影响,而脑血流速度又可能受到药物、CO2分压以及患者个体脑血管存在的生理性变异影响,因此其单独用于判断患者预后,尤其是诊断脑死亡时可能会存在假阳性及假阴性结果,因此还需要联合其他的诊断方式来提高诊断准确率[15]。
ICP升高作为重症TBI患者病情恶化、致残、致死的主要原因之一,相关研究指出ICP升高是TBI患者死亡的独立危险因素[16],有效监控重症TBI患者的ICP对于降低其病死率具有重要意义[17]。目前ICP检测可分为有创及无创两种,但目前无创ICP检测到的数值不准,因此还是以有创检测为主[18]。脑室型ICP检测方法简便、客观、准确,并且能够打开导管引流脑脊液,来降低重症TBI患者的ICP[19]。本研究结果显示,预后良好组患者入院后ICP随着时间而降低,而预后不良组入院后ICP随着时间升高,持续升高的ICP表明患者可能处于持续低灌注,而长时间脑室内ICP检测,会提高颅内感染的发生率,与患者处于昏迷,自身抵抗能力降低有关[20]。同时本研究还发现,ICP水平与GOS评分呈负相关,与Güiza等[21]研究一致,表明ICP具有较高的判断患者预后的价值。本研究通过ROC结果发现,ICP水平判断患者预后不良的AUC为0.857,具有较高的判断价值。但对于脑室受压、移位甚至消失的患者,脑室ICP检测的穿刺难度较高,可能使得其检测的数据不准确,从而出现假阴性情况,故而需要通过其他方式来提高准确率。
头颅CT扫描作为TBI患者诊断及病情评估的重要手段,Maas等[22]在Marshall评分的基础上,根据头颅平扫的基底池、中线位置偏移、脑内血肿和是否合并脑室内或蛛网膜下腔出血建立了Rotterdam CT评分。该评分与伤后6个月的病死率关系密切,尤其是对占位损伤患者预后的辨别力较高[23]。本研究发现对于Rotterdam CT评分4~6分之间患者术后3个月病死率与预后不良率之间关系密切,相关性分析也证实了Rotterdam CT评分与GOS评分呈负相关。张博等[24]认为Rotterdam CT评分是重症TBI患者预后不良及病死率的独立危险因子,提示Rotterdam CT评分具有判断患者预后的价值。本研究通过ROC结果发现,ICP水平判断患者预后不良的AUC为0.658,具有一定的判断价值。但由于头颅CT评分不能进行连续动态的检测,本次研究用于ROC分析的Rotterdam CT评分是入院7 d内基底池情况、中线移位、脑室受压情况最严重的头颅CT表现计算得到的,因此在病情判断上存在一定的滞后,可能对预后的评估价值较低。
为了进一步提高重症TBI患者预后判断的准确率,本研究分析了PI、Rotterdam CT评分联合ICP检测对预后判断的价值,ROC结果显示联合判断的AUC为0.927要明显高于PI、Rotterdam CT评分、ICP监测单独判断的AUC,提示多角度、多层次的检测能够提供更精准化的干预方式,更准确地判断预后。但本研究也存在一定的局限性,由于纳入样本数较少且是回顾性研究,因此还需要多中心、大量本的前瞻性研究来支持。本研究认为,多角度、多层次的个体化精准化治疗对提高患者的救治水平具有重要意义。
利益冲突:所有作者均声明不存在利益冲突。

