灰树花原生质体高温胁迫条件研究及其再生菌株的胞外酶活性分析*
王春晖,徐 宁,吴 芳,肖颖群,王小艳,姜性坚,张 宇,胡汝晓**
(1.湖南省食用菌研究所,湖南 长沙 410016;2.茶陵县兴农食用菌种植农民专业合作社,湖南 株洲 412415)
灰树花 (Grifola frondosa)又名莲花菌、栗蘑、舞茸等。其以阔叶林木屑为主要营养基质,是典型的木腐真菌。分类上隶属伞菌纲(Agaricomycetes)多孔菌目(Polyporales) 薄孔菌科(Meripilaceae) 树花菌属(Grifola)。90年代我国灰树花驯化栽培研究取得成功[1],2000年以来在品种的遗传多样性、生物学特性及栽培技术等方面开展了探索[2-3],不同原产地和不同生态类型的菌株也逐渐增多,促进了我国灰树花栽培品种及产业化栽培技术的进步发展。灰树花不仅风味浓香,味道鲜美,具有极高的食用价值,且富含抗氧化、抗病毒、抗肿瘤等多种活性成分[4-5],是颇具研究价值与开发潜力的食用菌。
食用菌在无性繁殖过程中种性会出现退化现象[6],引起菌丝类型变化,双核菌丝相对减少,单核菌丝相对增多,并伴随着形态、生理、遗传等方面的变化和衰退[7]。灰树花种性退化现象明显,母种多次无性扩繁,会使菌丝变得纤细、生长速度变缓、抗逆性减弱、原基数量减少、生物学效率降低,影响产量、品质与效益。目前常用组织分离和孢子分离方法进行菌种复壮。组织分离由子实体再生而成,无遗传因子的重组,复壮效果不好;孢子分离虽有遗传因子的重组,但遗传背景复杂,缺乏标记,筛选难度大,复壮时间较组织分离长。
真菌原生质体具有细胞全能性,是遗传育种的良好材料。许多学者在原生质体分离、再生、诱变、融合等方面开展了大量试验[8-9],应用分子生物学技术,取得了一系列研究成果[10]。薛平海等[11]对灰树花原生质体的制备和再生条件开展了研究;杨军等[12]获得灰树花原生质体单核体,进行了孢子单核体交配型分类与鉴定。关于灰树花原生质体高温胁迫条件及其再生菌株胞外酶活性的研究与分析,尚未有相关文献报道。因此,通过高温胁迫试验,揭示灰树花原生质体高温胁迫条件以及其再生菌株在胞外酶活性的个体差异,为灰树花和其他食用真菌品种复壮与选育研究提供科学依据。
1 材料与方法
1.1 供试菌株
灰树花2#,由湖南省食用菌研究所提供。
1.2 药品与试剂
溶壁酶(Lywallzyme)、纤维素酶(Cellulases)、蜗牛酶(Snailase),由湖南海全医疗科技有限公司提供 (进口分装);MgSO4、KH2PO4、K2HPO4、KCl、蔗糖、甘露醇、葡萄糖、蛋白胨,均为国产分析纯,由长沙先行化工有限公司提供。
1.3 仪器与设备
LMQ.C-50E蒸汽灭菌锅,山东博越科学仪器有限公司;TGL-16高速台式冷冻离心机,湘仪实验室仪器开发有限公司;BX-53荧光显微镜,奥林巴斯(中国)有限公司;SW-CJ-1FD超净工作台,杭州川一实验仪器有限公司;HWS-26恒温水浴锅,苏州江东州精密仪器有限公司;FA1204C分析天平,苏州生物技术有限公司;TS-1102C立式双层恒温摇床,长沙市天恒科学仪器设备有限公司;BCD-272WDPD低温冰箱,海尔智家股份有限公司;Biosafer400up超声波细胞粉碎仪,湖南远泰生物技术有限公司。
1.4 培养基配制
普通培养基:去皮马铃薯200 g、葡萄糖25 g、蛋白胨 2.5 g、MgSO41 g、KH2PO40.5 g、 K2HPO41 g,煮沸10 min,3层纱布过滤,定容至1 000 mL,加琼脂25 g,用于菌丝体培养。液体培养基:普通培养基不加琼脂,加羧甲基纤维素纳10 g,用于液体菌丝培养。再生培养基:以液体培养基为基液,用0.55 mol·L-1KCl等渗液配制再生培养基(调节渗透压,保持原生质体形态正常),加0.5%的酵母粉和0.1%的VB1。栽培培养基:木屑70%、玉米芯13%、麦麸10%、腐殖土5%、石膏粉2%,pH 6.0~6.5,含水量60%~65%。上述各类培养基配制后,置高压蒸汽灭菌锅内,121℃~126℃、0.11 MPa~0.14 MPa条件下,液体基质灭菌30 min,固体基质灭菌50 min,冷却至室温备用。
1.5 试验方法
1.5.1 原生质体制备
1)菌丝体培养收集
将灰树花试管种(母种)用普通培养基进行玻璃纸琼脂平板透析培养,待菌落直径达到2.5 cm~3.0 cm时,用接种环将菌落边缘菌丝接入盛有20 mL液体培养基的三角烧瓶中,轻轻摆动接种环,使菌丝分散在液体培养基中,25℃静置,黑暗培养2.5 d~3.5 d,单层无菌滤纸过滤,0.55 mol·L-1KCl等渗液洗涤 2次~3次,3 000 r·min-1离心10 min,去上清,无菌滤纸吸走多余水分,收集灰树花菌丝体,4℃~8℃低温冰箱保存备用。
2) 原生质体分离
根据陆欢等[13]的方法加以改进。称取纤维素酶1 g、溶壁酶 1.5 g、蜗牛酶 1 g,用 0.55 mol·L-1KCl等渗液溶解,后加入等渗液定容至100 mL配成复合酶液,细菌过滤器(4孔,0.45 μm)过滤后,4℃低温保存备用;取2 g菌丝体置50 mL三角烧瓶中,加无菌复合酶液10 mL,置于28℃的恒温摇床中酶解,每隔30分钟启动摇床1次,50 r·min-1持续1 min。酶解4.5 h后,用约0.5 cm厚的无菌脱脂棉过滤,过滤液4 000 r·min-1离心15 min,沉淀物用0.55 mol·L-1KCl等渗液溶解,重复离心1次,再将沉淀用等渗液溶解得到原生质体悬浮液。
3) 纯度与浓度检测
用荧光增白剂检查是否完全去壁,判断原生质体纯度;用血球计数板计算原生质体浓度。测定纯度与浓度后快速加甘油超低温保存。
1.5.2 原生质体高温胁迫和再生
1)原生质体高温胁迫
以胁迫温度和胁迫时间为胁迫参数,按胁迫温度分成5组,每组设5个胁迫时间、1个对照(CK)。操作方法为:在30个100 mL三角烧瓶内分别注入25 mL再生培养基,高压灭菌后冷却至室温,按无菌操作方法,将分离的灰树花2#原生质体用0.55 mol·L-1KCl稀释到 2×104个/mL,在盛有再生培养基的三角烧瓶内分别加入0.1 mL原生质体悬液,分别置42℃、45℃、48℃、51℃、54℃恒温水浴锅中,分别处理0(CK)、3 min、4 min、5 min、6 min、7 min。在确定最适胁迫温度后,根据原生质体致死情况,对0~3 min和7 min~10 min的胁迫时段细分为 0.5 min、1.0 min、1.5 min、2.0 min、2.5 min和 7.5 min、8.0 min、8.5 min、9.0 min、9.5 min,优化胁迫条件,以获得最适胁迫温度下对原生质体致死产生响应的最短胁迫时间(刚引起致死)和原生质体能忍受的最长胁迫时间(刚全部致死)。
2) 胁迫原生质体再生
将高温胁迫后的原生质体置于生化培养箱黑暗静置培养,培养温度为26℃~28℃。显微观察原生质体再生过程,待培养基中出现可见微小再生菌落,用无菌接种针及时挑出再生菌落,放PDA斜面培养基培养,得到原生质体再生菌株。统计不同胁迫量下的再生菌落数量,并按胁迫条件将再生菌株编号为TtMm-1、TtMm-2、TtMm-3……TtMm-N;各编号中t为胁迫温度、m为胁迫时间、TM为胁迫条件、N为本胁迫条件下的再生菌株编号。
1.5.3 原生质体高温胁迫条件筛选
用原生质体致死率衡量高温胁迫对原生质体活性的影响。通过不同温度、不同时间的胁迫参数试验,统计不同胁迫条件下原生质体的致死率,分析在设置的胁迫时间内不同胁迫温度对原生质体的胁迫程度与致死幅度,确定原生质体的最适胁迫温度以及该温度下对原生质体致死产生响应的最短胁迫时间、最长胁迫时间。原生质体致死率(P,%) 依据不同高温胁迫量条件下原生质体再生菌落的数量计算,计算公式为:

式中:N1为未经处理(CK)的原生质体再生菌落数(个);N2为高温胁迫处理后原生质体再生菌落数(个)。
1.5.4 再生菌株的胞外酶酶活力分析
从菌丝浓密、整齐、长速较快且处于最适胁迫温度下的再生菌株中随机挑选3个不同高温胁迫条件的再生菌株,以出发菌株灰树花2#为对照(CK),进行纤维素氧化酶类及木质素氧化酶类分析。纤维素氧化酶类用羧甲基纤维素酶(CMCase) 为衡量指标,木质素氧化酶类用漆酶(Laccase)为衡量指标。每次试验5个重复。数据处理以及统计分析采用MATLAB R2019b和Microsoft Excel。因各试验组之间总体方差不相同,为提高鲁棒性并减少第一型错误,用Welch’s t-test分析组间差异性。
1) 液体培养菌丝体粗酶液的提取
在250 mL三角烧瓶内分别注入50 mL液体培养基,在121℃、0.11 MPa条件下灭菌30 min。冷却至室温后,按无菌操作接入直径10 mm的菌丝块2个~3个,摇床避光培养,150 r·min-1,温度28℃。7 d后置离心管,3 000 r·min-1离心10 min,取上清液于4℃冰箱低温保存,作待测酶液备用。
2) 固体培养菌丝体粗酶液的提取
按栽培培养基配方配料、装瓶、灭菌。冷却至室温后,按无菌操作接入直径1 cm、长度2 cm的斜面试管菌种1块,25℃培养25 d~30 d,即为原种。待菌丝长满瓶底后,从中部取带菌丝的培养基2份,每份30 g。1份用4倍无菌蒸馏水浸泡,超声波捣碎,20℃浸提8 h,3层纱布过滤,3 000 r·min-1离心10 min,上清液为粗酶液,4℃保存备用。另1份用恒温干燥箱在60℃~65℃条件下烘干,称重。
3) 胞外酶酶活力测定方法
漆酶活力测定采用ABTS法[14]。酶活力单位定义为:1 g干培养物(或1 mL菌丝发酵液)中每分钟使OD600值改变0.01的酶量为一个酶活力单位。
羧甲基纤维素酶测定采用DNS法[15]。酶活力单位定义为:1 g干培养物(或1 mL菌丝发酵液) 每10分钟催化底物生成1 mg葡萄糖的酶量为一个酶活力单位。
2 结果与分析
2.1 原生质体高温胁迫条件
不同高温胁迫条件对灰树花原生质体致死的影响见表1~表7。
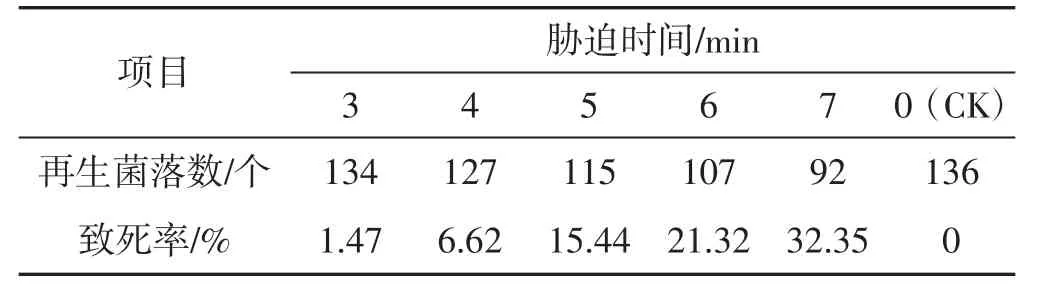
表1 42℃不同时间下原生质体致死率统计结果Tab.1 Lethality rate of protoplasts under different time with 42℃
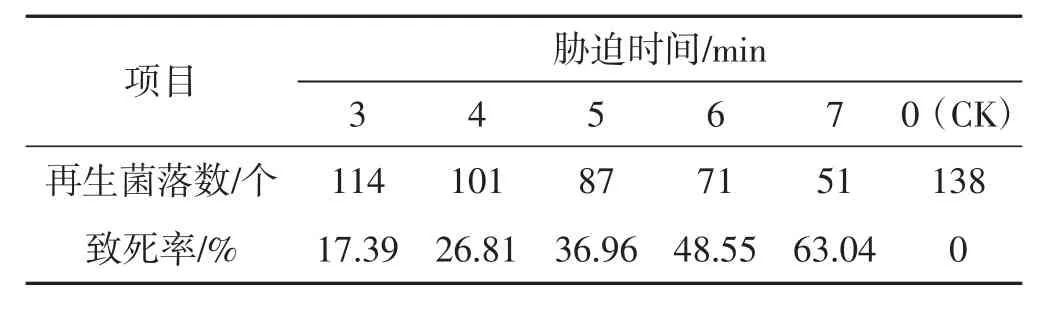
表2 45℃不同时间下原生质体致死率统计结果Tab.2 Lethality rate of protoplasts under different time with 45℃
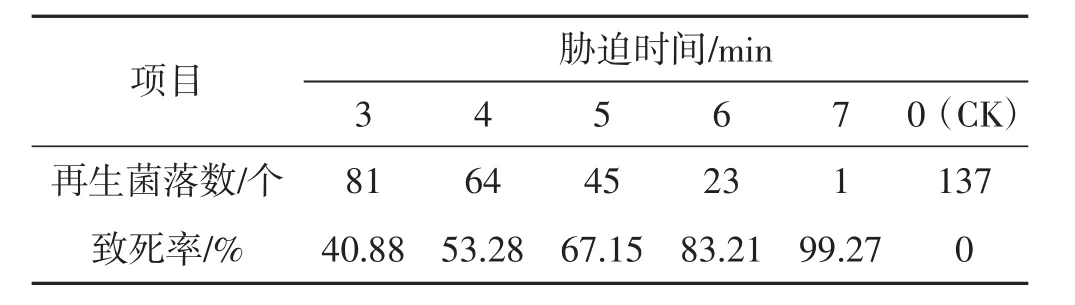
表3 48℃不同时间下原生质体致死率统计结果Tab.3 Lethality rate of protoplasts under different time with 48℃
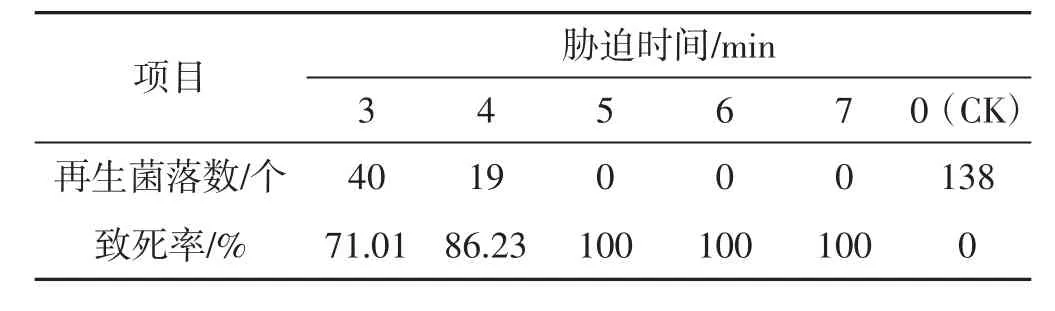
表4 51℃不同时间下原生质体致死率统计结果Tab.4 Lethality rate of protoplasts under different time with 51℃
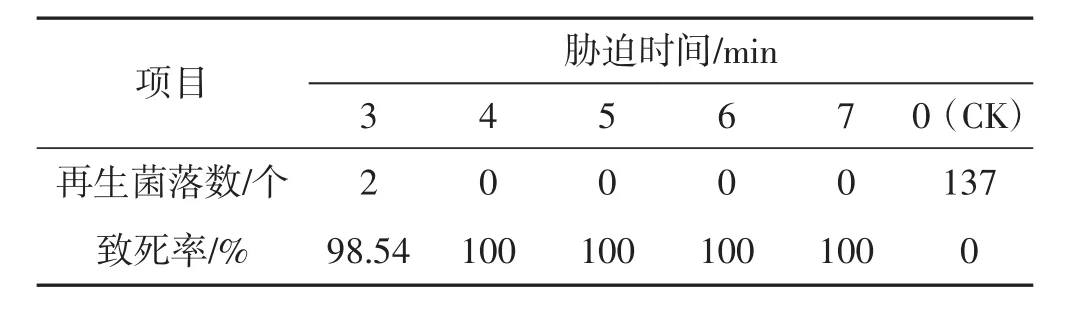
表5 54℃不同时间下原生质体致死率统计结果Tab.5 Lethality rate of protoplasts under different time with 54℃
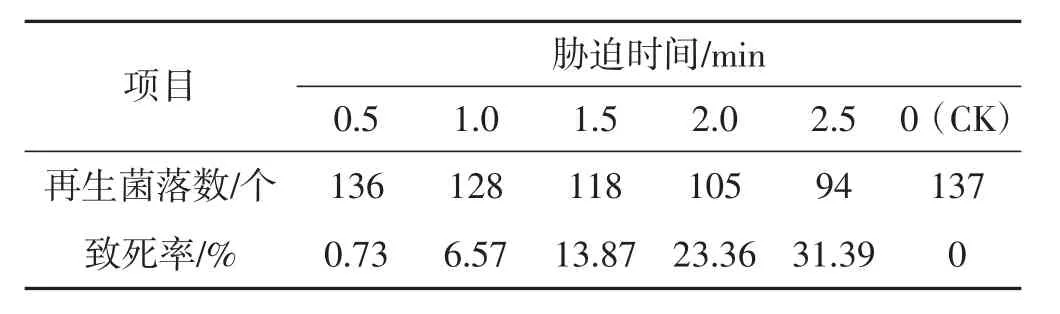
表6 48℃下0.5 min~2.5 min时间内原生质体致死率统计结果Tab.6 Lethality rate of 0.5 min-2.5 minprotoplasts under different time with 48℃
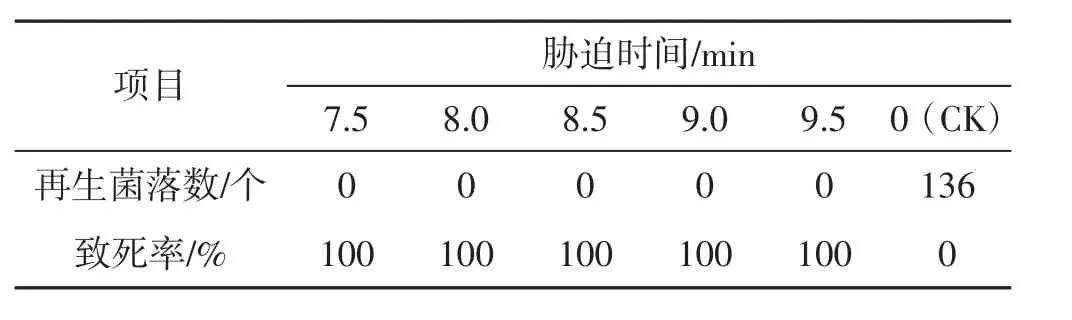
表7 48℃下7.5 min~9.5 min时间内原生质体致死率统计结果Tab.7 Lethality rate of protoplasts under 7.5 min-9.5 min conditions with 48℃
由表1及表2可知,分别在42℃、45℃,3 min~7 min胁迫条件下,原生质体致死率为1.47%~63.04%,在设置时间内未能使原生质体全部胁迫致死,可见该胁迫温度过低。由表4及表5参数可知,在51℃、54℃,3 min~7 min胁迫条件下,原生质体致死率为71.01%~100%,胁迫致死时间为3 min~4 min,致死率幅度大,胁迫时间短、胁迫速度快,可见,该胁迫温度过高。由表3可知,在48℃,3 min~7 min胁迫条件下,原生质体致死率为40.88%~99.27%,致死幅度与胁迫速度均匀,在设置时间内原生质体接近全部胁迫致死,可见该胁迫温度(48℃) 为灰树花2#原生质体高温胁迫的最适胁迫温度,该胁迫温度下原生质体可忍受的最大胁迫量为48℃、7min。由表6可知,在48℃、0.5min~2.5min胁迫条件下,原生质体致死率为0.73%~31.39%,当胁迫时间为0.5 min时,致死率为0.73%,接近对照。可见,该胁迫温度下可使原生质体致死发生响应的最短胁迫时间为0.5 min。由表7表明,在48℃,7.5 min~9.5 min胁迫条件下,原生质体致死率为100%,7.5 min时原生质体已全部致死。综合上述结果可得:灰树花2#原生质体高温胁迫致死的胁迫条件为48℃、0.5 min~7.5 min。
2.2 再生菌株的胞外酶活性分析
不同高温胁迫条件下再生菌株的羧甲基纤维素酶活性和漆酶活性见表8和表9。
由表8和表9可知,固体培养的再生菌株T48M3-36、T48M5-19和T48M7-1,以及出发菌株灰树花2#的羧甲基纤维素酶活性分别为(17.38±1.60) U·g-1、(17.50±1.35)U·g-1、(20.41±2.16)U·g-1、(14.71±1.36) U·g-1,漆酶活性分别为 (69.78±2.54) U·g-1、(69.95 ± 2.71)U·g-1、(73.82±3.10) U·g-1、(64.55 ±2.18) U·g-1;液体培养的羧甲基纤维素酶活性分别为 (27.44±1.826)U·mL-1、(22.70±1.53)U·mL-1、(26.63±2.63)U·mL-1、(19.40±2.25)U·mL-1,漆酶活性分别为 (49.90±2.45)U·mL-1、(49.62±2.62)U·mL-1、(52.67 ± 3.22) U·mL-1、(44.64 ± 1.90)U·mL-1。3个再生菌株的羧甲基纤维素酶活性和漆酶活性均极显著高于出发菌株灰树花2#(P<0.01)。T48M7-1菌株的固体培养基羧甲基纤维素酶活性、液体培养基羧甲基纤维素酶活性和固体培养基漆酶活性高于T48M5-19菌株和T48M3-36菌株,且差异显著(P<0.05)。再生菌株酶活高于出发菌株以及再生菌株之间酶活存在差异的原因,可能是高温胁迫使遗传因子差、酶活性低、生命力弱的原生质体失活,使遗传因子优、酶活性高、生命力强的原生质体得以再生,也包括正向突变和重组在内的变异,起到了提纯复壮或优化改良作用。试验结果与王谦等[16]从红桃侧耳(Pleurotus djamor)原生质体再生菌株中筛选出优良菌株以及张运峰等[17]发现平菇(Pleurotus ostreatus) 原生质体再生菌株间的遗传多样性存在显著差异的研究结论相一致。

表8 不同再生菌株的羧甲基纤维素酶活力比较Tab.8 Comparison of CMCase activity in different regeneration strains

表9 不同再生菌株的漆酶活力比较Tab.9 Comparison of laccase activity in different regeneration strains
3 讨论与小结
相同条件下制备的原生质体其再生活性存在个体差异,耐热性好的耐受时间长,耐热性差的耐受时间短。其原因可能是在原生质体形成过程中,菌丝内的细胞核及细胞器发生随机分配,产生无核、单核、双核及多核原生质体,细胞核及细胞器数量的变化,也包括突变和重组在内的变异,使分离后的原生质体在基因组成上产生个体差异,进而引起原生质体在再生活力上的个体差异。分离后的原生质体在基因组成上的个体差异也为其再生菌株在生物学特性上的变异提供了生物学依据。与单核原生质体、同核原生质体及巨大原生质体的研究价值一样[18-19],开展原生质体的个性研究,探索原生质体在基因组成、酶系酶活、代谢功能及活力抗性等方面的个体差异,揭示不同原生质体的个体特点、特性和生命规律。可为原生质体在品种复壮、选育及改良上的应用提供更丰富和更精细的研究材料;提高原生质体育种技术的特异性、精准性及高效性。促进原生质体育种技术的不断深入,具有极大的研究价值和应用潜力。
试验中探究了灰树花原生质体高温胁迫条件及其再生菌株的胞外酶活性。试验结果与数据分析表明,灰树花2#原生质体高温致死胁迫的条件为:最适胁迫致死温度为48℃,该温度下使原生质体致死的最短胁迫时间为0.5 min,使原生质体全部致死的最长胁迫时间为7.5 min,胁迫条件为48℃、0.5 min~7.5 min。高温胁迫下的原生质体再生菌株的胞外酶活性存在个体差异,不同高温胁迫量下的3个再生菌株的羧甲基纤维素酶活性和漆酶活性均高于出发菌株,且差异极显著(P<0.01),不同高温胁迫量下的再生菌株之间的羧甲基纤维素酶活性和漆酶活性也存在显著差异(P<0.05)。

