不同方法分离的梯棱羊肚菌菌种的交配型检测*
钟 娟,初奕杉,王晓艳,李桂伍,张 平
(湖南师范大学生命科学学院,湖南 长沙 410081)
羊肚菌是羊肚菌属(Morchella) 所有真菌的统称,是一类珍稀食用和药用真菌,具有重要的经济和科研价值[1]。多基因联合分子系统发育学研究表明,羊肚菌属可分为3大类群,分别为黑色羊肚菌类、黄色羊肚菌类和变红羊肚菌类[2-6]。近年来,我国的羊肚菌栽培产业发展迅速,2019年~2021年全国羊肚菌栽培面积近10 000 hm2[7]。栽培成功的主要为黑色羊肚菌类的一些物种,如梯棱羊肚菌(M.importuna)、六妹羊肚菌(M.sextelata)、七妹羊肚菌(M.eximia)、头丝羊肚菌(M.exuberans)、欧氏羊肚菌(M.oweri)、Mel-13和Mel-21,其中梯棱羊肚菌的栽培最广泛[8-10]。
有研究表明,梯棱羊肚菌有性生殖方式为异宗交配[11]。需要2个交配型基因相配的细胞核发生融合后才能完成有性生殖,进而形成子囊果即子实体。菌种是羊肚菌栽培的基础,只有当菌种同时具有2种交配型时,才能保证有性生殖的进行和子实体的产生。
食用菌菌种分离常用的方法有单孢分离法、多孢分离法、组织分离法、基质菌丝分离法[12]。目前在羊肚菌生产中采用的多为单孢法、多孢法和组织法,基质菌丝分离法很少被采用。不同分离方法获得的菌种的交配型有所不同,有研究表明单孢法分离的羊肚菌菌株大部分只具有一种交配型(MAT1-1-1或MAT1-2-1)[13-14],还有研究表明羊肚菌组织分离获得的菌株存在交配型基因缺失现象[15]。
通过研究采用组织分离法、单孢分离法和多孢分离法3种不同方式分别获得梯棱羊肚菌的菌种,后采用PCR扩增的方法检测其交配型基因。此外,研究多次继代培养对多孢菌丝体交配型的影响。研究结果旨在为梯棱羊肚菌的栽培生产提供理论支持。
1 材料与方法
1.1 供试子实体
试验所用材料:栽培于湖南师范大学真菌研究室羊肚菌栽培基地的梯棱羊肚菌子实体,由2014年采集的野生梯棱羊肚菌(MHHNU 7946)驯化得到。
培养基类型:PDA培养基,配方为马铃薯200 g·L-1、葡萄糖 20 g·L-1、MgSO42 g·L-1、琼脂 18 g·L-1。
试验所需仪器设备:Motic BA210生物显微镜,麦克奥迪实业集团有限公司;SW-CJ-2FD超净工作台,苏州净化设备有限公司;Hirayama HVE-50高压灭菌锅,日本Hirayama平山制作所株式会社;DK-98-IIA恒温水浴锅,天津泰斯特仪器有限公司;AUY120电子分析天平,日本岛津集团;2.5 μL、10 μL、100 μL、1 000 μL 移液枪、Centrfuge5425 高速离心机和Mastercycler®nexus PCR扩增仪,均为艾本德中国有限公司生产;JY300E电泳仪,北京君意东方电泳设备有限公司;ChemiDoc MP凝胶成像系统,伯乐生命医学产品公司;单孢分离器等。
试验所用试剂:Ezup柱式真菌基因组DNA抽提试剂盒(产品编号B518259-0100),生工生物工程(上海) 股份有限公司;2×Es Taq MasterMix、6×Loading buffer、DL 2 000 Marker和引物,均订购于北京擎科新业生物技术有限公司;TAE电泳缓冲液等。
1.2 菌种分离
组织分离法:用该方法进行了5次重复取样,即选取5个个体健壮、无病虫害的羊肚菌子实体。将无菌单蒸水冲洗过的子实体纵向剖开,用灭菌手术刀分别从菌盖内侧和菌柄内侧削取0.5 cm左右的小块菌肉组织,置于PDA平板培养基中间位置;每个培养皿只放1块菌肉,共转接了10个培养皿;于20℃恒温箱培养,待培养皿中长出菌落后转接至试管斜面培养基上。共对10个无污染的组织进行了菌种分离,其中5个分离自菌盖内侧,5个分离自菌柄内侧。
单孢分离法:由一个孢子萌发的菌丝体是单孢菌株菌丝体,用该方法共对30个单孢子进行了分离。剪取一块无病害的成熟羊肚菌菌盖组织,用镊子夹碎,然后转移到装有玻璃珠和无菌水的三角瓶中,旋转震荡制备成孢子悬浮液。用单孢分离器在显微镜下分离单孢,具体方法参照参考文献[16]。将单个孢子置于平板PDA培养基上,待孢子萌发长出菌落,再转接到试管PDA培养基上继续培养。
多孢分离法:多孢分离采用钩悬法,具体方法参照参考文献[12]。切取一块成熟羊肚菌菌盖,子实层朝下挂在钩上,钩的另一端挂在三角瓶口上,三角瓶内装有PDA培养基。静置12 h,待子囊孢子洒落在培养基表面,取出小钩,继续培养2 d~3 d。待孢子萌发长出菌丝,再转接到试管斜面培养基上。
1.3 多孢菌丝体的继代培养
多孢菌丝体生长到菌落直径约3 cm时,在菌落边缘区域挑取小块培养基,连同其上的菌丝一起转接到新的试管斜面培养基上。如此重复转接,并检测每一代菌种的交配型基因。
1.4 菌种的交配型基因检测
DNA提取:取不同菌种分离方法培养5 d的菌种,从斜面培养基上刮取菌核或菌丝用于提取DNA。DNA提取采用试剂盒法,提取方法按说明书进行。
PCR扩增:交配型基因的扩增方法参照参考文献[13]。PCR反应体积为25 μL,包括12.5 uL的2×PCR Master Mix、9.5 uL的灭菌双蒸水,浓度为10 umol·L-1的正反引物各1 uL和1uL的DNA模板。引物 MAT1-1-1F/R (5′-3′):CCGGTTTATCTTACTGGACTGGTTC/GCTTTCCTCTTCTCTCGTTGCCATA,MAT1-2-1 F/R (5′-3′):CATCTTATTCTGTTAGCCGCCCATC/TACGTGGTGCTCTCGTGCAGATTTT。反应程序为94℃预变性5 min;94℃变性30 s,62℃退火30 s,72℃延伸45 s~60 s,34个循环;72℃延伸7 min;4℃保存。
凝胶电泳检测交配型基因:每个样品分别用MAT1-1-1和MAT1-2-1引物扩增,扩增出的MAT1-1-1基因片段约为600 bp,MAT1-2-1基因片段约为1 000 bp。将2次扩增的PCR产物混合,用1.5%的琼脂糖凝胶电泳后,置于紫外光透射仪上进行观察拍照,若观察到目的条带就说明样品具有相应的交配型基因。
2 结果与分析
2.1 组织分离菌种的交配型基因分布情况
组织分离法共分离得到10个菌丝体,其中5个分离自菌盖内侧组织,经检测均只具有单一交配型基因MAT1-1-1,另外5个菌株分离自菌柄内侧组织,也只检测到单一交配型MAT1-1-1。
2.2 单孢分离菌种的交配型基因分布情况
单孢分离法得到30个梯棱羊肚菌子囊孢子,其中21个孢子萌发产生菌落,其中14个菌株为MAT 1-1-1交配型基因,7个菌株为MAT1-2-1交配型基因。由此可知含MAT1-1-1交配型基因的菌株数量是含MAT1-2-1交配型基因的菌株的2倍。
2.3 多孢分离菌种的交配型基因分布情况
此方法共得到6个多孢菌丝体,分别编号为MS-1~MS-6,经检测这 6个菌丝体均同时具有MAT1-1-1和MAT1-2-1两种交配型基因。
2.4 多孢分离菌种多次传代后交配型的变化
对2.3中6个多孢菌丝体进行多次转接继代培养,共转接了23代。每转接一代分别检测其交配型,试验连续3代确认MAT1-1-1或MAT1-2-1交配型丢失后不再继续检测,其结果见表1。
由表1可知,其中MS-1、MS-3、MS-4菌株在转接到第6代时,其交配型基因MAT1-2-1发生丢失,只剩下MAT1-1-1交配型基因;MS-2在第9代丢失了MAT1-1-1交配型基因;MS-6在第11代丢失了MAT1-1-1交配型基因;MS-5在继代培养了23代后仍存在MAT1-1-1和MAT1-2-1两种交配型基因。
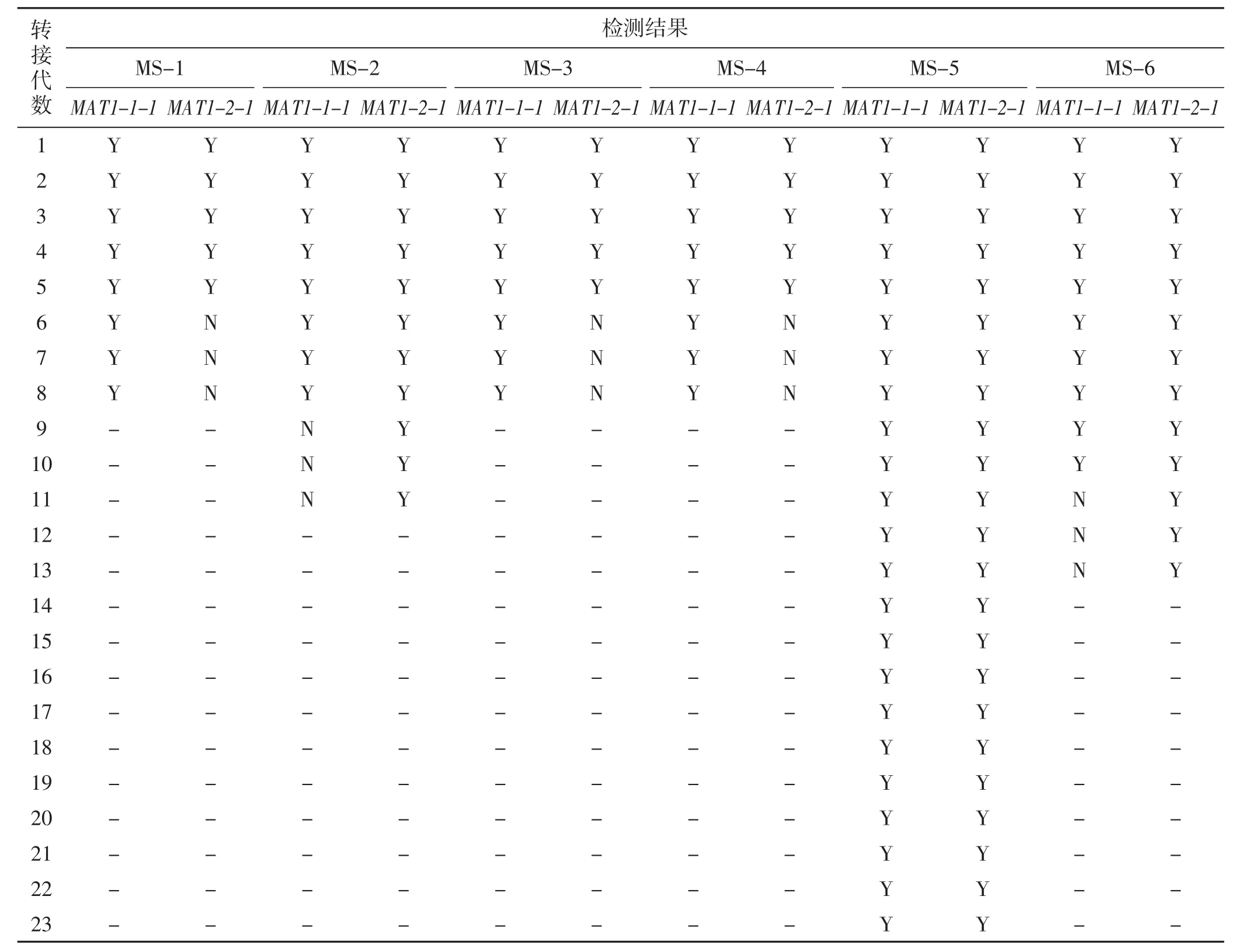
表1 多孢分离菌种继代培养后交配型基因检测结果Tab.1 Mating type genes results of the subcultures of multi-spore strains
3 结论讨论
3.1 梯棱羊肚菌子实体的交配型分布
目前人工栽培的食用菌大多属于担子菌,而梯棱羊肚菌属于子囊菌,其子实体的交配型分布情况较为复杂。杜习慧等[10-11]对梯棱羊肚菌子实体进行了交配型分布检测,发现多数栽培样品的菌柄和子实层均由2种交配型构成;而野生样品交配型分布则不同,仅子实层(可育组织)含2种交配型,而菌柄(不育组织)仅能检测到1种交配型。在本研究中,无论是从菌盖内壁还是从菌柄内壁进行组织分离取材,所得菌株都只有MAT1-1-1一种交配型。菌盖外表面的组织要产生子囊和子囊孢子,必须同时具有MAT1-1-1和MAT1-2-1两种交配型基因。已有报道分析,羊肚菌有3种不同交配型基因分布方式:菌柄和菌盖均有2种交配型基因,菌盖有2种交配型基因而菌柄只有MAT1-1-1交配型基因,以及菌柄和菌盖均只有MAT1-1-1[11]。再结合相关研究进行分析,认为供试子实体的交配型分布方式为:菌盖外层同时具有MAT1-1-1和MAT1-2-1两种交配型,菌盖内层只有MAT1-1-1一种交配型;而菌柄的内层和外层均只有MAT1-1-1一种交配型。目前对羊肚菌交配型基因研究都只对菌柄或菌盖进行检测,而鲜有同时针对菌盖内侧、外侧,菌柄内侧、外侧的交配型基因检测。本研究提供了更加精准的梯棱羊肚菌子实体的交配型分布图。当然,研究的供试子实体来自同一个栽培基地,其他产地栽培出的梯棱羊肚菌子实体的交配型分布情况如何有待进一步研究。组织分离是食用菌菌种分离的常用方法之一,出于无菌的考虑,在羊肚菌组织分离过程中通常是将子实体剖开,从子实体内表面取材。结果可能导致分离到的菌种只有一种交配型。刘伟等[15]在进行羊肚菌组织分离时也发现获得的菌种有一部分只检测到一种交配型基因。
3.2 梯棱羊肚菌菌种的交配型基因丢失现象
已有研究发现梯棱羊肚菌菌种会发生交配型基因丢失现象[13],即原本同时具有MAT1-1-1和MAT1-2-1两种交配型基因的菌种经过一段时间的培养和转接后,只能检测出其中的一种交配型。但对于交配型基因丢失的原因尚不清楚。本研究中分离出的6个多孢菌丝体在第一代时均检测到MAT1-1-1和MAT1-2-1两种交配型基因。但是,将这6个菌株进行多次转接,其中3个菌株在转接到第6代时,丢失了交配型MAT1-2-1,有2个菌株分别在转接到第9代和第11代时丢失了交配型MAT1-1-1,仅有1个菌株在经过23次转接后依然具有MAT1-1-1和MAT1-2-1两种交配型。因此认为梯棱羊肚菌的多孢菌丝体最初包含了多个子囊孢子萌发产生的菌丝,虽然单个子囊孢子只具有1种交配型,但1支试管中具有多个孢子萌发产生的菌丝,即多孢分离法获得的1个菌株是多个不同孢子萌发产生的菌丝混合物。当对整支试管(菌种) 的交配型进行检测时,往往可以检测到2种交配型。这些由不同孢子萌发产生的菌丝在试管中只是混合生长在一起,并没有发生融合。菌丝在斜面培养基上的生长速度和生长方向各不相同,在菌种转接时一般从菌落边缘挑取尖端菌丝。经过反复几次的操作,可能就只挑取到某一孢子产生的菌丝,这时检测其交配型也就只能检测到一种交配型。但这种情况下发生交配型丢失应属人为操作丢失,而不属于菌种自身原因造成的交配型基因丢失。
刘萍等[14]用207对具有不同交配型的梯棱羊肚菌菌株进行对峙培养,发现只有1对表现出营养体亲和,说明营养体(菌丝)不亲和性在梯棱羊肚菌单孢菌株间普遍存在。同时还还发现在供试的6个多孢菌丝体中,有1个菌株在转接23代后依然具有MAT1-1-1和MAT1-2-1两种交配型。产生这一现象的原因可能有以下3个方面:1)转接的代数还不够,若转接更多代,最终还是会出现交配型基因丢失;2)在减数分裂过程中偶尔发生错误,2个交配型不同的细胞核到同一个子囊孢子中,这样的孢子长出的菌丝就具有2种交配型,并且不会随着传代而发生丢失;3)具有不同交配型的菌丝偶尔发生了融合,融合后的菌丝具有2种交配型,也不会随着传代而发生丢失。
3.3 对梯棱羊肚菌栽培生产的指导意义
目前,羊肚菌人工栽培产业在我国发展迅速,但在一些栽培基地会出现出菇少或不出菇的现象[7-9],给菇农带来巨大经济损失,严重阻碍了产业的发展。造成出菇少或不出菇的因素有多种,除气候因素和栽培管理技术的影响外,还有一个重要原因就是菌种交配型基因的缺失。梯棱羊肚菌为异宗结合的真菌,栽培使用的菌种必须同时具有2种交配型,才能保证子实体的形成。研究结果表明,组织分离的梯棱羊肚菌菌种只有一种交配型,若实际应用中使用这样的菌种,很有可能导致不出菇。单孢分离的菌种也只有一种交配型,若使用一个单孢菌种进行栽培,也可能导致不出菇。但如果将2个或多个具有不同交配型的单孢菌种搭配使用,能在一定程度上减少不出菇的风险。
多孢分离的菌株虽然具有2种交配型,但转接次数太多会导致某一交配型丢失,因此生产中使用的多孢菌丝体一旦育成新品种,其菌种应该以冷藏或冷冻的方式进行保藏,避免多次传代,最好每年重新分离。无论是哪种方法分离的菌种,在大规模投入使用前都必须进行交配型基因检测。交配型基因检测应该成为制种单位对梯棱羊肚菌菌种进行质量评价的指标之一。

