猪源嗜酸乳杆菌La-0231菌粉生产工艺优化
宋士良
(上海邦成生物工程有限公司,上海 201506)
嗜酸乳杆菌(Lactobacillusacidophilus),1900年首先从婴儿粪便中分离出来,当时被命名为嗜酸芽孢杆菌(Bacillusacidophilus)。1970年经Hanson和Moquot重新鉴定、分类后,修改为现在的名称,属于乳杆菌属,革兰氏阳性杆菌。国外专家称它是GRAS,即公认安全的食品微生物[1]。嗜酸乳杆菌是少数可以存活并定植于人或动物肠道内的益生菌之一,其在肠道内的定植能力强于其它微生物。它能竞争性地定植于小肠上皮细胞,产生细菌素和有机酸,维持肠道内低pH环境,促进肠道中微生态环境的正常化[2]。赵臣等[3]测定了一株猪源嗜酸乳杆菌的体外生物学特性。采用试剂盒法测定了该菌株的产酸力和抗氧化性能;采用琼脂平板扩散法检测了该菌株的抑菌特性;使用猪肠上皮细胞测定了该菌株的黏附性能。Matthew等[4]研究发现嗜酸乳杆菌在鸡体内大量存在,能利用各种碳源生长,耐胆汁、耐酸,能在pH3.00的环境下,存活5 h;代谢乳糖,产生抗菌物质,生物合成乳酸。嗜酸乳杆菌作为动物肠道中重要的益生菌,具有维护动物肠道健康、缓解不良应激、改善饲养环境、调节机体脂肪代谢和改善畜禽产品品质等功能[5]。嗜酸乳杆菌La-0231来源于猪肠道,经测定其耐酸、耐胆盐能力强。研究的目的是为了优化其菌粉生产工艺。
1 材料与方法
1.1 试验材料
1.1.1 供试菌种 嗜酸乳杆菌,由本公司分离自猪肠道,保藏菌株号La-0231。
1.1.2 培养基 固体斜面培养基(MRS):葡萄糖20 g/L,蛋白胨10 g/L,牛肉膏10 g/L,酵母浸膏5 g/L,乙酸钠5 g/L,柠檬酸氢二铵2 g/L,K2HPO42 g/L,MgSO4·7H2O 0.58 g/L,MnSO4·4H2O 0.25 g/L,1 mL/L吐温80,琼脂18 g/L(液体MRS培养基不加琼脂),pH6.20~6.40。种子培养基:葡萄糖20 g/L,蛋白胨15 g/L,牛肉浸粉10 g/L,酵母浸膏5 g/L,乙酸钠5 g/L,柠檬酸氢二铵2 g/L,K2HPO42 g/L,CaCl21 g/L,L-半胱氨酸盐酸盐1 g/L,MgSO4·7H2O 0.5 g/L,MnSO4·4H2O 0.25 g/L,1 mL/L吐温80。发酵培养基:葡萄糖20 g/L,蛋白胨10 g/L,牛肉浸粉10 g/L,酵母浸膏5 g/L,乙酸钠5 g/L,柠檬酸氢二铵2 g/L,K2HPO42 g/L,CaCl21 g/L,L-半胱氨酸盐酸盐0.5 g/L,MgSO4·7H2O 0.5 g/L,MnSO4·4H2O 0.25 g/L,1 mL/L吐温80;豆粕水解物6.00 g/L;复合氨基酸0.25 g/L(异亮氨酸0.05 g/L、半胱氨酸0.05 g/L、天门冬氨酸0.05 g/L、丙氨酸0.05 g/L、赖氨酸0.05 g/L)。以上培养基均经118 ℃灭菌20 min处理。复合氨基酸装玻璃三角瓶,115 ℃灭菌15 min,单独灭菌处理。
1.2 试验方法
1.2.1 一级摇瓶种子培养方法
1.2.1.1 菌种活化培养 将培养好的斜面菌种接种于活化管种子培养基中,37 ℃恒温静止培养11 h~15 h。
1.2.1.2 一级摇瓶种子培养 按2%接种量将活化种子液转接至装液量为200 mL/250 mL三角瓶的种子培养基中,37 ℃恒温静止培养8 h~12 h。
1.2.2 优化培养试验方法
1.2.2.1 培养温度的优化 试验选取33 ℃、35 ℃、37 ℃、39 ℃四个温度,采用种子培养基,一级摇瓶培养方法,培养18 h后,取发酵菌液,测定菌液的pH、OD600 nm和CFU/mL值。
1.2.2.2 培养时间的优化 试验选取10 h、14 h、18 h、22 h和26 h五个培养时间,采用种子培养基,一级摇瓶培养方法,培养不同时间,取发酵菌液,测定菌液的pH、OD600 nm和CFU/mL值。
1.2.2.3 培养基起始pH的优化 将种子培养基起始pH值分别调整至5.40、5.80、6.20和6.80,一级摇瓶培养方法,培养18 h,取发酵菌液,测定菌液的pH、OD600 nm和CFU/mL值。
1.2.2.4 培养温度、培养时间和培养基起始pH值的优化组合 采用发酵培养基,一级摇瓶培养方法,L9(34)正交试验,测定各试验号发酵菌液的CFU/mL值。
1.2.3 5吨生产罐发酵试验方法
1.2.3.1 二级摇瓶种子培养 按2%接种量将一级摇瓶种子液转接至装液量为2000 mL/3000 mL三角瓶的种子培养基中,37 ℃恒温静止培养10 h~14 h。
1.2.3.2 种子罐培养 50 L培养基配制及灭菌:将种子培养基原料准确称量后置于约30 L配料桶中,加入约20 L净化水,搅拌溶解后过200目滤布添加到种子罐中,将冲洗配料桶的净化水过200目滤布倒入种子罐中,并补水至罐体适宜容量(95%±5%),80 r/min搅拌5 min,进行灭菌处理。50 L种子罐培养条件:接种量4%,接种后维持罐压0.02Mpa~0.04 MPa,搅拌转速80 min,培养时间8 h~10 h。
1.2.3.3 发酵罐发酵 5吨发酵培养基配制及灭菌:①首先向配料罐中通入约4吨净化水,打开蒸汽阀,使配料罐中的水温维持在40 ℃~60 ℃,打开搅拌机进行搅拌溶解;将发酵培养基原料准确称量后添加到配料罐中进行溶解,时间约为10 min;待物料完全溶解后,打开输送泵,将料液经200目过滤器输送至发酵罐中。然后在配料罐中加入适量净化水清洗配料罐,将清洗后的水经200目过滤器输送至发酵罐中(水量保证灭菌后加入复合氨基酸溶液和接种种子液后的终体积在4500L±100L)。②复合氨基酸配制及灭菌:向备用100升种子罐中注入净化水至罐体容量的90%(保证复合氨基酸溶液灭菌后体积在100L±10L),先对净化水进行121 ℃20 min灭菌处理,灭菌后降温至60 ℃以下,将复合氨基酸准确称量后投入灭过菌的净化水中,搅拌均匀充分溶解后,对复合氨基酸溶液进行115 ℃ 10 min灭菌处理,灭菌结束后降温至室温备用。③氢氧化钠溶液配制及灭菌:先打开进净化水水阀,向350升补碱罐中注入适量净化水,称取适量氢氧化钠,缓慢倒入350L补碱罐中,充分溶解。配制结束后,向罐内通入蒸汽,灭菌压力控制在0.05 Mpa~0.10Mpa,时间15 min,然后关闭蒸汽进气阀,夹层通入冷却水,降温至40±1 ℃,自然冷却待发酵培养基调初始pH。5吨发酵罐培养条件:接种量2%,接种后维持罐压0.02Mpa~0.04 MPa,搅拌转速80 min。
1.2.3.4 流加氢氧化钠溶液发酵试验方法 试验选取流加15%、25%、35%三个浓度的氢氧化钠溶液进行发酵试验,同时测定不同发酵时间发酵液的pH、OD600 nm和CFU/mL值,以确定最佳的氢氧化钠溶液流加浓度和停罐发酵时间。
1.2.4 离心参数的确定试验方法 试验采用管式离心机离心收集菌泥,试验选144、180、216、252和288L/h五个流量值进行离心,在菌泥收得率和菌体存活率之间找到一个平衡点,以最大限度地收得到高活菌存活率的菌泥。
1.2.5 冻干参数的确定试验方法
1.2.5.1 菌泥乳化方法 在300L乳化罐中加入适量净化水,准确称取冻干保护剂各组分(按1 kg菌泥添加脱脂奶粉195 g、海藻糖75 g、蔗糖57 g、甘露醇40 g、甘油30 g配制固体保护剂),按各组分先后程序分别称取并倒入乳化罐中,开启搅拌,搅拌转速80 min,待固体保护剂成分充分溶解后,补足水量,在乳化罐夹套中通入蒸汽进行加温灭菌,灭菌料温维持在115 ℃~118 ℃,时间15 min。灭菌后通冷凝水进行降温,维持罐内料温4 ℃~8 ℃,加入离心收集的菌泥,菌泥:液体保护剂(固体保护剂+水)=1∶2,乳化时间5 min~10 min。
1.2.5.2 预冻温度的确定试验方法 将乳化后的料液装入托盘,控制物料厚度在8 mm~12 mm之间,放入冻干仓,进行冷冻干燥。预冻对菌体在冻干过程中的存活率有重要影响,试验设预冻温度为-30 ℃、-35 ℃、-40 ℃、-45 ℃和-50 ℃五个温度值,预冻1 h,冻干过程物料仓的真空度40 Pa,测定冻干菌粉的CFU/g值和水分含量。
1.2.5.3 真空度的确定试验方法 在冻干过程中,物料仓的真空度是个重要的参数,试验设真空度为30 Pa、40 Pa、50 Pa和60 Pa四个值,测定其对冻干菌粉的CFU/g值和水分含量的影响。
1.2.6 冻干菌粉耐受性测定方法
1.2.6.1 酸耐受性测试方法 称取4 g待测冻干菌粉溶解于36 mL无菌生理盐水中,充分混匀制成菌悬液。吸取0.5 mL菌悬液至装有4.5 mL无菌生理盐水试管中,充分混匀,制成10-2稀释度菌悬液,以此方法制备10-3~10-10稀释度菌悬液,用平板倾注法进行菌落计数。吸取0.5 mL菌悬液至4.5 mL已经灭菌处理的 MRS液体培养基(用盐酸调节pH3.00)试管中,充分混匀,制备10-2稀释度菌悬液,以此方法制备3支10-3稀释度菌悬液,置于37 ℃水浴中;分别在1 h、2 h和4 h时取出,用生理盐水稀释后,平板倾注法进行菌落计数。以用无菌生理盐水稀释的菌悬液活菌数计数结果作为空白对照(0 h)。统计经MRS液体培养基(pH3.00)处理1 h、2 h和4 h后的菌悬液活菌数计数结果,以处理时间作为横坐标,活菌数计数结果作为纵坐标绘制曲线。
1.2.6.2 胆盐耐受性测试方法 称取4 g待测冻干菌粉溶解于36 mL无菌生理盐水中,充分混匀制成菌悬液。吸取0.5 mL菌悬液至装有4.5 mL无菌生理盐水试管中,充分混匀,制成10-2稀释度菌悬液,以此方法制备10-3~10-10稀释度菌悬液,用平板倾注法进行菌落计数。分别称取4 g待测冻干菌粉溶解于36 mL浓度为0.20%和0.30%的猪胆盐试剂瓶中,充分混匀,置于37 ℃水浴中;分别在1 h、2 h和4 h时取出,用生理盐水稀释后,平板倾注法进行菌落计数。以用无菌生理盐水稀释的菌悬液活菌数计数结果作为空白对照(0 h)。统计经不同猪胆盐浓度处理1 h、2 h和4 h后的菌悬液活菌数计数结果,以处理时间作为横坐标,活菌数计数结果作为纵坐标绘制曲线。
1.3 测定方法
1.3.1 OD600 nm值的测定方法 用752 N紫外可见分光光度计测定,用蒸馏水作空白。
1.3.2 pH值的测定方法 按照GB/T 6920规定的方法测定。
1.3.3 活菌数的测定方法 按照GB/T 20191规定的方法测定。
1.3.4 水分的测定方法 按照GB/T 6435规定的方法测定。
1.4 数据处理与分析 数据利用SPSS 21.0统计软件进行方差分析,差异显著时采用Duncan’s法进行多重比较,显著性水平为0.05。
2 结果与分析
2.1 优化培养试验
2.1.1 培养温度的优化 嗜酸乳杆菌La-0231在37 ℃下培养,菌液中的活菌数最高达到(8.62±0.14)×108CFU/mL,显著高于其它培养温度(P<0.05);此时OD600 nm值也最高为(2.91±0.13),pH值为(4.51±0.13)(表1)。

表1 培养温度的优化试验结果Tab 1 Optimized results of culture temperature
2.1.2 培养时间的优化 培养时间为18 h时,菌液中的活菌数最高达到(8.11±0.47)×108CFU/mL,显著高于其它培养时间(P<0.05);此时OD600 nm值也最高为(3.07±0.16),pH值为(4.49±0.31)(表2)。

表2 培养时间的优化试验结果Tab 2 Optimized results of culture time
2.1.3 培养基起始pH的优化 培养基起始pH值为6.20时,菌液中的活菌数最高达到(16.00±0.14)×108CFU/mL,显著高于其它培养基起始pH值(P<0.05);此时OD600 nm值也最高为(3.22±0.18),pH值为(4.35±0.25)(表3)。

表3 培养基起始pH的优化试验结果Tab 3 Optimized results of initial pH of culture medium
2.1.4 培养温度、培养时间和培养基起始pH值的优化组合 L9(34)正交试验结果,实际最佳组合和理论最佳组合一致,均为正交表的试验号5(A2B2C3),结果值为4.42×109CFU/mL(表4)。
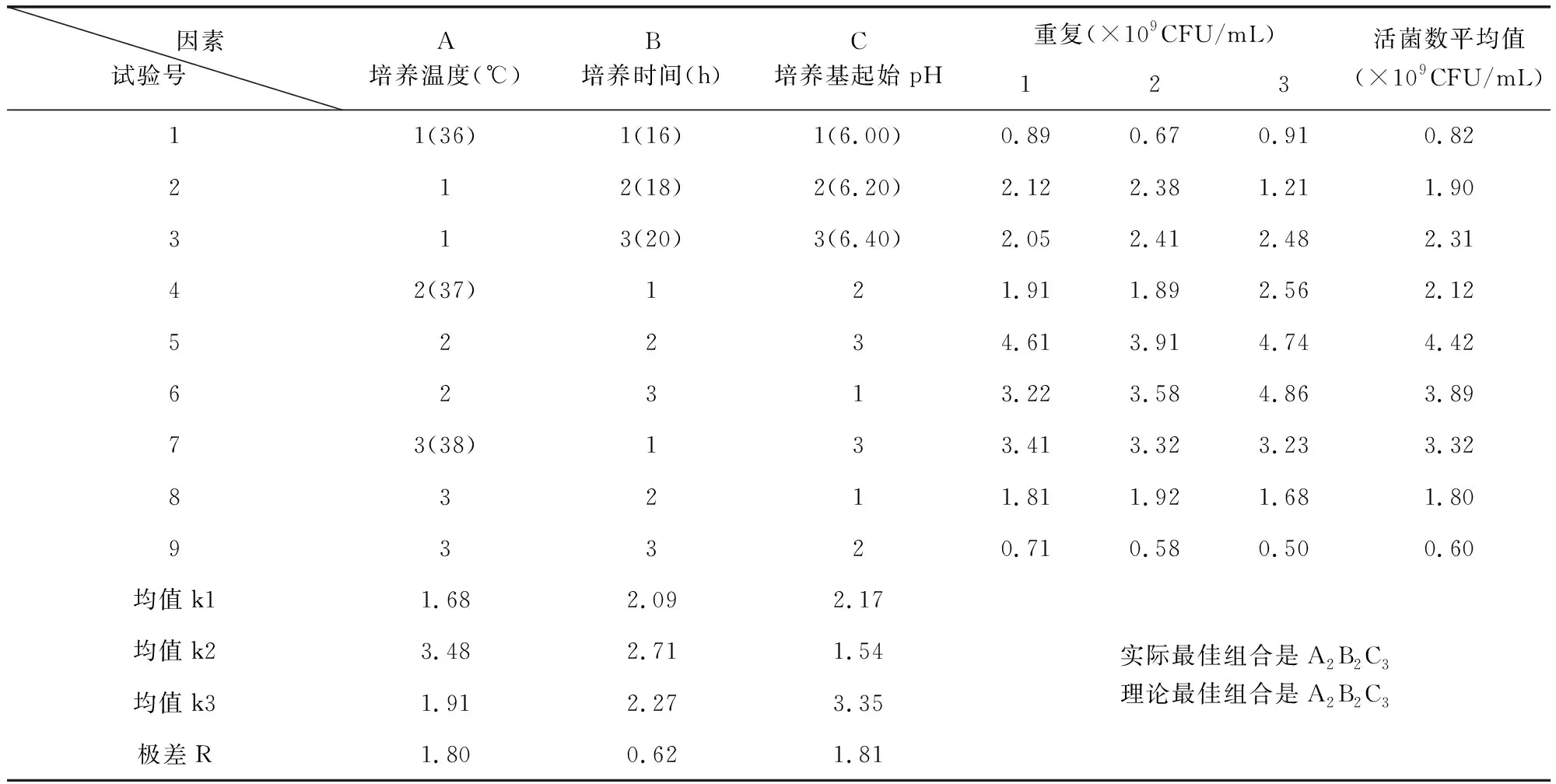
表4 L9(34)正交试验结果Tab 4 Results of L9(34) orthogonal experiment
因此,嗜酸乳杆菌La-0231发酵培养条件为:培养温度37 ℃、培养基初始pH值6.40、培养时间18 h,并为下一步5吨生产罐发酵参数的确定提供了试验依据。
2.2 5吨生产罐发酵参数的确定 嗜酸乳杆菌La-0231在发酵的过程中会不断的产生乳酸,乳酸的不断积累会使pH值持续下降,这对于高密度发酵菌体的积累很不利。因此,5吨生产罐发酵参数中pH控制和发酵终点(发酵时间)判定极为重要。图1为37 ℃、pH自然条件下发酵过程OD600 nm和pH值测定曲线。
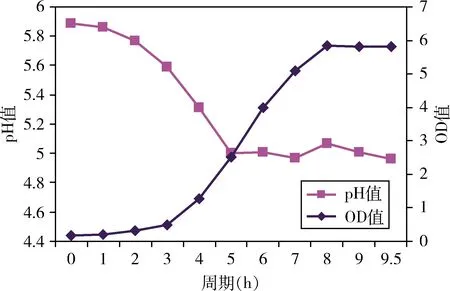
图1 37 ℃、pH自然条件下发酵过程OD600 nm和pH值测定曲线Fig 1 Fermentation process OD600 nm and pH determinationcurve at 37 ℃ and pH under natural conditions
当发酵液的pH值第一次达到4.90时,流加一定量的氢氧化钠溶液,使pH值回升到5.20,停止流加,如此反复两次,菌体在不受低酸度抑制的情况下实现大量累积。发酵温度37 ℃,流加15%浓度氢氧化钠溶液发酵17 h,发酵液的活菌数达到最高为(18.62±1.05)×108CFU/mL,显著高于发酵16 h、18 h(P<0.05);流加25%浓度氢氧化钠溶液发酵16~17 h,发酵液的活菌数达到最高为(63.11±2.23)×108~(68.01±3.08)×108CFU/mL,显著高于发酵15 h、18 h(P<0.05),发酵16 h~17 h之间无显著性差异(P>0.05);流加35%浓度氢氧化钠溶液发酵16 h,发酵液的活菌数达到最高为(20.12±1.13)×108CFU/mL,显著高于发酵15 h、17 h(P<0.05)(表5)。
表5中,流加15%、25%、35%浓度氢氧化钠溶液发酵液活菌数最高值比较,流加25%浓度氢氧化钠溶液发酵液的活菌数为最高,达到(68.01±3.08)×108CFU/mL,显著高于流加15%、35%浓度氢氧化钠溶液(P<0.05)。

表5 流加不同浓度氢氧化钠溶液发酵试验结果Tab 5 Results of fed-batch fermentation with different concentrations of sodium hydroxide
所以,嗜酸乳杆菌La-0231菌株5吨生产罐最佳发酵控制参数为:发酵温度37 ℃,培养基初始pH值为6.40,氢氧化钠的流加浓度为25%,发酵时间为16 h,发酵液最终pH值范围在4.20~4.80之间,OD600 nm值在6.00以上,活菌数为6.80×109CFU/mL。
2.3 离心参数的确定 发酵液在离心过程中,流量的大小决定离心所用的时间和菌泥的收得率,同时离心过程由于离心力的作用,会对菌体有一定的损伤。离心时的流量为216 L/h时,在每升发酵液获得(10.32±0.67) g较高菌泥收率的情况下,菌泥活菌数含量最高为(7.02±0.23)×1011CFU/g,显著高于其它流量指标(P<0.05),计算总活菌数为7.24×1012CFU/g(表6)。
2.4 冻干参数的确定 预冻温度在-45 ℃~-50 ℃的条件下,冻干菌粉的活菌数含量最高达到(3.61±0.13)×1011~(3.97±0.08)×1011CFU/g,显著高于其它预冻温度(P<0.05),预冻温度-45 ℃~-50 ℃之间无显著性差异(P>0.05);此时水分含量为(3.10±0.31)%~(3.22±0.14)%(表7)。

表7 预冻温度对冻干菌粉的活菌数和水分含量的影响Tab 7 Effects of prefreezing temperature on viable bacteria count and moisture content of freeze-dried powder
50 Pa的真空度对冻干菌粉活菌数含量的影响最小,冻干菌粉活菌数含量最高为(4.56±0.14)×1011CFU/g,显著高于其它真空度(P<0.05);冻干菌粉水分含量为(3.19±0.14)%(表8)。

表8 真空度对冻干菌粉的活菌数和水分含量的影响Tab 8 Effects of vacuum degree on viable bacteria count and moisture content of freeze-dried powder
2.5 冻干菌粉耐受性测定
2.5.1 对酸的耐受性测试 嗜酸乳杆菌La-0231在pH3.00的MRS液体培养基中处理0~1 h,活菌数从(2.31±0.06)×1011CFU/g降至(1.91±0.06)×1011CFU/g(P<0.05),存活率为82.68%;处理 0~2 h,活菌数从(2.31±0.06)×1011CFU/g降为(1.82±0.07)×1011CFU/g(P<0.05),存活率为78.79%;处理0 h~4 h,活菌数从(2.31±0.06)×1011CFU/g降为(1.31±0.04)×1011CFU/g(P<0.05),存活率为56.71%(图2)。

图2 活菌数随处理时间的变化趋势Fig 2 The changing trend of viable bacterial count with treatment time
2.5.2 对胆盐耐受性的测试 嗜酸乳杆菌La-0231在0.20%浓度的猪胆盐溶液中处理0 h~1 h,活菌数从(1.23±0.06)×1011CFU/g降至(1.08±0.06)×1010CFU/g(P>0.05),存活率为87.80%;处理0 h~2 h,活菌数从(1.23±0.06)×1011CFU/g降为(1.08±0.06)×1010CFU/g(P>0.05),存活率为87.80%;处理0 h~4 h,活菌数从(1.23±0.06)×1011CFU/g降为(1.01±0.06)×1010CFU/g(P>0.05),存活率为82.11%。在0.30%浓度的猪胆盐溶液中处理0 h~1 h,活菌数从(1.23±0.06)×1011CFU/g降至为(0.74±003)×1010CFU/g(P<0.05),存活率为60.16%;处理0 h~2 h,活菌数从(1.23±0.06)×1011CFU/g降为(0.70±0.04)×1010CFU/g(P<0.05),存活率为56.91%;处理0 h~4 h,活菌数从(1.23±0.06)×1011CFU/g降为(0.70±0.04)×1010CFU/g(P<0.05),存活率为56.91%(图3)。

图3 活菌数随处理时间的变化趋势Fig 3 The changing trend of viable bacterial count with treatment time
3 讨论与结论
陈齐等采用分离自人体肠道的一株嗜酸乳杆菌LA-G80,通过单因素试验优化获得其最佳基础培养基为葡萄糖41.5 g/L、麦芽糖20 g/L、牛肉浸粉18.64 g/L、蛋白胨15 g/L、胰蛋白胨10 g/L、大豆低聚糖10 g/L、乙酸钠5 g/L、柠檬酸三铵2 g/L、K2HPO42 g/L、MgSO4·7H2O 0.25 g/L、MnSO4·4H2O 0.05 g/L、1 mL/L吐温-80;添加豆饼粉7.43 g/L、花生蛋白粉5.43 g/L、天门冬氨酸0.16 g/L、丙氨酸0.16 g/L、丝氨酸0.16 g/L作增殖因子。最佳发酵条件为接种量2%、恒温37 ℃、培养基初始pH6.00、恒定pH5.50厌氧发酵,发酵液最高活菌数4.22×109CFU/mL;相比较MRS发酵培养基活菌数提高约9倍[6]。赵燕霞等采用分离自新疆传统酸马奶中的一株嗜酸乳杆菌IMAU30067,通过单因素试验、正交试验以及响应面法优化得到其最佳基础培养基为葡萄糖30.00 g/L、麦芽糖30.00 g/L、鱼蛋白胨30.00 g/L、海藻糖20.00 g/L、大豆蛋白胨10.00 g/L、乙酸钠5.74 g/L、柠檬酸钠2.29 g/L、K2HPO42.29 g/L、MgSO4·7H2O 0.80 g/L;添加马铃薯提取物6.00 g/L、组氨酸0.10 g/L作增殖因子。最佳发酵条件为接种量1×106CFU/mL、初始pH值6.50,于37 ℃恒pH5.00厌氧发酵,发酵液最高活菌数3.72×109CFU/mL;相比较MRS发酵培养基活菌数提高约8倍[7]。张超凤等采用中国普通微生物菌种保藏管理中心(CGMCC)购买的嗜酸乳杆菌菌种,通过单因素试验、正交试验优化获得其最佳基础培养基为4°Bx碎米水解液、豆粕(豆粕加水煮沸20 min,过滤)20 g/L、葡萄糖15 g/L、乙酸钠5 g/L、MgSO4·7H2O 0.5 g/L、MnSO4·4H2O 0.25 g/L;添加白萝卜汁70 g/L、麦芽汁60 g/L、乳糖9 g/L作增殖因子。最佳发酵条件为接种量5%、恒温37 ℃、培养基初始pH5.50~6.00、通5%CO2厌氧发酵,发酵液最高活菌数6.20×109CFU/mL。相比较其最佳基础培养基活菌数提高约12倍[8]。
研究以猪源嗜酸乳杆菌La-0231为供试菌株。以葡萄糖20 g/L,蛋白胨10 g/L,牛肉浸粉10 g/L,酵母浸膏5 g/L,乙酸钠5 g/L,柠檬酸氢二铵2 g/L,K2HPO42 g/L,CaCl21 g/L,L-半胱氨酸盐酸盐0.5 g/L,MgSO4·7H2O 0.5 g/L,MnSO4·4H2O 0.25 g/L,1 mL/L吐温80为基础培养基(改良MRS培养基);添加豆粕水解物6.00 g/L、复合氨基酸0.25 g/L(异亮氨酸0.05 g/L、半胱氨酸0.05 g/L、天门冬氨酸0.05 g/L、丙氨酸0.05 g/L、赖氨酸0.05 g/L)作增殖因子。与上述陈齐,赵燕霞等采用的基础培养基相比较,原料用量少,成本低;与张超凤等采用的基础培养基和增殖因子相比较,原料处理简单,更符合工业化生产要求。本研究经单因素试验、正交试验优化的5吨生产罐发酵最佳控制参数为接种量2%、发酵温度37 ℃、培养基初始pH值为6.40、流加氢氧化钠浓度为25%控制发酵液pH4.90~5.20、发酵时间为16 h、发酵液最终pH值范围在4.20~4.80之间、OD600 nm值在6.00以上,发酵液最高活菌数6.80×109CFU/mL,相比较采用MRS发酵培养基活菌数提高约10倍;优于上述陈齐、赵燕霞、张超凤等试验所获结果。同时,与上述陈齐、赵燕霞、张超凤等试验所获最佳发酵条件相比较,培养基初始pH值、控制发酵过程发酵液pH范围等参数值有所不同。上述试验结果比较说明,进一步开发不同猪源嗜酸乳杆菌发酵生产工艺,菌株不同,基础培养基、添加增殖因子以及最佳发酵条件也略有不同,本试验结果仅供参考借鉴。但发酵过程37 ℃培养、流加25%浓度氢氧化钠控制发酵液pH应具有普适性。
本研究发酵液离心时的流量设定值以216 L/h为优。确定预冻温度为-45 ℃~-50 ℃最佳,冷冻干燥中物料仓的真空度设定以50 Pa较为适宜。离心、冻干工艺优化后,冻干菌粉活菌数含量为4.56×1011CFU/g,水分含量3.19%。与优化前冻干菌粉活菌数含量相比提高约3~5倍。此结果为进一步开发不同猪源嗜酸乳杆菌离心、冻干工艺,为进一步扩大猪源嗜酸乳杆菌La-0231菌粉产业化规模生产,提供了指导意义。
袁林等采用Plackett-Burman试验设计优化其增殖培养基及其发酵条件,获得发酵液的最高活菌数为4.32×1010CFU/mL[9]。王晓萌等通过单因素和响应面试验,对冷冻干燥前的嗜酸乳杆菌进行休克处理条件优化,再结合复合冻干保护剂,使其冷冻干燥后的存活率提高至96.94%;比未冷休克,添加保护剂冷冻干燥(78.99%)高出17.65%;比未冷休克,未添加保护剂冷冻干燥(21.42%)高出75.22%[10]。参比上述试验研究方法,为进一步提高猪源嗜酸乳杆菌La-0231发酵液活菌数及冻干菌粉活菌含量,采用一些更新的思路、更新的手段优化菌粉生产工艺值得借鉴。
经耐酸、耐胆盐性能测试,显示猪源嗜酸乳杆菌La-0231具有良好的耐酸、耐胆盐特性。

