血清SCGN联合aEEG在新生儿缺氧缺血性脑病早期诊断和近期结局评估的价值
许邦礼 赵青赞 陈蒙蒙 高 超
1.河南省儿童医院(郑州儿童医院)新生儿科,河南 郑州 450018;2.郑州大学基础医学院,河南 郑州 450001
新生儿窒息是引起新生儿死亡、颅内出血及脑瘫等的重要原因,也是导致围生期小儿死亡和伤残的重要原因[1-2]。缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是指围产期窒息导致脑的缺氧缺血性损害,临床出现一系列中枢神经异常的表现。新生儿窒息后导致脑损伤的机制尚未完全明确,早期诊断和及时评估脑损伤及结局具有重要的临床意义[3-4]。振幅整合脑电 图(amplitude-integrated electroencephalography,aEEG)是常规脑电图的一种简化形式,属于无创性检查,具有便捷、安全、技术要求不高等优势,能够直观的反映脑功能状态,在神经系统损伤的早期评估和诊断上有一定的应用价值,已被广泛应用于新生儿脑损伤评估[5]。促泌素(secretagogin,SCGN)是一种新型钙结合蛋白,在神经内分泌组织、神经系统中均有表达,可反映神经元损伤[6]。目前,关于SCGN联合aEEG对HIE早期诊断和结局评估价值的研究很少。因此,本研究通过检测窒息新生儿血清SCGN水平及aEEG评分,探讨二者在HIE中的作用,以期为HIE的临床诊疗及结局评估提供理论依据。
1 资料与方法
1.1 一般资料
选取2018年10月—2021年4月于河南省儿童医院就诊的HIE新生儿106例为HIE组,同期选取106例窒息后未发生脑损伤新生儿作为非HIE组,均为足月儿。其中,HIE组男56例,女50例,平均胎龄为(39.32±1.26)周,平均出生体质量为(2 985.56±553.42)g,经头颅CT检查脑白质低密度分布范围评估分度[7]:轻度36例,中度49例,重度21例;非HIE组男54例,女52例,平均胎龄为(39.51±1.31)周,平均出生体质量为(2 897.72±549.13)g。纳入标准:①所有新生儿均进行影像学检查;②符合新生儿窒息脑损伤相关诊断标准[7];③病历资料完整;④家属对本研究知情同意,并签订协议书。排除标准:①合并非窒息所致脑损伤新生儿;②患有遗传、先天性畸形及其他先天性疾病新生儿;③合并代谢性疾病及其他严重并发症的新生儿。本研究经医院道德伦理委员会批准通过。
1.2 研究方法
1.2.1 样品采集
所有新生儿均于出生后12 h内抽取静脉血3 mL,3 000 r/min离心30 min,获取血清检验样本,冷冻保存待测。
1.2.2 血清SCGN水平检测
采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测两组新生儿血清SCGN水平,严格按照SCGN ELISA试剂盒(上海江莱生物科技有限公司,货号:JL30514-96T)说明书进行实验操作。
1.2.3 改良aEEG评分[8]
所有新生儿均于出生后12 h内进行aEEG检查,结合足月儿脑电图特点,分别对aEEG的连续性、睡眠觉醒周期(sleep wake cycling,SWC)及癫痫样惊厥活动(seizure activity,SA)进行赋值评分,分值范围3~12分,计算改良aEEG评分总分值,分值越低,则表示新生儿脑损伤越严重。
1.3 新生儿神经发育随访
对两组新生儿出生后2个月的神经发育情况进行评估,采用0~6岁儿童神经心理发育表评估[9],统计神经行为异常及神经心理发育低下发生率,并定义为结局不良。另进一步将HIE新生儿分为结局不良及结局良好组。
1.4 统计学分析
运用统计学软件SPSS 20.0对数据进行处理,计数资料以例(n)或[n(%)]表示,采用χ2检验;计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,三组间比较采用单因素方差分析,进一步比较使用SNK-q检验;采用ROC曲线分析血清SCGN水平及aEEG评分对HIE的早期诊断和结局评估的价值。检验水准α=0.05。
2 结 果
2.1 两组新生儿一般资料比较
HIE组与非HIE组胎龄、性别及出生体质量比较,差异均无统计学意义(P>0.05),见表1。
表1 HIE组与非HIE组新生儿一般资料比较[(±s)/n]
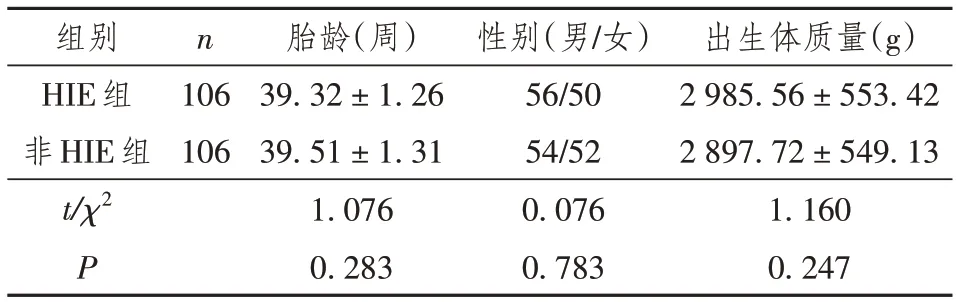
表1 HIE组与非HIE组新生儿一般资料比较[(±s)/n]
组别HIE组非HIE组t/χ2 P n 106 106胎龄(周)39.32±1.26 39.51±1.31 1.076 0.283性别(男/女)56/50 54/52 0.076 0.783出生体质量(g)2 985.56±553.42 2 897.72±549.13 1.160 0.247
2.2 两组新生儿血清SCGN水平、aEEG评分比较
HIE组血清SCGN水平高于非HIE组,aEEG评分低于非HIE组,差异有统计学意义(P<0.05),见表2。
表2 HIE组与非HIE组新生儿血清SCGN水平、aEEG评分比较(±s)

表2 HIE组与非HIE组新生儿血清SCGN水平、aEEG评分比较(±s)
组别HIE组非HIE组t P n 106 106 SCGN(ng/L)4.42±1.01 2.63±0.84 14.029<0.001 aEEG评分8.80±2.17 11.53±3.06 7.493<0.001
2.3 不同程度HIE新生儿血清SCGN水平、aEEG评分比较
重度HIE新生儿血清SCGN水平显著高于中度、轻度新生儿,aEEG评分低于中度、轻度新生儿,差异有统计学意义(P<0.05),见表3。
表3 不同程度HIE新生儿血清SCGN水平、aEEG评分比较(±s)
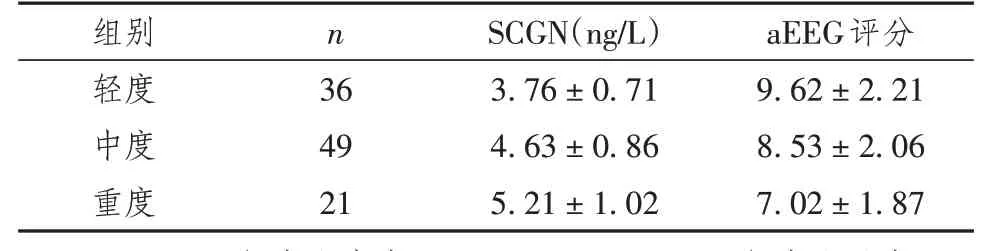
表3 不同程度HIE新生儿血清SCGN水平、aEEG评分比较(±s)
注:SCGN:轻度比中度,q=6.615,P<0.001;轻度比重度,q=8.814,P<0.001;中度比重度,q=3.711,P<0.05。aEEG评分:轻度比中度,q=3.380,P<0.05;轻度比重度,q=6.446,P<0.001;中度比重度,q=3.941,P<0.05
组别轻度中度重度n 36 49 21 SCGN(ng/L)3.76±0.71 4.63±0.86 5.21±1.02 aEEG评分9.62±2.21 8.53±2.06 7.02±1.87
2.4 ROC曲线分析血清SCGN、aEEG评分对窒息新生儿脑损伤的诊断价值
ROC曲线分析结果显示,血清SCGN诊断HIE的曲线下面积为0.938(95%CI:0.905~0.970,P<0.001),截断值为3.832 ng/L,敏感度为80.2%,特异度为95.3%。aEEG评分诊断HIE的曲线下面积为0.810(95%CI:0.753~0.867,P<0.001),截断值为11.655分,敏感度为94.3%,特异度为58.5%。血清SCGN、aEEG评分联合诊断HIE的曲线下面积为0.959(95%CI:0.934~0.984,P<0.001),敏感度为86.8%,特异度为96.2%,见图1。

图1 ROC曲线分析血清SCGN、aEEG评分对HIE的诊断价值
2.5 两组新生儿结局评估比较
HIE组新生儿神经行为异常及神经心理发育低下总发生率高于非HIE组,差异有统计学意义(P<0.05),见表4。

表4 HIE组与非HIE组新生儿结局评估比较[n(%)]
2.6 结局不良组与结局良好组HIE新生儿血清SCGN水平、aEEG评分比较
结局不良组血清SCGN水平显著高于结局良好组,aEEG评分低于结局良好组,差异有统计学意义(P<0.05),见表5。
表5 结局不良组与结局良好组HIE新生儿血清SCGN水平、aEEG评分比较(±s)
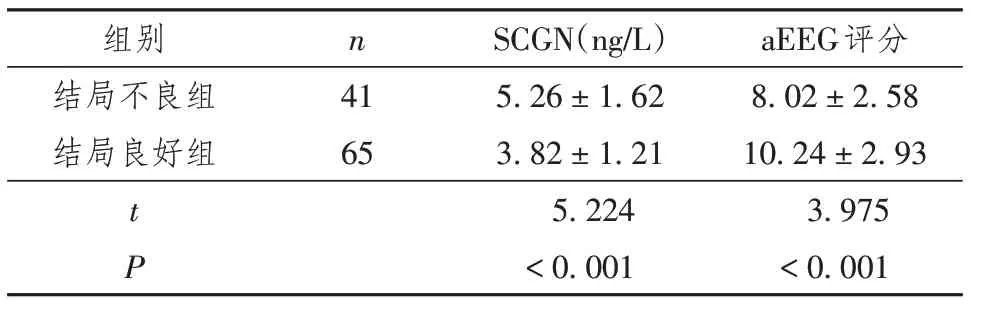
表5 结局不良组与结局良好组HIE新生儿血清SCGN水平、aEEG评分比较(±s)
组别结局不良组结局良好组t P n 41 65 SCGN(ng/L)5.26±1.62 3.82±1.21 5.224<0.001 aEEG评分8.02±2.58 10.24±2.93 3.975<0.001
2.7 ROC曲线分析血清SCGN、aEEG对HIE新生儿不良结局的评估价值
ROC曲线分析结果显示,血清SCGN评估HIE新生儿不良结局的曲线下面积为0.660(95%CI:0.552~0.767,P<0.001),截断值为3.886 ng/L,敏感度为78.0%,特异度为52.3%。aEEG评分评估HIE新生儿不良结局的曲线下面积为0.718(95%CI:0.621~0.815,P<0.001),截断值为9.488分,敏感度为78.0%,特异度为61.5%。血清SCGN联合aEEG评分评估HIE新生儿不良结局的曲线下面积为0.797(95%CI:0.707~0.887,P<0.001),敏感度为65.9%,特异度为86.2%,见图2。

图2 ROC曲线分析血清SCGN、aEEG对HIE新生儿不良结局的评估价值
3 讨 论
新生儿窒息会导致新生儿出现多种器官功能损伤,由于脑细胞对于缺氧非常敏感,新生儿容易发生HIE。我国新生儿脑损伤发生率较高,如果不及时诊断以及治疗,会引起新生儿神经系统功能障碍,给新生儿家长带来极大的心理与经济负担[10]。本研究结果显示,HIE组新生儿神经行为异常及神经心理发育低下总发生率显著高于非HIE组,表明脑损伤严重影响新生儿神经系统发育,易导致新生儿神经系统不良结局的发生。
aEEG是基于常规脑电图发展起来的一种新型脑功能监测技术,对新生儿无害、操作方便、图形直观、容易移动、可床旁化,能够对患儿脑部的整体功能进行观测评估,是评价新生儿脑功能的有效方式,已被广泛应用于临床。aEEG能够迅速有效对患儿的脑功能状态进行分析,一旦患儿出现脑功能异常能够快速得到数据,进而可及时采取相应的措施,降低病情对新生儿的伤害,能够对新生儿的脑损伤进行早期诊断。此外,aEEG与新生儿神经系统近期的发育水平密切相关,能够有效评估神经系统的预后[11-13]。本研究显示,HIE组aEEG评分显著低于非HIE组,结局不良组aEEG评分显著低于结局良好组,表明aEEG与HIE存在密切联系,对HIE新生儿的结局具有一定的监测作用,能够有效评估患儿结局。万珍艳等[13]研究指出,aEEG与脑损伤早产儿有密切关系,在早产儿脑损伤预测中有较高的临床价值。邓松清等[14]研究表明,脑损伤患儿早期顶区aEEG定量值可用于预测患儿的近期结局。ROC曲线分析结果显示,aEEG评分诊断HIE及评估HIE新生儿不良结局的曲线下面积分别为0.810、0.718,截断值分别为11.655分、9.488分,敏感度分别为94.3%、78.0%,特异度分别为58.5%、61.5%,也进一步表明aEEG评分对HIE的早期诊断和结局评估具有一定的价值,提示当aEEG评分低于11.655分,窒息新生儿可能存在发生脑损伤的风险,当aEEG评分低于9.488分时,脑损伤新生儿神经系统发育存在不良结局的风险。
促泌素是一种新型钙结合蛋白,在内分泌器官、弥散性神经内分泌组织、神经系统中均有表达,在缺血性神经元损伤患者的血清中可以检测到SCGN,可能作为一种新型的神经元损伤的临床血清标志物[15]。但目前,SCGN在窒息新生儿脑损伤的诊断及结局评估中的作用研究报道较少。本研究结果显示,HIE组血清SCGN水平显著高于非HIE组,结局不良组血清SCGN水平显著高于结局良好组,由此可推测SCGN与HIE新生儿脑损伤及结局有关,可能参与新生儿神经元损伤过程,但其具体作用机制尚未完全明确,仍待进一步的研究验证。ROC曲线分析结果显示,血清SCGN诊断HIE及评估HIE新生儿不良结局的曲线下面积分别为0.938、0.660(P<0.001);截断值分别为3.832 ng/L、3.886 ng/L,敏感度分别为80.2%、78.0%,特异度分别为95.3%、52.3%,提示血清SCGN对HIE的早期诊断及结局评估均具有一定价值,血清SCGN水平高于3.832 ng/L时窒息新生儿可能有发生脑损伤的风险,高于3.886 ng/L时提示HIE新生儿发生不良结局风险较高。血清SCGN、aEEG评分联合诊断HIE及评估窒息后脑损伤新生儿不良结局的曲线下面积分别为0.959、0.797,敏感度分别为86.8%、65.9%,特异度分别为96.2%、86.2%,表明二者联合检测对HIE的早期诊断及结局评估价值更高,具有重要的临床意义。
综上,HIE新生儿血清SCGN水平明显升高,aEEG评分明显降低,与脑损伤新生儿神经发育异常存在一定关联,对HIE的早期诊断和结局评估均具有一定的价值,且二者联合价值更高。但SCGN、aEEG在HIE新生儿中的具体作用,仍有待进一步的研究。
利益冲突所有作者均声明不存在利益冲突

