肝癌血清标志物预测模型的建立及诊断价值评估
王求知 靳 尧 潘家超 张淑红
1.济南市第三人民医院消化内二科,山东 济南 250101;2.济南市第四人民医院消化内科,山东 济南 250031;3.山东第一医科大学附属中心医院消化二科,山东 济南 250013
原发性肝癌(primary hepatic carcinoma,PHC)在我国及世界范围内都是一种高发病率、高死亡率的恶性肿瘤。世界卫生组织国际癌症研究机构(IARC)发布的2020年最新数据显示,目前该病发病率居全球肿瘤发病率第6位,但死亡率高居第3位,其中,45.3%的新发病例和47.1%的死亡病例是中国人,这与中国巨大的人口基数和数量庞大的慢性乙型肝炎病毒(hepatitis B virus,HBV)感染密不可分。PHC属于具有高度生物学异质性的恶性肿瘤,绝大部分的病理类型是肝细胞癌(hepatocellular carcinoma,HCC),病因多种多样。在我国,慢性HBV感染是主要病因。
HCC发病隐匿,通常晚期才确诊,此时已丧失根治性治疗的时机,只能采取姑息治疗。美国国家癌症中心报告显示,确诊后患者的中位生存期为6~20个月,五年生存率为18%;我国患者则为12.1%。若早期发现,患者生存率将大为改观。数据显示,对于疾病早期、患者肝功能基础良好、单发病灶直径≤5 cm、无肝内转移和血管内侵犯、肝叶切除术阴性切缘>1 cm的患者,其五年生存率可达40%~78%[1-2]。
早期筛查出无症状的肝癌患者意义重大,对需要干预的患者采取积极治疗措施,可以显著改善预后,降低社会负担及其家庭负担。目前临床多数是通过腹部B超结合甲胎蛋白(alpha-fetoprotein,AFP)对人群进行筛查。超声的低价格、无创性、无辐射等优势使得它成为被多家医学会指南广泛推荐的监测方法,但其检出PHC的能效受到多种因素的影响,例如肝脏质地、腹部肥胖,还包括超声设备的质量及超声科医师的阅片经验等,条件受限可能导致较早病灶的漏诊。本研究旨在研究创伤小、成本低、准确度高、方便取材,患者及家属以及医护易于采纳的血液检验指标作为诊断模型,可帮助临床医生早期判断患者的病情进展,提示HCC的发生。
1 资料与方法
1.1 研究对象
选取山东第一医科大学附属中心医院2017—2020年间收治过的慢性HBV感染、乙型肝炎病毒性肝硬化、HBV相关肝细胞癌住院患者进行回顾性分析,其中150例患者入选慢性HBV感染相关非肝癌组,38例患者入HBV感染相关肝癌组。
1.2 纳入与排除标准
纳入标准:非肝癌组病例:(1)乙型肝炎表面抗原阳性或HBV DNA阳性持续半年以上;(2)诊断符合2019版中华医学会慢性乙型肝炎防治指南的临床诊断标准,符合慢性HBV携带状态、慢性乙型病毒性肝炎、乙型肝炎肝硬化。肝癌组病例:(1)乙型肝炎表面抗原阳性或HBV DNA阳性持续半年以上。(2)满足下列3项中的任1项:①具有两种典型影像学(超声、增强CT、MRI或选择性肝动脉造影)表现,病灶>2 cm;②一项典型的影像学表现,病灶>2 cm,AFP>400 ng/mL;③肝脏活检阳性,所有肝癌组的38例患者均经肝穿刺活检术后病理证实为HCC。
排除标准:(1)一般资料不全,相关化验检查等数据不完善的病例;(2)合并其他恶性肿瘤、血液系统疾病、免疫系统疾病的患者;(3)合并其他原因导致的肝脏疾病的患者,如其他病毒性肝炎、药物性肝损伤、酒精性肝损伤、自身免疫性肝病、胆汁淤积性肝病等;(4)肝癌组排除经治疗后的肝癌患者,包括手术切除、消融、TACE、放疗、化疗、免疫治疗等。
1.3 研究方法
1.3.1 一般资料 包括年龄、性别、HBV感染病程、Child-Pugh评分、有无合并腹水、有无食管胃底静脉曲张(esophagogastric varices,EGV)等。
1.3.2 常规、生化及病毒学指标检验方法 搜集所有研究对象入院24 h内的血常规、生化、凝血、病毒学、肿瘤标志物等检查结果。
1.4 统计学方法
应用SPSS 25.0软件和Stata SE 15.0软件进行统计学分析,进行单因素和多因素分析,得出具有统计学意义的独立危险因素,建立诊断模型并绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算其灵敏度、特异度,比较各模型曲线下面积(area under curve,AUC)的差异是否有统计学意义。
连续数值型变量经正态性检验,符合正态分布的变量采用均数±标准差表示,两组间比较采用独立样本t检验;非正态分布的变量采用中位数与四分位数表示,组间比较采用Mann-WhitneyU检验。分类变量采用n(%)表示,组间比较采用Pearson卡方检验和Fisher确切概率法检验。检验水准α=0.05。
2 结 果
2.1 影响HBV肝癌发生的单因素分析
研究对象一般资料及各项血液指标中,年龄、病程、性别、Child-Pugh分级、有无腹水、有无EGV、ALT、白蛋白、胆红素、肌酐、门冬氨酸氨基转移酶-血小板比值指 数(aspartate aminotransferase to platelet ratio index,APRI)、血小板分布宽度(platelet distribution width,PDW)、红细胞分布宽度(red blood cell volume distribution width,RDW-CV)、凝血酶原活动度(prothrombin time activity,PTA)、HBsAg、HBeAg,差异均无统计学意义(P>0.05)。α1-酸性糖蛋白 (α1-acid glycoprotein,orosomucoid,AGP)、超氧化物歧化酶(superoxide dismutase,SOD)、谷 氨 酸 脱 氢 酶(glutamate dehydrogenase,GLDH)、血清唾液酸(serum sialic acid,SA)、血清淀粉样蛋白A(serum amyloid A,SAA)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、门冬氨酸氨基转移酶-丙氨酸氨基转移酶比值(aspartate aminotransferase to alanine aminotransferase ratio,AAR)、谷氨酰转肽酶(glutamyl transferase,GGT)、中性粒细胞-淋巴细胞比 值(neutrophil to lymphocyte ratio,NLR)、血小板淋巴细胞比值(platelet to lymphocyte ratio,PLR)、AFP、HBV DNA等指标在肝癌组和非肝癌组中差异具有统计学意义(P<0.05);HBsAg在两组间的差异无统计学意义(P>0.05)。为不遗漏有意义的变量,纳入标准放宽至P<0.1。AGP、SOD、GLDH、SA、SAA、AST、AAR、GGT、NLR、PLR、AFP、HBsAg、HBV DNA共13个变量可能是HBV相关肝癌的独立影响因素,见表1。

表1 影响HBV肝癌发生的单因素分析
2.2 3个二元logistic回归模型与AFP分级单项回归模型对比
计算Pearson相关系数,通过排列组合依次纳入多因素回归,排除共线性较高的指标,最终得到3个多因素回归模型,见表2。
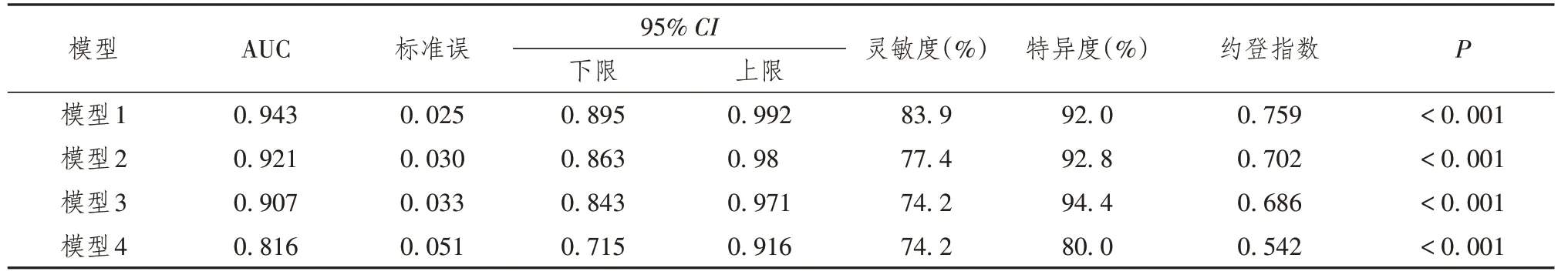
表2 3个二元logistic回归模型与AFP分级单项回归模型对比
2.3 各个模型的AUC、灵敏度、特异度比较
将AFP作为模型4列入表中,计算并比较各个模型的AUC、灵敏度、特异度。结果显示,AUC最高者是回归模型1,为0.943,其次是回归模型2,AUC=0.921,再次是模型3,AUC=0.907,AFP单项的AUC=0.816。模型1灵敏度最高,为83.9%,特异性模型3最高为94.4%。AFP作为模型4与研究建立的模型1、2、3对比后发现,模型1、2、3的AUC、灵敏度和特异度均高于AFP的单因素模型。
绘制上述4个模型的ROC曲线,如图1,可见曲线2、3略有交叉,曲线1的面积最大、曲线4的面积最小,与各曲线没有交叉。

图1 模型1、2、3、4 ROC曲线
Stata SE 15.0计算结果显示,研究建立的模型1、2、3的AUC均显著高于AFP单项的AUC,P<0.025(单侧);而模型1、2、3之间两两比较AUC的差异无统计学意义(P>0.05)。
2.4 影响HBV肝癌发生的多因素logistic回归分析
最优预测模型纳入SA、AST、GGT、AFP、HBsAg共5项变量(表3),研究显示该诊断模型的AUC最大,为0.943,且与其他曲线无交叉,认为在预测和诊断HBV相关疾病进展为HCC时,该模型具有较好的筛检能力。模型计算公式为:

表3 影响HBV肝癌发生的多因素logistic回归分析(最终模型)

若AFP∈(10~100)ng/L,Bi=4.230;AFP∈(100~400)ng/L,Bi=3.187;AFP>400 ng/L,Bi=4.813。若HBsAg∈(0.03~100)ng/L,Bj=-2.509;HBsAg∈(100~1 000)ng/L,Bj=-3.526;HBsAg>1 000 ng/L,Bj=-3.041。若P<0.05,认为该患者未患有HCC,若P>0.05,认为该患者患有HCC。计算可得模型1诊断HCC的阳性预测值为87.5%,阴性预测值为92.4%。
3 讨 论
最终模型纳入了SA、AST、GGT、AFP、HBsAg 5项变量,其中AFP是临床被应用于筛查、诊断和评估HCC最广泛的辅助检查指标。研究证明,高水平的AFP是患者预后的独立危险因素[3]。本研究单因素和多因素研究也得出了一致的结论。但仍有许多患者AFP升高不明显,甚至在整个疾病过程中不升高,这与患者的肿瘤病理类型、病灶大小、TNM分期等因素相关。特别在早期HCC的诊断中,AFP灵敏度和特异性远远低于中晚期HCC,仅有约10%~20%早期HCC表现出AFP升高[4]。欧洲肝脏研究协会(European association for the study of the liver,EASL)发布的临床实践指南中指出,AFP作为被最广泛应用的血清学指标得到的诸多认可是基于应用在诊断HCC中的,而这一指标在监测模式中的表现并不理想[5]。Singal等[6]的Meta分析和Biselli等[7]的观察试验都报告了在AFP与超声结合监测的患者中,对于超声无法识别的肿瘤,AFP检测仅仅提高了6%~8%发现率。
随着上述研究的报告和医学影像技术的发展,AFP检测对诊断HCC的作用逐渐减弱,EASL、美国肝病研究协会(American association for the study of liver disease,AASLD)发布的筛查指南已不再常规推荐[5,8]。而在国内,AFP检测仍然被广泛应用于筛查和诊断HCC,并且仍具有较好的检出率。原因包括以下两点,一是致病因素不同,导致中国HCC的致病因素中HBV感染仍然是占主导,而欧美国家中,HCV感染、酒精性肝硬化、非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)等因素占比更多,肝癌分子分型加临床报告的证据证实,增殖型HCC侵袭性强,易产生高水平的AFP,HBV感染率高;非增殖型HCC预后相对较好,病因多是HCV和酒精性肝病[9]。另一个重要原因则是各国诊疗模式和公民关注健康意识的不同,导致我国患者一旦检出,多数是出现症状体征的晚期HCC,而AFP在中晚期HCC中有更大概率升高。本研究将AFP水平由低到高分为4组,从OR值可以看出,AFP水平的升高仍然提示HBV感染者患HCC的概率显著增加,在研究纳入的HBV相关的初治HCC患者中,AFP检测依然具有较好的诊断价值。
SA是一系列神经氨酸的乙酰化衍生物,由蛋白质结合SA、脂质结合SA和游离SA共同构成。本研究中单因素和多因素研究证实,SA与慢性乙肝发生HCC显著相关,并且是独立危险因素,在建立的3个诊断模型中都是不可缺少的组成部分。在肿瘤起源方面,肿瘤细胞表面的唾液酸化是其逃脱机体免疫清除的重要机制,过表达的α-2,6唾液酸转移酶(ST6GAL)使得Fas受体唾液酸化,阻止了配体介导的凋亡通路,导致肿瘤逃避了正常的凋亡信号[10]。在肿瘤侵袭机体过程中,高唾液酸化也可以解释癌症的迁移,Pearce[11]和Vajaria等[12]证实了唾液酸化与癌细胞对血管内皮细胞的侵袭相关,使细胞外基质结合改变,病情进展加速,多种癌症(包括肝癌、肺癌、卵巢癌、宫颈癌、乳腺癌、结肠癌等)均表现出这一特征。在癌症的治疗过程中,人们还发现异常的唾液酸化可以使肿瘤细胞耐药,敲除过表达的ST6GAL基因后耐药性消失[13]。综合前人的研究进展可以发现,SA在肿瘤的发生、发展过程中都发挥了非常重要的作用。
HBsAg在病毒感染机体过程中扮演多种重要角色,在HBV组装时与核心结合,调节病毒cccDNA转录;作为亚病毒颗粒结合细胞受体,减弱机体的免疫抵抗,启动感染;阻断信号传导通路,使HBV逃脱机体的免疫清除等。在HCC的发生过程中,HBsAg与宿主细胞内质网结合,激活细胞内多种信号通路,引发细胞炎症、损伤再生,加速肝细胞增殖,刺激肝星状细胞增生,并诱导病毒DNA的转录,使得肝细胞突变概率增加,更易恶变。台湾一项观察性研究发现,低病毒载量HBV感染者患HCC的风险受到HBsAg水平的显著影响[14]。2019年的一项Meta分析汇总了多家数据库的10项研究共12 000余例病例的结果显示,在不同临界值分组的HBsAg中,高水平组均提示肝癌的发病风险增加[15]。本研究中相对于非肝癌组患者,肝癌组患者HBsAg回归系数为负值,显示为负相关因素,与其他研究不符。可能有以下3个原因,第一,对照组为HBV慢性感染的非肝癌患者,而不是健康人群。相较于健康人群肝癌组HBsAg的数据必然属于强危险因素。第二,入选的肝癌组相比对照组的慢性肝病者有更多比例患者合并肝硬化,而多项研究显示HBeAg阳性患者中HBsAg与肝纤维化的程度呈负相关[16];原因是慢性感染后期,免疫耐受消失,进入免疫清除阶段,HBsAg水平逐渐降低。第三,与HBV基因型的变异有关,肝癌组变异的HBsAg可能未被试剂检测。
AST最初被认为是肝细胞损伤标志性指标,但后来的研究者们发现其血液水平的高低与肝细胞的损伤相关性并不强,逐渐作为代表肝脏代谢功能的指标。少有人验证其在HCC诊断中的价值,可能是由于AST存在多种组织中,并不具有特异性。本研究发现,经过单因素及多因素的分析,AST在HBV感染非肝癌组和肝癌组的差异有统计学意义。Bayomi等[17]研究发现,AST对诊断HCC有间接相关性。最近在上海交通大学的一项研究中,同样选取的是HBV感染的肝炎、肝硬化和HCC患者,得出的结论与本文结果也较为接近[18]。虽然单纯AST检测诊断HCC灵敏度、特异性均不佳,但在与AFP等血清学标志物联合检测诊断HBV-HCC中具有比单纯AFP检测更好的诊断意义。本研究多因素logistic回归也证实,AST可以影响HBV-HCC的发生,在诊断HCC中确有一定的价值。
GGT包括有多种同工酶,由肝脏Kupffer细胞和胆管内皮细胞分泌,参与谷胱甘肽的合成与分解,从而维持细胞正常的氧化应激状态。早在上个世纪就有学者发现,GGT在肝癌前病变和不同病理类型的PHC中均有高水平的表达。有学者认为,GGT参与了细胞癌变中的脂质过氧化过程,并在大鼠活细胞中得到了验证[19]。随后的深入挖掘证实,GGT介导的谷胱甘肽的代谢是肿瘤生长和抵御损伤的重要机制,即癌细胞中高水平的GGT可以使其对化学、辐射等的抵抗力增强,造成了肿瘤的抗药性、耐药性[20]。HCC的相关研究中发现,GGT对于患者生存率等方面是一项独立危险因素,高浓度的GGT往往提示肿瘤更具侵袭性以及预后更差[21]。GGT并不是一种肝脏特异性的酶类,所有细胞膜上几乎都具有GGT,高表达的GGT也不止存在于肝癌,还存在于结肠癌、卵巢癌、血液系统肿瘤等。研究发现,GGT对HCC具有一定的诊断作用[22-23]。Cui等[24]发现,GGT的同工酶GGTⅡ对于诊断HCC有较好的灵敏度和特异性。在与其他血清学指标联合检测诊断HCC的ROC曲线及回归模型中,GGT往往是一项不能忽视的独立危险因素[25]。
本研究中建立的模型1、2、3所绘制的AUC显著大于AFP单项,但前3者的AUC虽略有不同,但经检验差异并无统计学意义。查阅相关文献后发现模型1相比模型2、3有异议的指标AST、GGT、HBsAg均具有辅助诊断作用,整体评价较好,预测准确度最高,灵敏度、特异性显著优于单因素指标,且不需患者进行额外的花费,纳入的变量均为血清学指标,相比影像学检查具有客观性好、可量化并长期追踪的优势,通过公式计算可以方便的应用于临床,虽不能做到绝对精准,但对于最终诊断结果阳性或处于临界值的患者可以提示临床医生进行有针对性的进一步检查。
本研究还存在不足之处需要改进,例如,虽选择的是初治HCC患者,但没有对HCC进行亚组分析,下一步研究应进一步对所收集的病例进行TNM或BCLC分期,对比模型对于较早期HCC与晚期HCC病例的诊断效能,并收集更多的病例扩大样本量进行多中心研究。
利益冲突所有作者均声明不存在利益冲突

