基于分子对接法预测红藤Sargentol及类似物紫丁香苷抗炎靶点的研究
耿春叶,曹裕旻,王 培,王雪茹,刘 东,汤 建*
(1.安徽中医药大学 药学院,安徽 合肥 230013;2.亳州学院 中药学院,安徽 亳州 236800)
红藤(Sargentodoxa cuneata)是中医临床常用的一味中药材,具有清热解毒、活血、祛风止痛等功效[1]。红藤提取物具有抗菌、抗病毒、抗氧化等作用,特别是对炎症疾病具有很好的治疗效果,其化学成分主要有酚酸类、苯丙素、木脂素等[2-4]。本课题组在前期研究中,从野生红藤的地上部分中分离得到苯丙醇苷类化合物Sargentol,该化合物对二甲苯致小鼠耳肿胀具有良好的抑制作用[5]。进一步在单核巨噬细胞(RAW264.7)模型中发现,3 μmol/L 的Sargentol 和结构类似物紫丁香苷(Syringin)均能有效抑制脂多糖(LPS)诱导的一氧化氮(NO)释放,抑制率达40.5%和37.8%[6],且后者(11 mg/kg)对大鼠足肿胀以及足中前列腺素E2(PGE2)、NO 均有显著抑制作用(P<0.05)[7]。Sargentol 及紫丁香苷均表现出较好的抗炎应用前景,但目前尚未对二者的抗炎相关机制及作用靶点进行深入研究。
分子对接(Molecular docking)是利用计算机软件模拟小分子配体与大分子受体之间活性位点的最佳结合模式的技术,在药物筛选和靶点确定等方面有着广泛的应用。分子对接中发现化合物肉桂硫胺(Cinanserin)对SARS病毒主要蛋白酶(Mpro)结合能极强,体外实验验证发现,该化合物确实可以强烈抑制病毒复制[8]。近年来,分子对接在中药活性成分筛选、解析其作用机制方面的研究逐渐增多[9-10]。本研究拟利用AutoDockVina 软件[11]进行分子对接,根据对接能量高低,预测Sargentol和紫丁香苷潜在的作用靶点,为深入研究其作用机制提供一定的依据。
1 材料和方法
1.1 材料
本研究采用ChemOffice Professional 软件(美国PerkinElmer公司),AutoDock Tools 1.5.6和AutoDock Vina(美国The Scripps Research Institute),PyMOL(TM)1.7.4.5 Edu(美国Schrodinger,LLC 公司)和Discovery Studio 2016 client(美国BIOVIA 公司)等软件。
1.2 Sargentol和紫丁香苷结构的处理
绘制Sargentol和紫丁香苷的结构,参照文献[10],MM2 能量最小化后经AutoDock Tools1.5.6 进一步处理,扭度(Torsion)设为默认值,最终保存为pdbqt 文件,以备AutoDockVina进行分子对接。
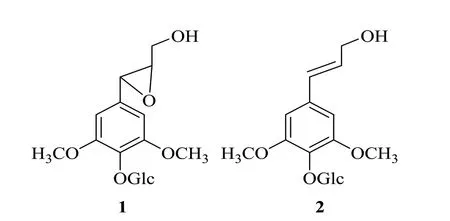
图1 Sargentol(1)和紫丁香苷(2)的化学结构Fig.1 Chemical structures of sargentol(1)and syringin(2)
1.3 靶标蛋白结构的获取和预处理
检 索 中 药 抗 炎 相 关 文 献[9,12-14]和 蛋 白 数 据 库(PDB,http://www.rcsb.org),选取26个与炎症密切相关的靶点蛋白(表1)。将26 个靶点蛋白pdb 文件依次导入PyMOL软件中,删除原配体、水分子、有机物、无机物等,在AutoDock Tools1.5.6 软件中加氢,保存为pdbqt格式,以备AutoDockVina进行分子对接。
1.4 参数设置和分子对接
通常认为均方根偏差(RMSD)在2 Å 范围内。分子对接的晶格中心设置见(表2),对接空间(Grid Box):40nm×40nm×40nm,能量范围为4,利用Vina软件进行半柔性对接,得到Sargentol及紫丁香苷(配体)与26个靶点蛋白(受体)对接后的结合能打分值(kcal/mol)。蛋白晶体复合物中的原配体对接值为阈值。一般认为与药物有较高结合能,且超过或接近阈值的蛋白,可初步确定为潜在的作用靶点。
2 结果与分析
2.1 分子对接的结果
Sargentol、紫丁香苷以及原配体分别与26 个靶点蛋白进行对接,具体结果见表2。Sargentol分别与4NF5、6EQ9、2Y37、5D3I 和2R59 等蛋白结合力较强,紫丁香苷分别与6EQ9、2Y37、2R59、3KGC 和3ELJ 等蛋白有结合较强的结合力,这些蛋白可能与Sargentol 和紫丁香苷抗炎作用具有密切关系。Sargentol及紫丁香苷均与c-Jun氨基末端激酶-3(JNK-3,PDB ID:6EQ9)表现出较强的结合能,分别为-7.9和-8.3 kcal/mol,提示JNK-3可能是Sargentol和紫丁香苷抗炎的重要靶点。二者对诱导性一氧化氮合酶(iNOS,PDB ID:2Y37)亦有较强的结合能,分别为-7.7 和-7.6 kcal/mol。Sargentol 对N-甲基-D-天冬氨酸受体-2A(NR2A,PDB ID:4NF5)具有-8.2 kcal/mol的结合能,远超其阈值-6.0 kcal/mol,提示该化合物还可能通过调节NR2A 等谷氨酸受体发挥抗炎作用。
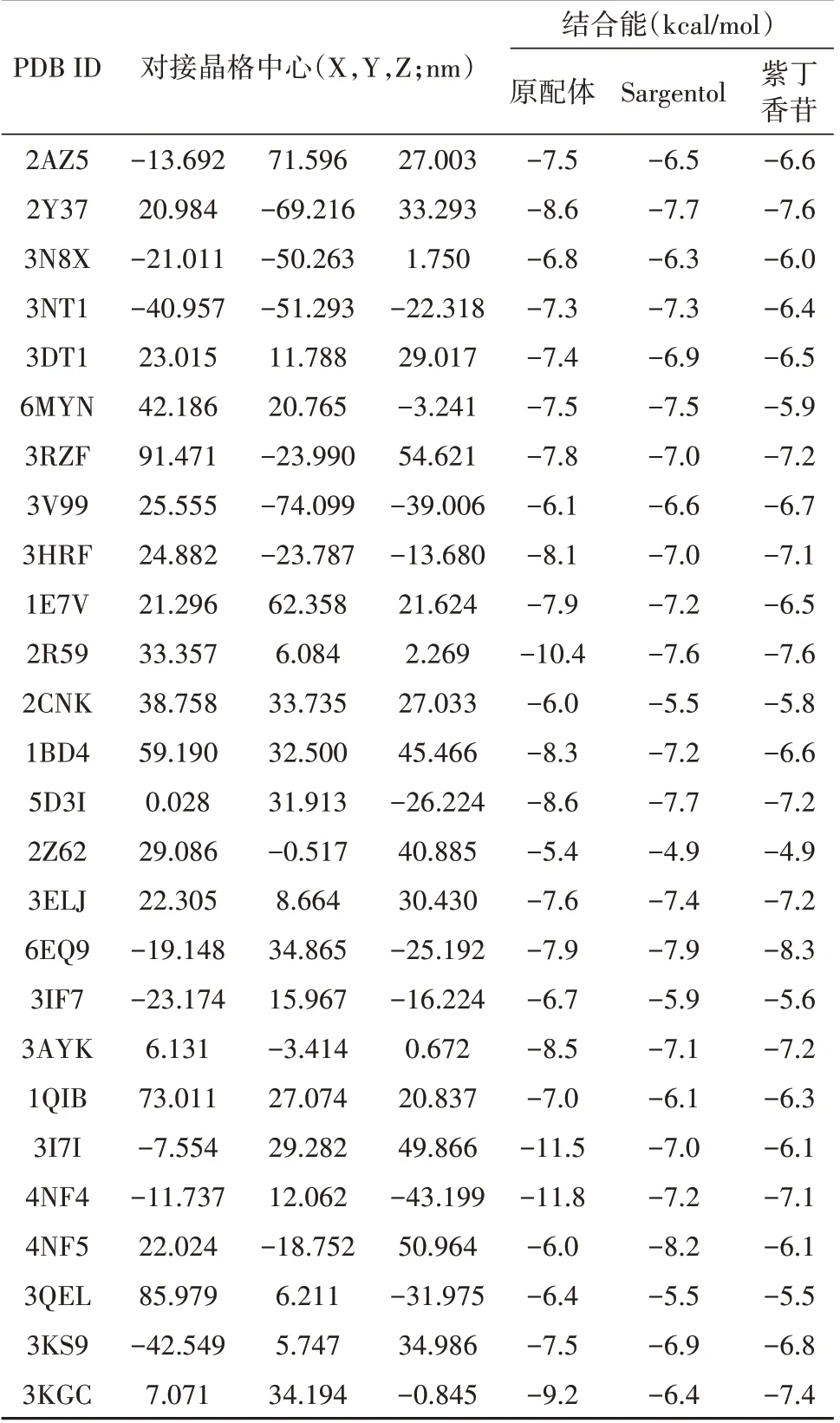
表2 Sargentol及紫丁香苷与受体蛋白的结合能Tab.2 Affinity of sargentol and syringin docking with receptors
在26 个靶点蛋白中,Sargentol 表现出更强结合能力的有14 个,紫丁香苷表现出更强结合力的有9个,二者相同的有3 个,这表明二者结构中的差异(前者为含氧三元环,后者为碳碳双键)对结合能力有明显的影响。
Sargentol 对4NF5(NR2A)具有较强的结合能,且超过其阈值,分子对接平面图(图2)中可见其与4NF5蛋白中的SER114等氨基酸残基之间存在范德华力;苯丙素片段5-OCH3的氧与ARG121 之间、三元环上的氧与THR116之间、9-OH的氧与GLU16之间分别形成氢键,3-OCH3的氧及糖的4'-OH的氧与LYS87 之间、2'-OH 的氧及3'-OH 的氧与GLY89 之间、3'-OH 的氢与ASN97 之间分别形成氢键;苯环与HIS88 之间存在Pi-Pi 作用;4'-OH 的氧与GLY86之间、半缩醛的氧与LYS90 之间存在一种弱的氢键。
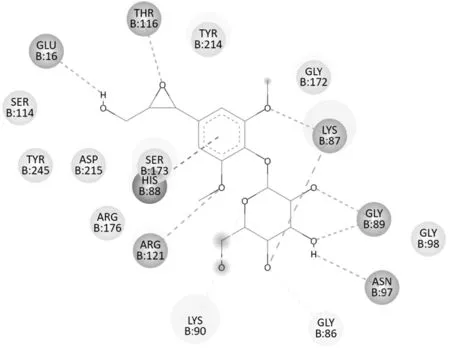
图2 Sargentol与4NF5蛋白分子对接平面图Fig.2 2D diagram of sargentol docking with protein 4NF5
Sargentol 对6EQ9(JNK-3)表现出较强的结合能,与阈值(-7.9 kcal/mol)相同,分子对接平面图(图3)中可见其与6EQ9蛋白中的ILE124等氨基酸基之间存在范德华力;苯丙素片段3-OCH3的氧与LYS93之间、9-OH 的氧与MET149 之间、糖的2'-OH 的氢与ASP207 之间、3'-OH 的氢与SER193 之间分别形成氢键;苯环与LEU206、VAL78 之间存在Pi-sigma作用,与MET146 之间存在Pi-sulfar 作用,与LYS93之间 存在Pi-alkyl 作用;3-OCH3的 碳与LEU206、GLU111 之 间、9 位 碳 与MET149 之 间、5'位 碳 与SER193之间存在一种弱的氢键;另外2'-OH的氢与GLY75 之间存在斥力。氢键及苯环的疏水性结合对Sargentol与6EQ9的结合具有关键作用。
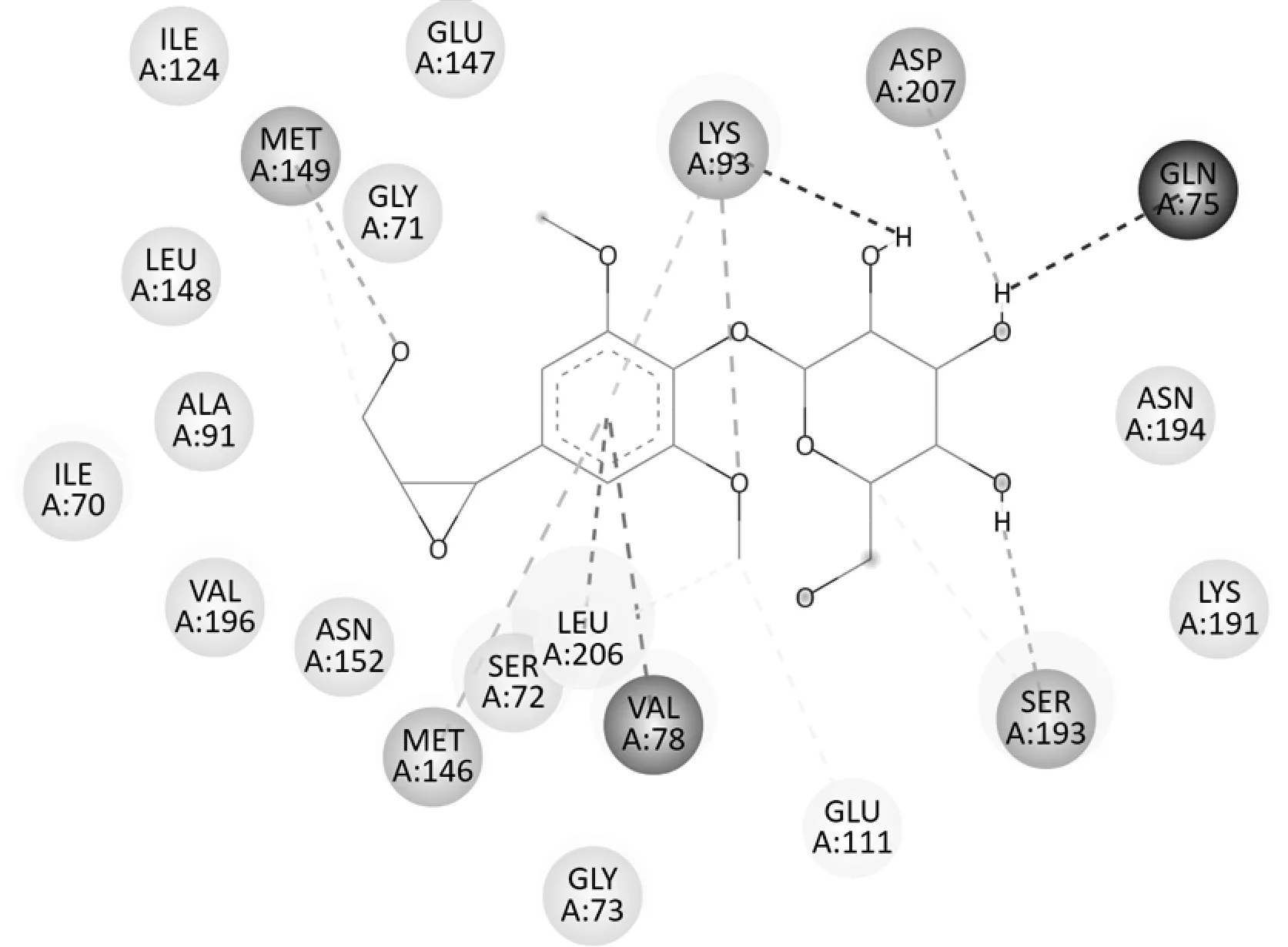
图3 Sargentol与6EQ9蛋白分子对接平面图Fig.3 2D diagram of sargentol docking with protein 6EQ9
紫丁香苷对6EQ9 具有较强的结合能,超过其阈值,分子对接平面图(图4)中可见其与6EQ9 蛋白中的ILE70 等氨基酸基之间存在范德华力;苯丙素片段9-OH 的氧与MET149 之间、3-OCH3的氧及糖的3'-OH 的氧与LYS93 之间、2'-OH 的氢与SER193之间、6'-OH 与GLY76 之间分别形成氢键;苯环与LEU206、VAL78 之间存在Pi-sigma 作用,与MET146之间存在Pi-sulfar 作用;8 位碳与GLU147 之间存在一种弱的氢键;另外6'-OH 的氢与GLY73 之间存在斥力。氢键及苯环的疏水性结合对紫丁香苷与6EQ9的结合具有关键作用。
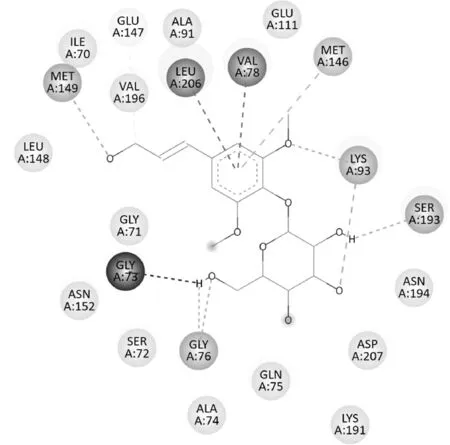
图4 紫丁香苷与6EQ9蛋白分子对接平面图Fig.4 2D diagram of syringin docking with protein 6EQ9
Sargentol 与2Y37(iNOS)的结合能力较强,分子对接平面图(图5)中可见与2Y37 蛋白中的ILE238等氨基酸残基之间存在范德华力;三元环上的氧与ASN364 之间、糖的2'-OH 的氢与TRP366 之间、3'-OH 的氧与MET368 之间分别形成氢键;苯环与TRP188形成Pi-Pi相互作用,与CYS194间还存在一种弱的氢键。
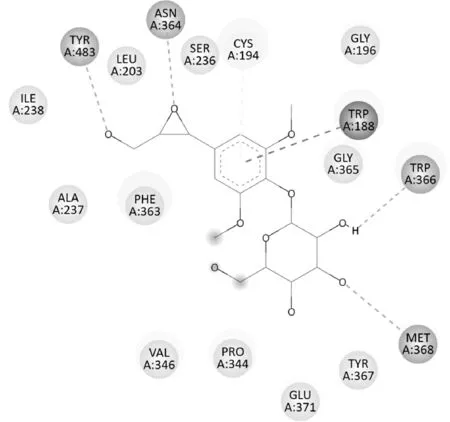
图5 Sargentol与2Y37蛋白分子对接平面图Fig.5 2D diagram of sargentol docking with protein 2Y37
紫丁香苷与2Y37 的结合能力也较强,与2Y37中ILE238等氨基酸残基之间存在范德华力;苯环与ASN364、CYS194 之间分别存在Amide-Pi 和Pi-sulfur 作用;5-OCH3的氧 与GLY196 形成一 种弱的 氢键(图6)。
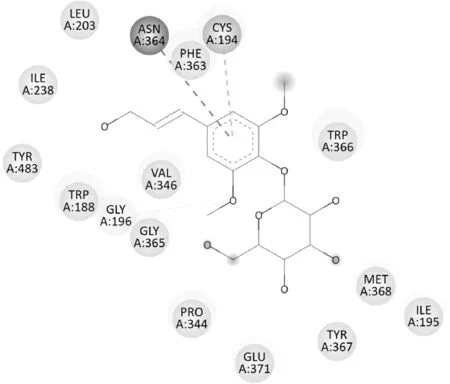
图6 紫丁香苷与2Y37蛋白分子对接平面图Fig.6 2D diagram of syringin docking with protein 2Y37
3 讨论
本次对接结果显示Sargentol 和紫丁香苷均对iNOS 有较强的结合能,这与二者前期的药理实验结果一致。Sargentol 和紫丁香苷对LPS 诱导的RAW264.7 细胞中NO 的释放具有明显的抑制作用,后者还能显著抑制角叉菜致大鼠组肿胀模型中PGE2和NO释放[6-7]。JNK-3是促分裂原活化蛋白激酶(MAPK)家族成员之一,在机体的炎性反应过程中起到重要作用,抑制JNK-3 是药物抗炎的重要机制[15],Sargentol 和紫丁香苷对JNK-3 均有较强的结合能力,这说明JNK-3 可能是抗炎的关键靶点,这一点尚未有相关的药理实验报道。
N-甲基-D-天冬氨酸受体(NMDA)的过度兴奋会导致Ca2+超载和一氧化氮合酶(NOS)活性增加、NO 释放增加,从而引起神经损伤,而抑制NMDA 可以有效降低神经炎症水平[16-17]。Sargentol 与NR2A(PDB ID:4NF5)表现较高的结合能(-8.2 kcal/mol),这意味着Sargentol还可能具有基于NMDA的神经保护潜力。但该化合物与NR1(PDB ID:4NF4)、NR2B(PDB ID:3QEL)、mGluR1(PDB ID:3KS9)、AMPM(PDB ID:3KGC)之间的结合能较弱,分别为-7.2、-5.5、-6.9、-6.4 kcal/mol。
后续的研究中将会采用细胞和动物模型进行Sargentol与紫丁香苷基于JNK-3等靶点蛋白的抗炎活性和相关的机制,将采用双向电泳(2D-PAGE)技术等方法进一步确证Sargentol与紫丁香苷炎症的靶点蛋白[18],同时验证分子对接技术在靶点确定过程中的可行性。

