光周期对赤点石斑鱼血管囊TSHβ和TSHR基因表达的影响
徐文刚,刘立明,王九龙,张建柏,真鍋颯一郎,唐永政
(1.烟台大学海洋学院,山东 烟台 264005;2.烟台市海洋经济研究院,山东 烟台 264003;3.长崎大学环中国东海环境资源研究所,日本 长崎 851-2213)
赤点石斑鱼(Epinephelusakaara)隶属于辐鳍鱼纲(Actinopterygii)、鲈形目(Perciformes)、鲈亚目(Percoidei)、鮨科(Serranidae)、石斑鱼属(Epinephelus),广泛分布于我国东海、南海以及日本和韩国等[1]。国内有关其研究主要集中在生长、发育、成熟、产卵和孵化[2-4]等。自然环境下,赤点石斑鱼需要4~6年性腺才能发育成熟[5],采用人工调控水温和光照时间有利于促进其提前成熟和产卵,缩短养殖周期,减少越冬消耗,降低养殖成本[6-7]。
调控鱼类性腺发育的内分泌系统依赖于光刺激,因此光周期成为影响鱼类性腺发育重要的环境因子[8]。在鸟类和哺乳类中已有光周期和性成熟的相关研究报道,其大致传递途径为脑内的光接受部位感受到光刺激后诱导腺垂体合成促甲状腺激素(TSH),TSH包含一个β亚基单元和一个糖蛋白α亚基单元。TSHβ与甲状腺合成的促甲状腺激素受体(TSHR)相结合,诱导下丘脑合成Ⅱ型脱碘酶(DIO2)。DIO2能使下丘脑中非活性型TSHβ中的T4脱去1个碘,使其转变为具有活性的三碘甲状腺素(T3)。T3作用于下丘脑合成的促性腺激素释放激素(GnRH)的神经末端[9]。一般情况下,哺乳类和鸟类下丘脑中的GnRH神经末端被神经干细胞包裹而抑制了GnRH的合成和释放,但T3能够作用于神经干细胞,改变其结构并向毛细血管释放GnRH而调节其性成熟[9]。由于鱼类脑部没有脑垂体隆起结构,所以有关光刺激和性成熟的研究报道较少。
目前,以鱼类视网膜和松果体作为已知光感应器官的报道较多[10]。在短光照繁殖的鱼类如香鱼(Plecoglossusaltivelis)中,摘除光接收部位如眼球和松果体后,其性成熟受到抑制[11]。虹鳟(Oncorhynchusmasou)无论是否摘除松果体,在明暗条件下都不会丧失摄食行动[12],表明在鱼类中可能存在除松果体和视网膜以外的光接受器官。在大麻哈鱼(Oncorhynchusmasou)中,血管囊可能具有代替脑垂体隆起叶的功能[13]。血管囊是鱼类[14-15]或甲壳类[16]特有的器官,位于鱼类脑垂体后方,表面被王冠细胞所覆盖。鱼类血管囊对季节变化较为敏感,是一种季节传感器[17]。目前仅在斜带石斑鱼(E.coioides)中发现有关TSHβ基因克隆和表达的研究报道[18]。因此,本实验以赤点石斑鱼为对象,考察光周期对其TSHβ和TSHR基因表达的影响,以期为石斑鱼的资源保护提供更多的信息和依据。
1 材料与方法
1.1 材料及设计
以在日本山口县水产研究所购买的赤点石斑鱼为实验对象,将其运输至长崎大学环中国东海环境资源研究所。2018年11月20日,挑选外形规格一致的鱼,全长25.14±0.57 cm(total length,TL),体重160.89±9.57 g(body weight,BW),将其饲养在2个容积为500 L的水槽中,共计60尾,每个水槽放置30尾。水槽为开放式流水养殖,水温17.1~18.8 ℃,盐度29~31,pH 7.6~8.1,溶解氧5 mg/L以上,保持24 h增氧。实验时间为11月30日至12月21日。2个水槽分别设为对照组和处理组,对照组为自然光照条件下饲养,光周期为10L∶14D(Light∶Dark);处理组以日光灯作为光源,放置在试验池上方大约2 m处,每平方米放置2根日光灯管,并在四周用黑布遮挡以避免外界干扰,利用开、关灯控制光照时间,光周期为14L∶10D。实验期间每天早晚各投食一次,所用饲料为Ohitome EP2(日清丸红饲料,日本)。实验期间无个体死亡。
1.2 方法
采样时间为11月30日、12月7日、12月14日和12月21日(每周各一次),对照组和处理组每次各6尾。采样时,用2-苯氧乙醇将鱼麻醉后,打开头盖骨,取下血管囊,将其保存在200 μL RNAlater试剂(Ambion Inc., Invitrogen Life Technologies, Japan)中4 ℃低温保存,一周后废弃RNAlater,转移至-80 ℃冰箱中长期保存用于PCR实验。实验结束后,再随机取下5尾鱼的全脑组织并将其立即置于波恩试剂中固定24 h后于70%的乙醇中保存,用于血管囊结构组织学分析。
1.2.1 血管囊的组织学观察 组织学步骤参照本实验室已发表论文[19-22]的方法,对石斑鱼全脑进行常规梯度酒精脱水、二甲苯透明、石蜡包埋和连续切片,厚度为5 μm。采用苏木精-伊红(hematoxylin-eosin,HE)染色,中性树胶封片,Olympus FX380型光学显微镜观察并拍照。
1.2.2 总RNA的提取与反转录反应 取冻存的赤点石斑鱼血管囊组织,参照TRIzol试剂盒(Life Technologies Corp.,USA)中的说明书进行总RNA的提取,经1%琼脂凝胶电泳检测RNA完整度,用NanoDrop 2000分光光度计(Thermo Scientific Inc., USA)检测RNA浓度。根据Transcriptor first strand cDNA synthesis(Roche Diagnostic GmbH, Mannheim, Germany)说明书操作,取500 ng总RNA为反转录模板合成第一链cDNA,用于PCR的扩增。
1.2.3 PCR扩增和TSHβ和TSHR基因的测序 由合成的cDNA对TSHβ和TSHR基因进行扩增。首先设计简并引物,引物参考基因库中已知同源物种的序列进行设计。TSHβ参照欧洲鲈鱼(Dicentrarchuslabrax)(GenBank accession No. KJ095101)、金头鲷(Sparusaurata)(GenBank accession No. KM014688)、红拟石首鱼(Sciaenopsocellatus)(GenBank accession No. GU144513)、尖吻鲈(Latescalcarifer)(GenBank accession No. XM-018661848)、深裂眶锯雀鲷(Stegastespartitus)(GenBank accession No. XM-008280178)。TSHR参照欧洲鲈鱼(GenBank accession No. ABD39706)、大黄鱼(Larimichthyscrocea)(GenBank accession No. XP-010755243)、高体鰤(Serioladumerili)(GenBank accession No. XP-022620292)、尖吻鲈(Latescalcarifer)(GenBank accession No. XP-018550226)、尼罗罗非鱼(Oreochromisniloticus)(GenBank accession No. XP-005449610)。使用Primer3Plus软件设计简并引物,由Fasmac公司(Kanagawa,Japan)合成,引物序列如表1所示。

表1 PCR扩增反应中的引物序列
使用EmeraldAmp®PCR Master Mix试剂盒(Takana bio株式会社,日本)对目的区域片段进行扩增,步骤如下:将-80 ℃下保存的cDNA样品在冰上解冻,之后在PCR管中加入EmeraldAmp PCR Master Mix(2×Premix)5 μL、UltraPureTMDistilled Water 3.6 μL、cDNA 1 μL、Forward primer(10 pmol/μL)0.2 μL、Reverse primer(10 pmol/μL)0.2 μL,混合均匀。随后在PCR热循环仪(Applied Biosystems Thermal Cycler)进行扩增反应,条件如下:95 ℃预变性5 min;98 ℃ 10 s、后56 ℃ 30 s、最后 72 ℃ 1 min,共30个循环;95 ℃ 5 s,65 ℃ 1 min熔解;最后50 ℃冷却30 s。反应结束后,取出PCR管,收集PCR产物并在1%琼脂糖凝胶上进行电泳检测,随后切割符合大小的条带,利用天根DNA胶回收试剂盒回收目的片段。回收后的片段与TOPO载体过夜连接,转化至DH5α大肠杆菌感受态细胞中。之后将其涂板过夜培养后,挑选阳性单菌落于含有X-Gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷)液体培养基中在37 ℃条件下震荡培养一晚,进行菌液PCR和琼脂糖凝胶电泳验证后送Fasmac公司测序。利用NCBI ORF finder在线工具(https://www.ncbi.nlm.nih.gov/orffinder/)预测赤点石斑鱼TSHβ和TSHR基因的开放阅读框。使用NCBI Protein BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对赤点石斑鱼TSHβ和TSHR碱基和所编码的氨基酸序列与其他鱼种的相似性进行比较分析。
1.2.4TSHβ和TSHR基因表达量的检测TSHβ和TSHR基因表达量的测定方法参照本实验室已发表论文[20-22]:根据已获得的TSHβ和TSHR碱基序列,用Primer3Plus软件设计,由Fasmac公司(Kanagawa,Japan)合成,引物序列如表2所示。TSHβ和TSHR基因测定参照FastStart Essential DNA Green Master(Roche Diagnostics GmbH,Mannheim,Germany)试剂盒上的说明书操作,PCR反应体系:cDNA模板1 μL,5 μL Green Master(2×concentrate),上下游引物(10 pmol/μL)各1 μL,2 μL灭菌超纯水,总计10 μL混合物。在 Light Cycler®480(Roche Diagnostics, Switzerland)进行PCR反应,条件如下:95 ℃预变性5 min;94 ℃变性10 s,58 ℃退火10 s,72 ℃延伸10 s,45个循环;95 ℃ 5 s,65 ℃ 1 min熔解;最后50 ℃冷却30 s。PCR反应后获得熔解曲线,检测数据用绝对定量法进行统计分析。

表2 实时荧光定量PCR反应中的引物序列
1.3 数据分析
2 结果与分析
2.1 赤点石斑鱼血管囊的组织学观察
赤点石斑鱼血管囊位于脑垂体后侧的延髓附近,呈一团红色状(图1(a))。组织学结果表明其位于脑垂体后方的间脑下部(图1(b)),在血管囊内部观察到了冠状细胞(图1(c)、(d))。

图1 赤点石斑鱼血管囊解剖结构及组织切片
2.2 TSHβ和TSHR基因的克隆和序列分析
运用PCR技术成功克隆出TSHβ和TSHR部分碱基序列,其碱基序列和所编码的氨基酸序列见图2。TSHβ包括270个碱基,对应89个氨基酸残基;TSHR包括380个碱基,对应126个氨基酸残基。如表3所示,赤点石斑鱼TSHβ碱基序列与欧洲鲈鱼、金头鲷、红拟石首鱼、尖吻鲈和深裂眶锯雀鲷相比,相似性分别为94%、91%、91%、90%和89%。TSHβ所编码的氨基酸序列与欧洲鲈鱼、金头鲷、红拟石首鱼、尖吻鲈和深裂眶锯雀鲷相比,相似性分别为97%、92%、92%、92%和90%。赤点石斑鱼TSHR碱基序列与欧洲鲈鱼、大黄鱼、高体鰤、尖吻鲈和尼罗罗非鱼相比,相似性分别为91%、90%、90%、89%和85%。TSHR所编码的氨基酸序列与欧洲鲈鱼、大黄鱼、高体鰤、尖吻鲈和尼罗罗非鱼相比,相似性分别为89%、91%、91%、87%和83%。

图2 TSHβ和TSHR部分碱基序列和所编码的氨基酸序列
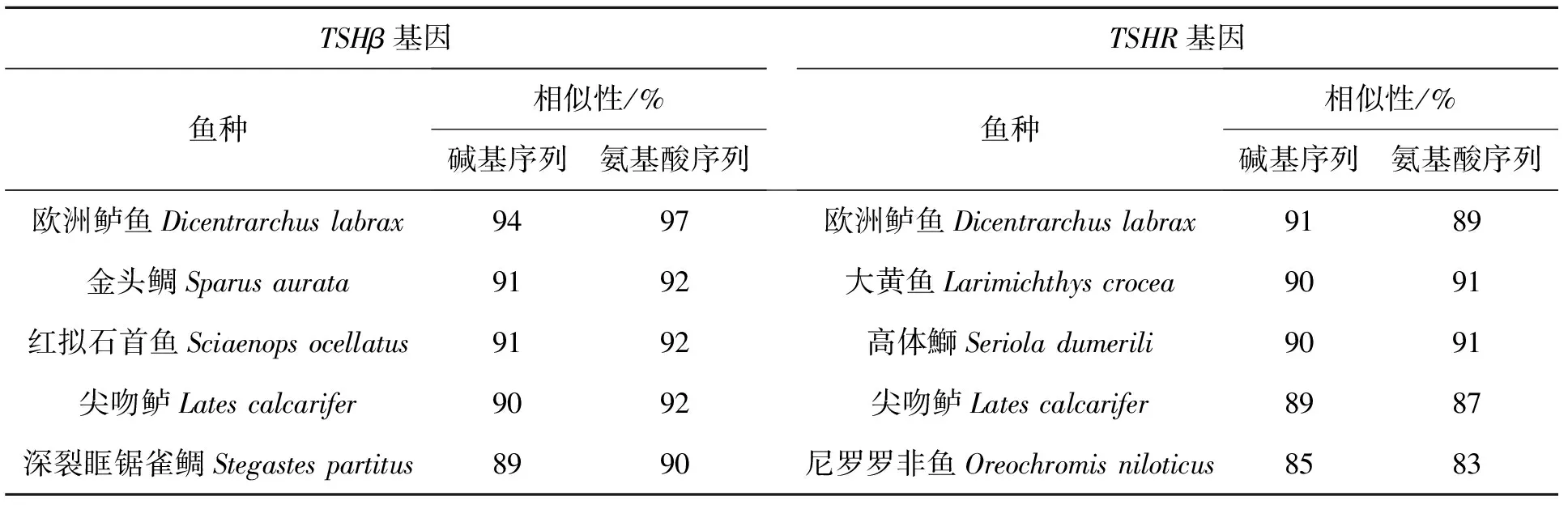
表3 赤点石斑鱼TSHβ和TSHR碱基序列及其所编码的氨基酸序列的相似性
2.3 赤点石斑鱼TSHβ和TSHR基因表达量变化
如图3所示,对照组中TSHβ和TSHR基因表达量在各时间段的差异无统计学意义(P>0.05);但处理组中TSHβ和TSHR基因表达量在12月7日均显著高于其他时间段(P<0.05),也显著高于对照组12月7日的表达量(P<0.05)。
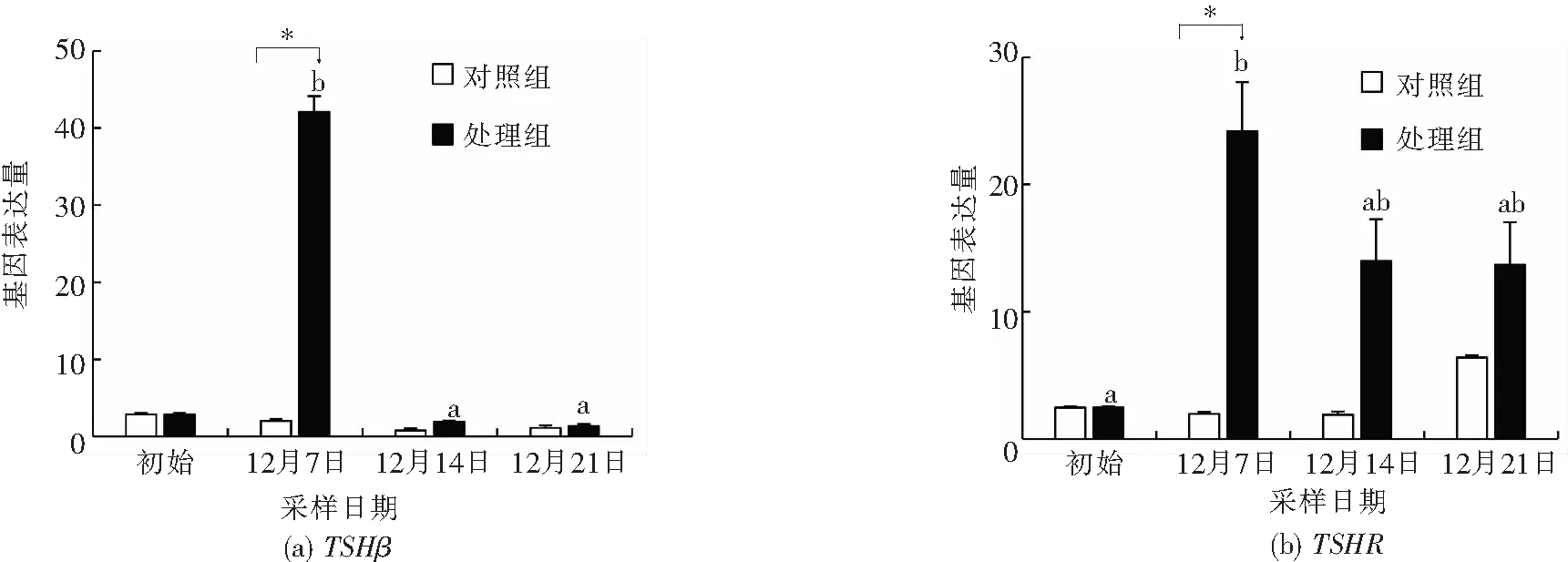
不同小写字母表示处理组间差异有统计学意义(P<0.05),相同小写字母或无字母表示对照组间或处理组间差异无统计学意义(P>0.05),*表示对照组与处理组之间差异有统计学意义(P<0.05)。
3 讨 论
3.1 赤点石斑鱼血管囊结构的组织学观察
本研究通过对赤点石斑鱼血管囊结构进行组织学观察,观察到了冠状细胞。研究表明,冠状细胞具有多种功能,包括光感受和神经内分泌输出,比如在虹鳟等硬骨鱼血管囊冠状细胞中,不仅检测到TSHβ和DIO2等物质的存在,还检测到其他光感受因子如SWS1(short wavelength-sensitive 1)和OPN4(opsin 4)蛋白因子的存在[23]。赤点石斑鱼血管囊中的冠状细胞可能也具有光信息接收和感应的功能。已有研究表明,血管囊可能具有分泌蛋白质的机能[14-16];血管囊冠状细胞和周围的毛细血管上附着有不同直径的神经纤维,这些神经纤维连接着血管囊与第三脑室,表明血管囊冠状细胞分泌的蛋白因子可能从毛细血管通过神经纤维传递到第三脑室[24]。由本研究结果推测赤点石斑鱼血管囊可能也有分泌光感应蛋白因子的机能,但蛋白因子的种类和角色有待进一步研究。
3.2 赤点石斑鱼TSHβ和TSHR碱基序列
本研究运用PCR技术,克隆到赤点石斑鱼TSHβ和TSHR基因的部分碱基,其碱基序列分别为270 bp和380 bp,与鲈形目其他鱼种进行比较分析,赤点石斑鱼碱基序列全长范围大约为850~3000 bp。已有研究表明,斜带石斑鱼TSHβ碱基序列全长为913 bp[18]。本实验中克隆的序列大概是全长的1/3到1/8。本实验克隆的TSHβ和TSHR所编码的氨基酸序列分别为89和126个氨基酸残基。鲈形目其他鱼种的TSHβ和TSHR所编码的氨基酸序列全长大约为150和780个残基。因此,从所编码的氨基酸序列长度来看,本实验克隆的TSHβ和TSHR分别约为全长的60%和15%。与鲈形目其他鱼种相比,赤点石斑鱼TSHβ相似性为89%~94%,TSHR为85%~91%。综上所述,本研究中克隆的赤点石斑鱼TSHβ和TSHR碱基序列能用于后续基因表达量的测定。
3.3 光周期对赤点石斑鱼TSHβ和TSHR基因表达的影响
本实验中赤点石斑鱼在光周期(14L∶10D)条件下饲养一周后,处理组鱼血管囊中TSHβ和TSHR基因表达量均显著增加,且显著高于对照组,表明光周期可能影响赤点石斑鱼TSHβ和TSHR基因的表达。已有研究表明,大西洋鲑(Atlanticsalmon)暴露在长光照条件下10 d后脑垂体中TSHβ基因表达量增加5倍且能够维持至少20 d;但血管囊中的TSHβ基因表达量保持低值并不受到光周期的影响[25]。在黑线仓鼠(Cricetulusbarabensis)中对TSHβ和TSHR光周期表达模式的研究发现,雄性个体垂体和睾丸中两基因在长光照的相对表达量都显著高于短光照的表达量;雌性个体垂体和卵巢中TSHβ在中光照条件下表达量最高[26]。本研究结果表明,光周期(14L∶10D)条件可能刺激赤点石斑鱼血管囊中的冠状细胞,导致TSHβ和TSHR基因表达量的增加。
4 结 论
(1)在赤点石斑鱼血管囊内部观察到了冠状细胞。(2)赤点石斑鱼TSHβ和TSHR碱基序列与鲈形目其他鱼种相比具有高度相似性,分别为89%~94%和85%~91%。(3)光周期(14L∶10D)条件可能影响赤点石斑鱼血管囊中TSHβ和TSHR基因的表达。

