Rotigotine增强细胞自噬发挥抗PD作用
田付港,郭春敏,于 昕
(烟台大学药学院,分子药理和药物评价教育部重点实验室(烟台大学),新型制剂与生物技术药物研究山东省高校协同创新中心,山东 烟台,264005)
帕金森病(Parkinson′s Disease, PD)是以中脑黑质致密部(substantia nigra pars compacta, SNpc)中DA神经元的选择性丢失、α-syn错误堆积为主要病理特征的神经退行性疾病[1]。PD发病机制不明,主要的研究观点认为PD与基因缺陷、环境毒素、机械性创伤等因素相关,其中A53T突变作为SNCA基因常染色体显性遗传突变,导致α-syn的异常堆积,被认为是30%以上家族性PD的主要病因[2]。正常α-syn为细胞中基础蛋白,在大脑中含量丰富,可以通过调节 SNARE 复合物调控神经递质的释放[3]。发生A53T突变的SNCA基因可导致α-syn异常折叠,产生α-syn寡聚体。α-syn寡聚体与细胞器脂质膜相互作用,使溶酶体和蛋白酶体功能障碍,并干扰细胞正常的自噬清除功能,导致细胞中毒死亡[4]。此外研究表明,线粒体功能障碍、α-syn 聚集以及自噬降解途径在 PD 的神经退行性过程中存在三边关系。
在药物改善细胞自噬功能的研究中发现,多巴胺受体激动剂普拉克索可增加PD小鼠脑中自噬小泡的数量,减少细胞的死亡率[5],说明多巴胺受体激动剂可能改善细胞的自噬功能。Rotigotine作为非麦角类多巴胺受体(D3/D2/D1)激动剂[6],对多巴胺受体的亲和力远大于内源性多巴胺,临床用药显示Rotigotine对PD具有良好的治疗作用[7],但未见Rotigotine对自噬作用的调节以及α-syn的清除影响的相关报道。
本试验以Rotigotine为受试用药,构建A53T-SY5Y细胞,利用MPP+刺激A53T-SY5Y细胞[8]以探究Rotigotine是否在细胞自噬方向上参与α-syn的清除发挥细胞保护作用,并为Rotigotine治疗PD的机制研究提供理论指导。
1 试验材料
1.1 细胞来源和病毒来源
人神经母细胞瘤细胞SH-SY5Y细胞株由中国科学院干细胞库提供。慢病毒购买自吉凯基因,该突变型α-syn基因的Genbank ID为6622。在A53T突变体α-syn基因中,第209位的核苷酸表现出G→A错义突变,将第53位的丙氨酸(Ala)突变为苏氨酸(Thr)。所需的培养基为含10% 胎牛血清DMEM完全培养基,置于5 % CO2、饱和湿度、37 ℃ 恒温培养箱内培养。1~2 d 更换培养液,培养至单层细胞汇合,传代培养。
1.2 药品与试剂
N-甲基-4-苯基吡啶鎓碘化物(MPP+iodide,MPP+)(N137206,阿拉丁);Rotigotine(浙江瑞博制药);β-actin抗体(小鼠单抗)、BCA浓度测定试剂盒(增强型)、TUNEL检测试剂盒、Alexa Fluor 647标记山羊抗小鼠IgG(H+L)、酶标山羊抗兔IgG、酶标山羊抗小鼠IgG、增强型特超敏ECL化学发光试剂盒(碧云天生物技术公司);α-syn抗体、LC3B抗体、P62抗体、Bax抗体、Bcl-2抗体(Cell Sigal Technology, CST)。
1.3 主要仪器
CO2培养箱(日本SANYO公司);离心机(美国Beckman公司);全自动化学发光成像凝胶成像系统(北京赛智创业科技有限公司);酶标仪(美国伯腾仪器有限公司);OLYMPUSIX73倒置荧光显微镜(北京奥林巴斯有限公司)。
2 试验方法
2.1A53T α-syn过表达细胞构建以2×l07个/L的密度接种对数生长状态良好的SH-SY5Y细胞于6孔板中,使96 h后细胞生长良好便于传代。将细胞分为正常对照组、阴性对照组、SNCA过表达组,24 h后,分别以仅可感染表达荧光蛋白的病毒感染阴性对照组细胞、以可同时感染表达目的蛋白与荧光蛋白的病毒感染SNCA过表达组细胞,浓度均为20 MOI。96 h后,荧光显微镜下观察EGFP的表达,统计转染效率。选择转染稳定的过表达SNCA(A53T)细胞株,嘌呤霉素筛选,建立单克隆A53T-SY5Y细胞系(Tg)。
2.2TUNEL染色多聚赖氨酸包被24孔板15 min,培养基洗3次,以2×l07个/L的密度接种于板上。24 h后更换含有Rotigotine(0.1、1、10 nmol/L)的DMEM培养基,对照组更换新鲜DMEM培养基继续培养。1 h后加入1 mmol/L MPP+,24 h后,PBS浸洗,4%多聚甲醛固定,Triton X-100通透,滴加TUNEL检测液37 ℃避光孵育60 min,抗荧光淬灭封片液封片,然后在荧光显微镜下观察采集图像,并使用Image J软件进行定量。
2.3Western Bolt检测细胞蛋白表达药物处理后,裂解细胞约20 min,15 000 r/min离心处理15 min,收集上清,BCA法测定蛋白浓度并配平,蛋白样品在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中分离,转移到聚偏二氟乙烯(PVDF)膜上。封闭后将膜与一抗在4 °C下反应过夜,随后将膜与二抗在室温下共孵育1 h。通过增强型特超敏ECL化学发光试剂显影,使用Image J软件进行定量。
2.4细胞免疫荧光多聚赖氨酸包被后,以2×l07个/L的密度接种于板上,药物处理后,PBS浸洗,4%多聚甲醛固定后Triton X-100通透,1% BSA室温封闭后一抗4 ℃ 孵育过夜,滴加荧光二抗孵育1 h,滴加 DAPI避光孵育5 min,抗荧光淬灭封片液封片,荧光显微镜下观察采集图像,并使用Image J软件进行定量。
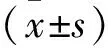
3 试验结果
3.1 荧光显微镜下观察细胞内荧光蛋白的表达
除正常对照组外,阴性对照组和过表达组细胞均可见荧光蛋白表达,显示病毒转染成功(图1)。
对明场及暗场荧光细胞计数,计算转染效率:转染效率=暗场荧光细胞个数/明场细胞个数。正常对照组、阴性对照组和SNCA过表达组的慢病毒转染效率分别为0、29.37%和55.83%。

图1 细胞内荧光蛋白的表达
3.2 Rotigotine降低了MPP+作用下Tg细胞的细胞毒性
TUNEL荧光结果表明,与正常组相比,模型组荧光强度显著上升(P<0.01);与模型组相比,Rotigotine治疗组TUNEL荧光强度显著下降(P<0.01),且具有浓度依赖性,说明在一定浓度范围内,Rotigotine发挥细胞保护作用(图2)。
与对照组相比,##P < 0.01;与模型组相比,**P<0.01。
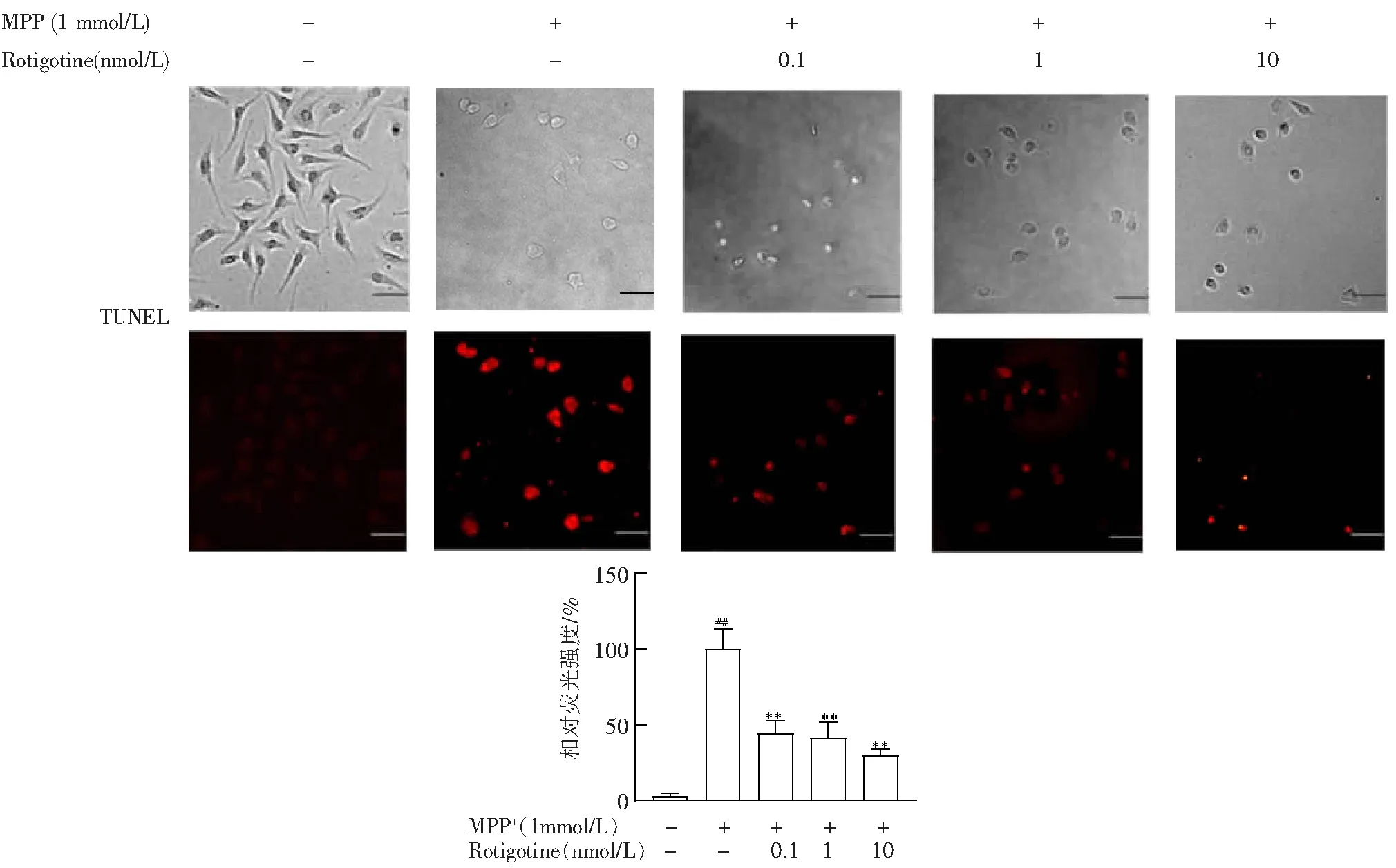
Western Blot结果表明,与正常组相比,模型组Bcl-2/Bax比值显著下降(P<0.01),与模型组相比,Rotigotine 治疗组Bcl-2/Bax比值增加,且呈剂量依赖性,说明在一定浓度范围内,Rotigotine保护受损伤细胞,具有浓度依赖性(图3)。
与对照组相比,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
3.3 Rotigotine激活自噬保护受损细胞
由图 4可见,与正常组相比,模型组LC3B含量显著下降,P62含量显著增加;与模型组相比,Rotigotine治疗组LC3B含量增加,P62含量降低,且具有浓度依赖性,说明在一定浓度范围内,Rotigotine可以激活自噬,保护受损细胞。

与对照组相比,#P<0.05,##P<0.01;与模型组相比,*P<0.05,**P<0.01。
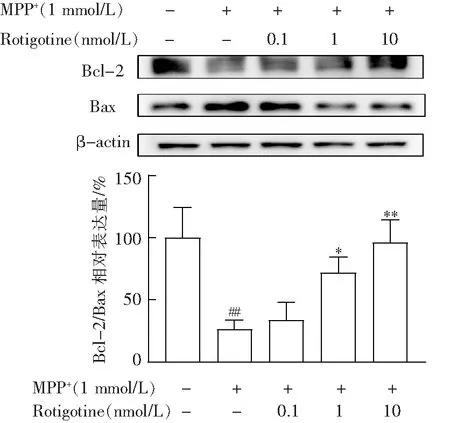
3.4 Rotigotine增加对α-syn的清除
由图5可见,与正常组相比,模型组α-syn含量显著增加;与模型组相比,Rotigotine治疗组α-syn含量降低,说明Rotigotine可以通过激活自噬,增加对α-syn的清除。
与对照组相比,##P<0.01;与模型组相比,**P<0.01。
4 讨 论
α-syn与帕金森病的发病机制密切相关,α-syn可破坏细胞内的自噬平衡最终导致细胞凋亡[9]。自噬是一种进化上保守的稳态机制,用于最大限度地减少异常蛋白质聚集并促进细胞器更新[10]。α-syn的累积会危害自噬,这反过来又可能进一步抑制其自身的降解,导致神经元死亡的恶性循环[11]。在药物改善细胞自噬功能的研究中发现,多巴胺受体激动剂普拉克索可增加PD小鼠脑中自噬小泡的数量,减少细胞的死亡率[5],该结果表明多巴胺受体激动剂可能通过增强受损细胞的自噬功能而发挥神经保护作用。基于以上理论,本研究利用A53T-SY5Y细胞模型探讨多巴胺受体激动剂Rotigotine通过改善细胞自噬功能进而介导细胞保护的作用机制。
人神经母细胞瘤细胞SH-SY5Y具有成熟神经元形态和生化特征,常用于神经科学领域的研究。PD造模药MPP+可通过影响线粒体复合物Ⅰ致ATP消耗,进而触发多巴胺渗漏到细胞质中并刺激ROS的产生和诱导神经元凋亡,还可通过ERK/MAPK通路介导α-syn的增加[12]。
本研究采用MPP+处理过表达A53T突变体α-syn的SH-SY5Y细胞制作PD细胞模型,在细胞水平上观察Rotigotine的细胞保护作用,并研究其影响自噬调节的机制。TUNEL染色结果显示,与正常组相比,过表达基因组细胞中可观测到较多的绿色荧光蛋白表达,表明成功构建了A53T SNCA基因过表达细胞模型;Western Blot结果显示,与对照组相比,模型组α-syn蛋白含量显著上升,与模型组相比,Rotigotine给药组α-syn蛋白含量明显下降;凋亡蛋白结果表明,与对照组相比,模型组Bcl-2/Bax蛋白含量显著降低,与模型组相比,Rotigotine给药组Bcl-2/Bax蛋白含量升高,同时在TUNEL荧光结果上也具有相同表现,说明Rotigotine可抵抗MPP+和α-syn诱导的细胞凋亡;自噬蛋白结果显示,与对照组相比,模型组自噬标志蛋白LC3B含量显著下降,自噬底物蛋白P62含量显著升高,表明PD模型细胞内的自噬功能被MPP+和α-syn破坏;与模型组相比,Rotigotine给药组LC3B蛋白含量上升,P62蛋白含量下降,均具有统计学意义和剂量依赖性。上述结果说明Rotigotine可剂量依赖性地上调PD模型细胞的自噬,增加对α-syn的清除,进而发挥神经保护作用。
5 结 论
本研究结果表明,Rotigotine可通过上调自噬蛋白,拮抗MPP+损伤的α-syn过表达细胞PD模型中的自噬抑制,从而进一步增强PD细胞模型的自噬功能,增强对α-syn的清除,同时减少细胞凋亡,保护神经元,发挥抗PD的作用。

