葡萄糖转运体8 的生物信息学分析
高 晗,赵 贝
(大理大学基础医学院,云南 大理 671000)
在大脑中表达的葡萄糖转运体有两种,一种是包含非钠依赖性葡萄糖转运体(glucose transporter,GLUT),另一种是钠依赖性GLUT。不同的GLUT 在大脑中不同位置和细胞中表达,以保证大脑正常的能量代谢。研究表明[1-3],GLUT8 大脑中在皮质、小脑、下丘脑、海马中均有表达,而在大鼠脑中,GLUT8在神经元中普遍表达,但不在星形胶质细胞或者小胶质细胞中表达。虽然GLUT8 和GLUT3 都在神经元上表达,但其表达的位置不同。GLTU8 定位在神经元胞体和近端顶端树突上,参与了海马神经元的能量供应[4]。在哺乳动物大脑发育过程中,GLUT8 表达增加可为大脑发育提供能量[5]。但目前尚未确定GLUT8 是否接受D-半乳糖、D-果糖、磷酸化单糖作为底物,同时GLUT8 在大脑中的生理功能、调节机制及病理生理影响尚不明确。基于此,本研究通过在线软件分析对GLUT8 的结构和功能进行生物信息学分析,以期为进一步研究GLUT8 在大脑中的生理功能、调节机制和病理生理机制提供理论基础。
1 资料与方法
1.1 数据资料 通过美国国家生物技术信息技术中心NCBI数据库(https://www.ncbi.nlm.nil.gov)对GLUT8 进行序列分析;登录Uniprot 蛋白数据分析库和NCBI 网站,获取GLUT8 的基因序列和氨基酸序列。
1.2 生物信息学分析 ①理化性质分析:通过在线软件Expasy 的ProtParam Pool 和ProtScale 分别对GLUT8 进行理化性质和亲疏水性分析;②蛋白跨膜区域、亚细胞定位和细胞信号肽的预测:通过TMHMM(TMHMM Server V 2.0)和SignalP 4.1 对GLUT8对跨膜区域和信号肽预测;通过ProtCrop-Version对GLUT8 细胞定位分析;③蛋白糖基化分析:通过YinOYang 1.2 Server 分析GLUT8 的O-糖基化位点;通过NecNGlyc 1.0 Server 分析GLUT8 的N-糖基化位点;④蛋白磷酸化位点预测:通过NetPho3.1在线工具预测GLUT8 的磷酸化位点;⑤蛋白二、三级结构分析:通过在线工具SOPMA 分析GLUT8 的二级结构;另通过SWISS-MODEL 和UniProt 网址分析GLUT8 的三级结构;⑥蛋白相互作用分析:通过UniProt 的Inertation 数据库对GLUT8 蛋白进行二元相互作用分析;另通过UniProt 的STRING 数据库进行蛋白相互作用网络分析。
2 结果
2.1 蛋白基因及编码蛋白的基本信息 GLUT8 蛋白由SLC2A8 编辑,位于9q33.3,全长10 759 bp,包含11 个外显子,477 个氨基酸。基因ID:29 988,基因组序列为NC-000009,蛋白质NP-055395.2。
2.2 蛋白质的理化性质及亲疏水性分析 GLUT8 有477 个氨基酸,其中丙氨酸(Ala)占12.8%,亮氨酸(Leu)占13.8%,其他氨基酸的占比均小于10%。带负电荷残疾的天冬氨酸(Asp)和谷氨酸(Glu)的总数为28,正电荷残疾的精氨酸(Arg)和赖氨酸(Lys)的总数为29。相对分子质量为50 819.08。分子式为C2361H3665N587O661S24,原子总数为7298。不稳定指数(Ⅱ)为41.07。理论等电点pⅠ为7.55。蛋白脂肪系数为110.25。通过ProtScale 获得GLUT8 蛋白亲疏水性氨基酸残基的分布图,结果显示氨基酸亲水性得分最大值为2.56,最小值为-3.33,标度值>0 区域比<0 区域密集;总平均亲水性为(GRAVY)0.73,见图1。
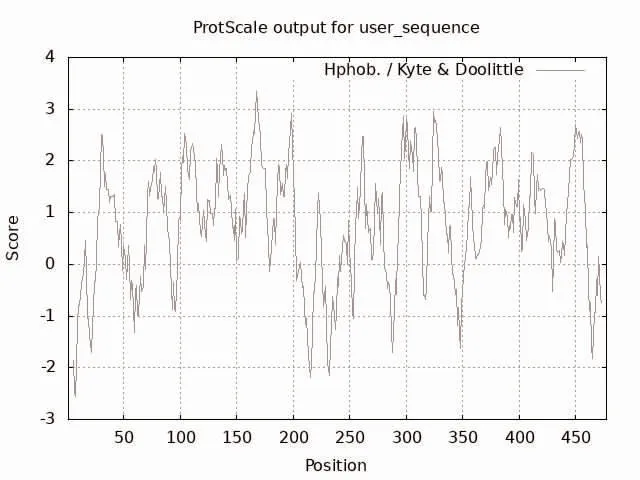
图1 GLUT8 蛋白亲水性分析
2.3 蛋白的跨膜区域以及亚细胞定位 TMHMM Server.2.0 工具在线分析显示,GLUT8 蛋白有12 个跨膜结构域,见图2。ProtCrop-Version 9 分析显示,GLUT8 蛋白主要定位于细胞膜和细胞质内,见表1。SignalP 4.1 软件在线分析显示,GLUT8 蛋白信号肽中Cmax在42,为0.127;Ymax在42,为0.161;Smax在30,为0.262,见图3。
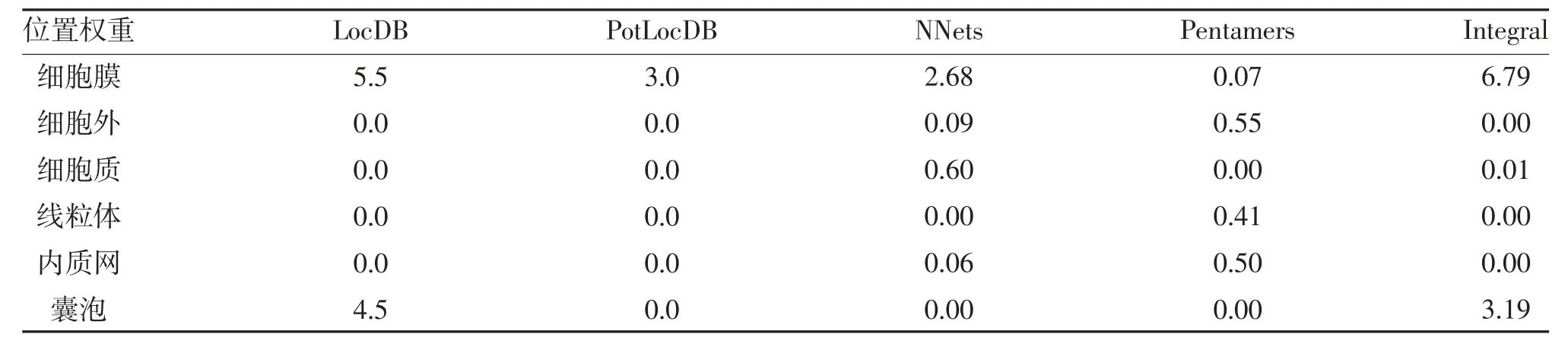
表1 GLUT8 蛋白的亚细胞定位
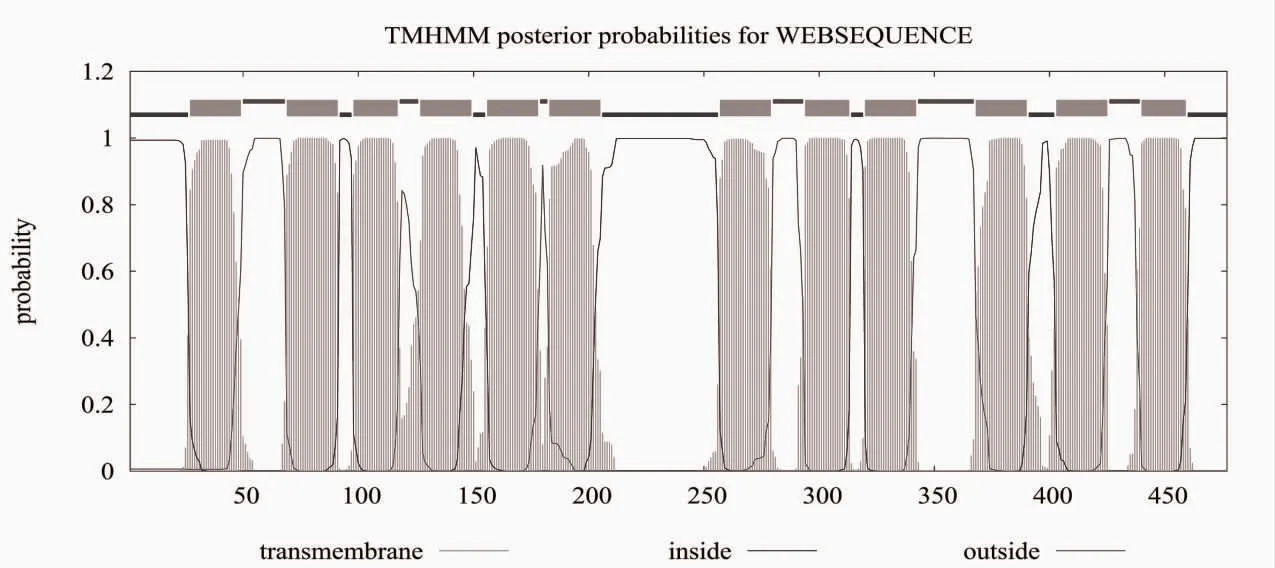
图2 GLUT8 蛋白的跨膜结构域分析

图3 GLUT8 蛋白信号肽分析
2.4 蛋白的糖基化分析 GLUT8 蛋白有5 个O-糖基化位点,分别在47、333、350、356、360 位。N-糖基化分析显示,GLUT8 蛋白有1 个N-糖基化位点,在349 位,见图4、图5。

图4 GLUT8 蛋白O-糖基化分析

图5 GLUT8 蛋白N-糖基化分析
2.5 蛋白的磷酸化位点分析 GLUT8 蛋白共有24 个磷酸位点,见图6。其中,丝氨酸(Ser)磷酸化位点12个,苏氨酸(Thr)磷酸化位点10 个,酪氨酸(Tyr)磷酸化位点2 个,见表2。

表2 GLUT8 蛋白磷酸化位点预测

图6 GLUT8 蛋白磷酸化位点分析
2.6 蛋白的二级结构和三级结构分析 二级结构:采用SWISS MODEL 软件分析GLUT8 蛋白的三维立体结构,该模型的GEMQ 评分为0.63 分,平均QMEAN 评分为(0.66±0.05)分,见图7。三级结构:采用SPOMA 软件分析GLUT8 蛋白的二级结构,其中α-螺旋(Hh)231 个,占48.43%;无规则卷曲(Cc)135 个,占28.3%;β 折叠(Ee)89 个,18.66%;β 转角(Tt)22 个,占4.61%,见图8。

图7 GLUT8 蛋白三级结构分析

图8 GLUT8 蛋白二级结构分析
2.7 蛋白的相互作用分析 GLUT8 蛋白共与46 个蛋白有二元相互作用,见图9。蛋白相互作用网络分析显示,GLUT8 蛋白与10 个蛋白有相互作用,分别是SLC5A1、SLC23A1、FAM162A、MAP3K14、MRPS33、NPEPL1、CHSY3、AP2A1、AP2A2、AP2B1,见图10。
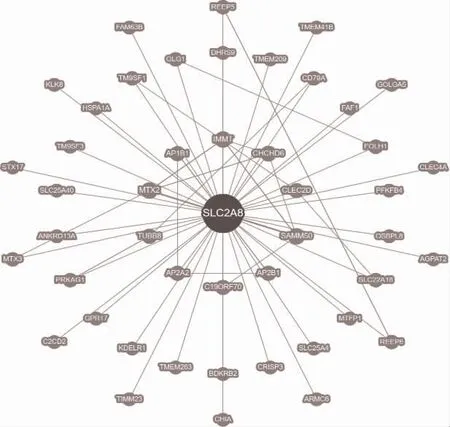
图9 GLUT8 蛋白二元相互作用网络

图10 GLUT8 蛋白相互作用网络
3 讨论
脑细胞不能储存和合成葡萄糖,因此人脑几乎完全依赖葡萄糖作为能量来源。大脑需要源源不断的葡萄糖供应来维持脑细胞正常活动、神经递质的合成和神经突触形成[6]。而葡萄糖是一种极性大分子物质,不能通过单纯扩散穿过质膜的双层脂质层[7],因此需要转运载体进入细胞。GLUT 家族蛋白是糖转运蛋白亚家族成员,现有14 个成员[5],不同的GLUT 分布在不同的组织和细胞中,特定的GLUT 促进不同的底物进入细胞,如葡萄糖、果糖、肌醇等。GLUT8 是继GLUT4 后第2 个由胰岛素调节的葡萄糖转运体[8],具有高亲和力葡萄糖转运活性(Km=2 mmol/L)[9]。GLUT8 的底物现已确定的有葡萄糖[10]、海藻糖[11]、己糖[12],海藻糖的摄入可以上调大脑中的GLUT8 的表达[13],除葡萄糖外尚未确定这些底物的Km 值。除了在海马体中高表达,GLUT8 还在学习和记忆、探索、恐惧、焦虑、多动等行为特征的脑区中发挥作用[14-17]。Schmidt S 等[18]在GLUT8 敲除小鼠中发现,小鼠表现为过度活跃且行为学实验有明显改变,这种改变是由GLUT8 引起的葡萄糖代谢障碍导致神经元功能障碍的结果。另有实验研究显示[10],GLUT8 可能是将葡萄糖从粗面内质网运输到细胞质中,而且GLUT8 可能影响海马的葡萄糖稳态。海马在大脑中具有至关重要的作用,而GLUT8在海马的能量供应起着主要的调节作用,明确GLUT8 的生理功能和调节机制可能对神经退行性疾病的研究有着重要意义。目前对于大脑中GLUT8的生理功能和调节机制的研究较少,因此利用生物信息学技术对GLUT8 进行分析和预测,有助于对GLUT8 在大脑的生理功能和调节机制进行研究。
在过去的几十年中,使用高通量技术研究分子生物学系统已改变了生物学和生物医学的研究,使研究人员能够系统的研究生物体的基因组(基因组学)、一组RNA 分子(转录组学)和一组蛋白质,以及其结构和功能(蛋白质组学)[19]。因大多数生理和病理过程都表达在蛋白质水平上,现已开发了很多公开可用的数据库和资源,以支持与蛋白质相关的信息管理和生物学知识的发现,可帮助研究人员快速寻找研究蛋白的相关信息学资源,为科研研究提供便利。本研究选取了一些常用的数据库和资源对GLUT8 的蛋白特性、糖基化位点、磷酸化位点、与蛋白的二元相互作用及有相互作用的蛋白进行了预测,结果显示GLUT8 蛋白由SLC2A8 编码,位于9q33.3;全长10 759 bp,包含11 个外显子,共477个氨基酸。GLUT8 为不稳定疏水性蛋白,无信号肽,有12 个跨膜区域,二级结构以α-螺旋为主,定位于细胞膜和细胞质中。蛋白质的糖基化参与多个生物过程,影响蛋白特性,而有的蛋白需要糖基化才能正常的折叠和在细胞内穿行[20]。本研究结果发现,GLUT8 有6 个糖基化位点,有利于其与不同底物结合,并携带底物在胞内迁移。GLUT8 磷酸化修饰主要参与细胞的信号转导,对蛋白的活性和功能有重要的影响。本研究预测GLUT8 具有24 个磷酸化位点,推测其可能有多个作用位点和参与多条信号通路。现已确定的磷酸化位点为AMPK[21],其他的磷酸化位点尚未见到报道。此外,预测的GLUT8 与46 个蛋白有二元相互作用,与10 个蛋白有相互作用,以上结果为进一步研究GLUT8 在脑内的生理功能和调节机制提供了理论依据。
综上所述,GLUT8 为12 次跨膜蛋白,有多个糖基化位点和磷酸化位点,与多个蛋白相互作用,参与多条信号通路。

