不同品质冰糖橙果园土壤化学性质与微生物群落差异分析
徐绍英 彭 双 林先贵 王一明,* 戴 勋 褚跃革 黄学彩
(1 中国科学院南京土壤研究所,江苏 南京 210008;2 中国科学院大学,北京 101400;3 红塔烟草(集团)有限责任公司,云南 玉溪 653100;4 云南省玉溪市高原甜橙有限责任公司,云南 玉溪 653100)
冰糖橙(Citrussinensis)属于芸香科(Rutaceae)柑橘属(Citrus)常绿乔木,是从普通甜橙的优良实生变异中选出的地方良种[1]。该品种因品质优良、味浓香甜、肉质脆嫩等特性而倍受市场欢迎。云南是我国冰糖橙的主要产地之一,种植面积达6 700 hm2[2]。冰糖橙的产量和品质受多种自然因素的影响,包括土壤、气候、地形地貌、水文等,其中土壤是柑橘生产的基础,土壤养分和肥力状况直接影响柑橘的产量和品质[3]。研究表明,土壤有机质与甜橙果实品质、还原糖、可溶性固形物含量呈显著线性正相关,水解性氮与果实糖酸比、固酸比含量呈显著线性正相关[4];土壤速效钾、有效硼和pH可显著影响冰糖橙果实的可滴定酸含量;土壤有机质、有效磷、交换性镁和pH可显著影响维生素C的含量[3]。
微生物作为土壤生态系统的重要组成部分,是土壤化学过程的主要推动者[5],也是土壤肥力形成和持续发展的基础[6]。土壤中一些微生物群落可以促进植物对土壤氮、磷养分的吸收[7],菌根群落可以增加土壤磷的转化以及磷对植物的可吸收性[8]。果园土壤微生物对土壤养分转化、植物生长及健康至关重要,研究表明根际促生菌具有促进磷酸盐溶解、固氮、产生生长素等功能[9],一些菌群还可以诱导柑橘对病原体产生抗性[10]。土壤微生物可以通过多种方式影响土壤肥力和植株生长状况,而土壤养分状况和植物生物量以及健康状况又反过来影响着土壤微生物群落的结构和功能[11-12]。因此,除了土壤化学性质外,植物的物种特性和生命力等性状对根际土壤微生物群落也有相当大的影响。充分了解植物性状-土壤化学性质-土壤微生物三者之间的相互关系和综合作用,对于更好地指导农事管理和农业施肥措施具有重要意义。
坡地果园容易受到土壤侵蚀和养分流失的影响,因此土壤肥力对于保持水果的产量和品质非常重要。然而,坡地果园开垦对土壤质量,尤其是果园土壤发育过程中土壤微生物特性的影响,目前尚不清楚。本研究以云南哀牢山产区不同品质冰糖橙果园土壤为研究对象,在土壤类型、海拔、农事管理和树龄(10 年以上)均相同的情况下,对比不同品质冰糖橙果园土壤化学性质和微生物群落的差异,分析导致冰糖橙品质发生变异的因素,探讨冰糖橙地上变异与地下土壤化学性质和微生物群落之间的因果关系,旨在为冰糖橙果园栽培管理、微环境调节以及土壤状况的评估提供理论参考。
1 材料与方法
1.1 采样地点信息
采样地点位于云南省玉溪市高原甜橙有限责任公司新平哀牢山基地,海拔700~900 m,土壤类型为红砂岩发育的湿润富铁土(Udic Ferrosols)。橙园果树品种为冰糖橙,树龄10 年以上,平均每棵树产果30 kg。果园每年施肥2次,分别在每年的5月和12月施肥,夏肥(5月)施用量:每棵树施用钙镁磷肥0.8 kg(含五氧化二磷16%),尿素0.4 kg(含氮46%),硫酸钾0.6 kg(氧化钾含量50%)。冬肥(12月)施用量:每棵树施用钙镁磷肥0.8 kg(含五氧化二磷16%),尿素0.4 kg,农家肥30 kg。施肥方式为放射状沟施,沟深30~40 cm,施入肥料后覆盖土壤。该果园经过十多年管理和栽培,部分冰糖橙产出的果实糖度较高,并带有蜂蜜味,品质较其他橙树的果实好,因此将橙园中的果树划分为两类,即高品质冰糖橙(记为H)和普通冰糖橙(记为N)。2019 年9月对橙子品质进行分析,数据如表1所示。
1.2 试验方法
1.2.1 土壤样品采集 土壤样品采于2019 年7月,对两组橙子树根围0~20 cm土层(记为a)和20~30 cm土层(记为b)分别进行采样,每组样本设置3个重复。土壤样品采集方式为五点取样法,每个样点在橙子树的滴水线(距离橙子树主干30~50 cm)内,用无菌铲采集土壤样品,去除杂质后混匀,一部分风干用于测定土壤化学性质,另一部分置于-20℃冰箱中保存用于DNA提取。

表1 不同品质冰糖橙果实的品质差异Table 1 Quality of Bingtang orange fruits with different quality
1.2.2 土壤化学性质和微量元素含量的测定 土壤化学性质与微量元素测定的指标:pH值(水土比为2.5∶1)、有机质(organic matter,OM)、水溶性碳(water soluble carbon,WSC)、全氮(total nitrogen,TN)、全磷(total phosphorus,TP)、全钾(total potassium,TK)、水解性氮(hydrolyzed nitrogen,HN)、有效磷(available phosphorus,AP)、速效钾(readily available potassium,RAK)、缓效钾(slowly available potassium,SAK)、交换性钙(exchangeable calcium,ECa)、交换性镁(exchangeable magnesium,EMg)、有效铜(available copper,ACu)、有效锌(available zinc,AZn)、有效锰(available manganese,AMn)、有效铁(available iron,AFe)、有效硼(available boron,AB)、有效钼(available molybdenum,AMo)和有效硅(available silicon,ASi),均由云南三标农林科技有限公司采用常规方法完成,具体参见《土壤农化分析》[13]。
1.2.3 土壤DNA提取、扩增和测序 每个样品称取0.5 g鲜土(各土样含水量在12%~16%之间,差异不大),利用Fast DNA Spin Kit for Soil试剂盒(MP Biomedicals,美国)提取土壤总DNA,步骤参照试剂盒说明,利用1.0%琼脂糖凝胶电泳检测DNA的纯度和浓度,于-20℃冰箱保存备用。依托北京诺禾致源公司的IonS5TMXL平台,采用单端 (Single-end) 测序的方法,对各处理土壤DNA的真菌内转录间隔区(ITS)的ITS1区和细菌16S rRNA基因的V4区进行扩增测序。
通过Cutadapt软件对Reads进行过滤,按Barcode拆分出各样品数据,截去Barcode和引物序列并去除嵌合体序列,得到最终有效数据。用Uparse软件对序列进行聚类,默认以97%的一致性将序列聚类成为操作分类单元(operational taxonomic unit,OTU)。根据OTU聚类结果,细菌和真菌分类分别对应于SILVA132数据库和Unit(v7.2)数据库,对每个OTU的代表序列做物种注释,设定阈值为0.8~1,获得各个分类水平下的物种丰度信息。利用QIIME 1.9.1软件计算Alpha多样性指数(Chao1指数、ACE指数、Simpson指数和Shannon指数)。
1.3 数据统计与分析
运用SPSS 13.0软件进行统计分析,并使用独立样本T检验比较同一土层的两组土壤化学性质是否具有显著差异(P<0.05)。使用Wilcox检验进行组间Alpha多样性指数的差异显著性分析;使用R软件的pheatmap软件包对属水平上细菌和真菌优势群落相对丰度进行聚类分析并绘制热图;用Vegan软件包进行NMDS分析和Adonis、ANOSIM检验,分析微生物群落结构并对其进行差异显著性检验。通过组间T检验,找出丰度差异显著(P<0.05)的物种。利用R软件中的Plspm软件包分析土壤化学性质、微量元素含量、细菌群落结构、真菌群落组成和橙子品质之间的关系;GoF作为整个模型的平均预测指标,GoF值越高越好,在偏最小二乘路径建模(partial least squares path modeling,PLS-PM)中,GoF值大于0.7被认为模型非常好。
2 结果与分析
2.1 土壤化学性质
不同品质冰糖橙根围土壤中的化学性质和微量元素含量如表2所示,与普通品质冰糖橙0~20 cm土层土壤(Na)相比,高品质冰糖橙土壤(Ha)中有机质含量显著提高(P<0.01),交换性钙、交换性镁的含量显著提高(P<0.05),全钾含量显著升高(P<0.001),分别提高了30.22%、26.23%、43.56%、84.31%,有效锰含量降低了67.16%(P<0.05);在20~30 cm土层,高品质冰糖橙根围土壤(Hb)中全磷、全氮和全钾的含量分别在P<0.05、P<0.01、P<0.01水平显著升高,与Nb相比分别升高了81.48%、73.24%、69.15%,有效锰含量降低了57.6%(P<0.01)。
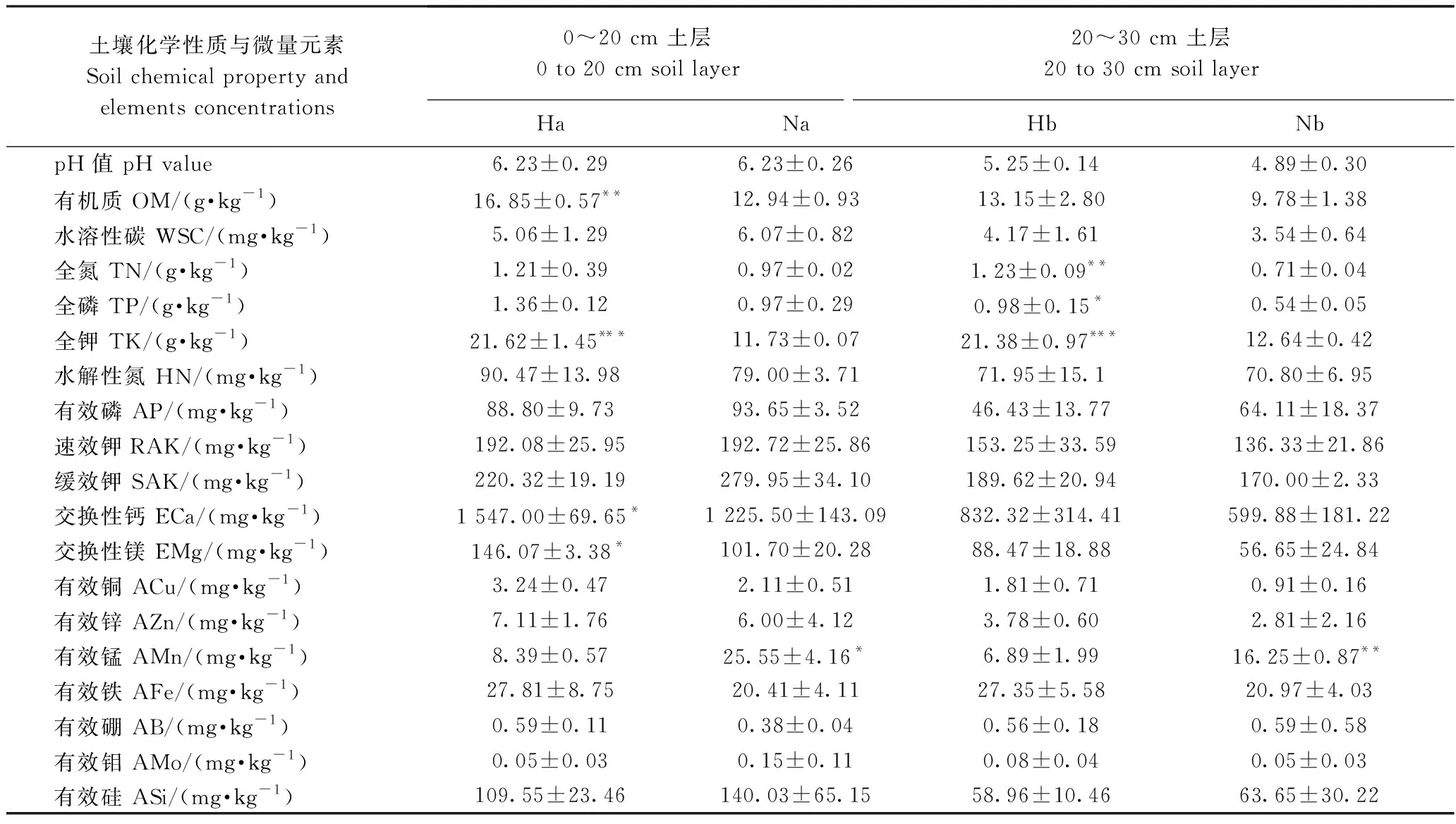
表2 不同品质冰糖橙根围土壤化学性质及其差异Table 2 Chemical property and differences of soil samples near the root zone of different quality Bingtang orange
2.2 土壤微生物群落多样性
细菌和真菌群落的α多样性指数及其Wilcox检验结果如图1所示,不同品质冰糖橙根围土壤微生物群落多样性指数无显著差异,仅普通品质冰糖橙根围土壤的不同土层之间,细菌群落的Shannon指数和ACE指数存在显著差异,真菌群落的Chao 1指数存在显著差异。对细菌和真菌群落进行NMDS分析,并对组间群落结构差异进行ANOSIM显著性检验,结果表明不同品质冰糖橙根围土壤微生物群落结构也无显著差异(P>0.05,图2)。

注:*表示在P<0.05水平差异显著。Note:*indicates significant difference at 0.05 level.图1 土壤细菌群落(a)和真菌群落(b)的α多样性指数Fig.1 Alpha diversity index of soil bacterial community (a) and fungal community (b)

注:ANOSIM分析中R值介于-1~1之间,R大于0,说明组间存在差异,R小于0,说明组间没有差异,P< 0.05表示统计具有显著性。Adonis分析中的R2表示不同分组对样本差异的解释度,即分组方差与总方差的比值,R2越大表示分组对差异的解释度越高, P<0.05说明检验的可信度高。Note: The R value in the ANOSIM analysis is between (-1, 1), R is greater than 0, indicating that there is a difference between groups, R is less than 0, indicating that there is no difference between groups, P<0.05 indicates statistical significance. The R2 in the Adonis analysis indicates the degree of interpretation of sample differences between different groups, that is, the ratio of the group variance to the total variance. The larger R2indicates the higher the degree of explanation of the difference between the groups, P<0.05 indicates the higher reliability of the test.图2 不同品质冰糖橙果园土壤细菌(a)、真菌(b)群落结构NMDS分析Fig.2 Nonmetric Multidimensional Scaling analysis of bacterial (a) and fungus (b) community structure in different quality Bingtang orange orchards soil
2.3 土壤微生物组成
土壤细菌群落组成如图3所示,主要的细菌优势菌门(图3-a)为放线菌门(Actinobacteria,31.90%~41.33%)、变形菌门(Proteobacteria,21.21%~32.92%)、绿弯菌门(Chloroflexi,7.69%~12.69%)和酸杆菌门(Acidobacteria, 7.35%~12.58%)。对36个优势细菌种属进行分析,发现土壤中的优势细菌种属丰度存在明显差异(图3-b),聚类分析发现Ha与Na聚在一个分支,说明土层深度对细菌群落的影响大于分组差异。通过T检验,找出组间相对丰度具有显著性差异的菌群,结果如图3-c、d所示,与Na相比,绿弯菌门(Chloroflexi)和蓝细菌门(Cyanobacteria)在Ha土壤中显著富集,拟杆菌门(Bacteroidetes)则显著减少;Hb土壤中酸杆菌门(Acidobacteria)相对丰度显著低于Nb土壤(图3-d)。在科水平上,与Na相比,纤线杆菌科(Ktedonobacteraceae)和绿弯菌未鉴定科(unidentified_Chloroflexi)在Ha土壤中显著富集(图3-c)。
土壤真菌群落组成如图4-a所示,优势真菌类群为子囊菌门,占比61.4%~79.9%,其次为担子菌门,占比1.5%~3.2%。优势真菌种属存在明显的差异(图4-b),聚类分析发现Ha与Hb聚在一个分支,说明土层深度对真菌群落的影响小于分组差异。通过T-test检验发现,Ha与Na,Hb与Nb之间,各真菌类群在门水平上均无显著差异,在科水平上,丛赤壳科(Nectriaceae)(Ha 31.27%,Na 16.11%)、枝孢菌科(Cladosporiaceae)和葡萄穗霉科(Stachybotryaceae)在Ha土壤中显著富集(图4-c);Hb与Nb相比,科水平上各真菌类群相对丰度无显著差异。
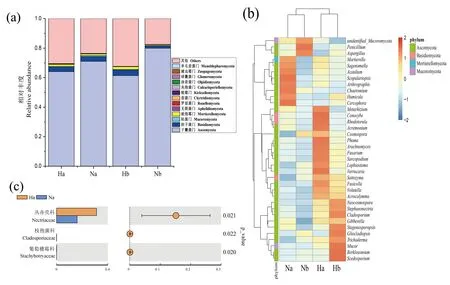
注:a:门水平土壤真菌种群的物种丰度;b:属水平优势真菌类群的丰度热图;c:科水平上组间差异物种。Note: a: Relative abundance of soil fungal phylum. b: Clustered heat map for the relative abundance of the dominant fungal genus. c: Different fungal families between groups.图4 土壤真菌群落物种组成及组间差异物种Fig.4 Species composition of soil fungal community and the different species between groups
2.4 土壤化学性质、微生物群落与冰糖橙品质的关系
将土壤化学性质、土壤微量元素含量、微生物群落结构与橙果实品质进行PLS-PM分析,结果如图5所示。土壤化学性质和微生物群落结构对橙果实品质产生了直接正影响,土壤微量元素含量对橙果实品质均产生了负影响,但影响均未达到显著水平,其中对橙果实品质产生直接影响最大的是土壤化学性质(主要是TK、TN和OM),直接影响系数达到了0.961(图5-a)。由图5-b可知,对橙果实品质的总影响(包括直接和间接影响)较大的是土壤化学性质(0.563)和微量元素(-0.761);土壤中的细菌和真菌群落结构对橙子品质的总影响分别为0.242和0.361,均小于土壤化学性质和微量元素的影响。
3 讨论
3.1 土壤养分及微量元素是影响橙果实品质的主要因素
研究表明,冰糖橙果实中可溶性固形物含量主要受土壤有机质、有效铜、有效锌含量和pH值的影响,可滴定酸含量主要受土壤速效钾、有效硼含量和pH值的影响[3]。Peng等[14]发现柑橘根系土壤镁元素的缺乏会抑制叶片的光合作用,适量增施钙[15]、镁肥[16]可提高柑橘果汁的维生素C、可滴定酸、可溶性固形物含量以及固酸比。此外,官雪芳等[4]研究表明土壤有机质与甜橙果实品质、还原糖、可溶性固形物呈显著线性正相关。本研究中,高品质冰糖橙根围土壤中的有机质、全磷、全钾、交换型钙镁含量显著高于普通冰糖橙根围土壤(表1),与前人对橙子树根围土壤的研究结论一致,说明土壤养分会影响冰糖橙的品质。此外,PLS-PM分析结果也验证了这一推测,土壤化学性质、土壤微量元素含量、微生物群落结构等因素中,对橙果实品质影响较大的是土壤化学性质(主要是TK、TN和OM)和微量元素(主要是EMg),细菌和真菌群落结构对橙果实品质的影响相对较小(图5)。由此推测,通过合理施肥维持土壤养分及有机质含量水平,并及时调节微量元素使其处于合理水平是橙园土壤管理的关键。
3.2 土壤微生物及其与橙果实品质的关系
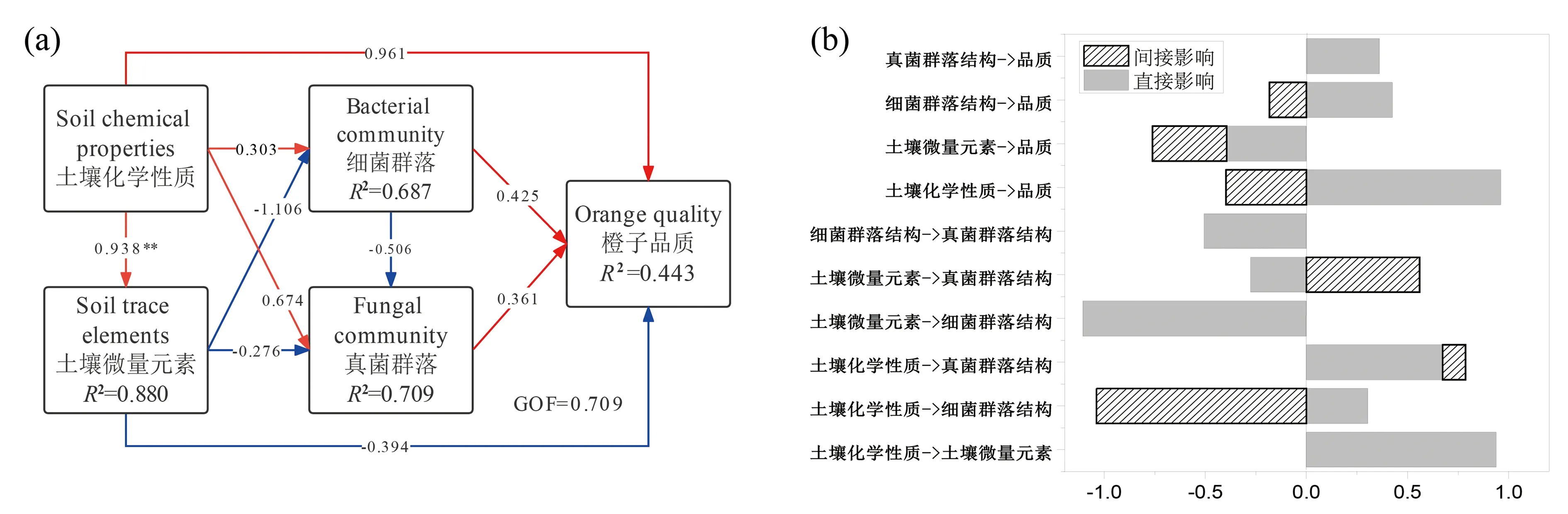
注:偏最小二乘路径建模(PLS-PM)分析了主要土壤化学性质、主要微量元素、微生物群落结构影响橙子品质的路径、直接影响系数,及直接影响和间接影响的标准化总效应。主要土壤化学性质(pH、OM、TN、TP、TK、RAK)和主要微量元素(ECa、EMg、ACu、AZn)通过PLS-PM分析筛选得出,微生物群落结构为细菌和真菌PCoA的第一轴。路径系数(即直接效应)用箭头表示,**表示路径系数达到显著(P<0.01),带有正负系数的箭头分别用红色和蓝色表示,R2值表示由内部模型不同因变量解释的方差,GOF表示 模型拟合优度指标。Note: Partial Least Squares Path Modeling (PLS-PM) analyzes the path of the main soil chemical properties, main trace elements, microbial community structure affecting orange quality, the direct impact coefficient, and the standardized total effect of the direct and indirect effects. The main soil chemical properties (pH, OM, TN, TP, TK, RAK) and the main trace elements (ECa, EMg, ACu, AZn) are selected through PLS-PM analysis, and microbial community structure are the first PCoA axis of bacterial and fungal communities. Path coefficients (i.e., direct effects) are displayed on arrows, and ** means that the path coefficient reaches significant (P < 0.01). Arrows with positive and negative coefficients are shown in red and blue, respectively. R2values represent the variance of dependent variables explained by the inner modal. GOF denotes the goodness of fit index.图5 偏最小二乘路径建模分析Fig.5 Partial least-squares path modelling (PLS-PM)
本研究中,两种品质的冰糖橙根围土壤中,细菌和真菌群落结构和多样性无显著差异(图1、2)。土壤微生物群落结构和多样性受多种因素影响,外因包括气候条件、植被类型、土壤类型和人类活动等,内因主要是与土壤微生物生长密切相关的土壤性质及养分含量等化学因素[17]。本研究中,两种品质的橙果实根围土壤类型、农事管理、所处地理位置以及橙品种及其种植年限均相同,可能对其产生影响的只有土壤内部因素,即土壤化学性质。虽然已有研究表明土壤化学性质会对土壤微生物群落产生影响,例如长期施用粪肥可通过改变土壤环境(如pH值)来影响土壤微生物群落结构[18],土壤有效磷、全磷含量和pH显著影响了土壤微生物的物种多样性[19]。但这种影响会因地域气候差异、土壤类型差异以及农事管理的不同而不同,如Wang等[20]发现水稻和小麦根际土壤在不同施肥条件和作物的不同发育时期,土壤化学性质发生了明显改变,使得根际土壤微生物群落结构也发生明显改变,但是多样性的总水平保持稳定;刘思等[21]发现葡萄枝条覆盖的土壤中,土壤pH值、有机质含量和速效磷含量可以显著影响优势群落的相对丰度;Ding等[22]研究表明土壤真菌群落主要受土壤速效磷和有机质含量的影响,其次是土壤pH值;而Han等[23]研究表明土壤氮是影响真菌群落的主要因素。虽然不同品质冰糖橙根围土壤中部分化学因子(如0~20 cm土层土壤中的有机质、全钾、交换性钙、交换性镁等)存在显著差异(表1),但因外部因素基本一致,土壤内部化学性质的差异不足以引起微生物多样性和群落结构发生显著改变。
土壤微生物不仅是土壤的重要组成部分,也是土壤养分循环的主要驱动力[24]。土壤微生物可提高土壤碱解氮、有效磷、速效钾、有机质等的含量,可促进植物对P、Zn、Cu等元素的吸收[5],但是这种促进作用并不一定以土壤微生物群落结构发生改变为前提。本研究中,虽然两种品质冰糖橙根围土壤微生物多样性和结构没有显著差异,但是部分细菌类群或真菌类群在高品质冰糖橙根围土壤中显著富集,如绿弯菌门(Chloroflexi)、蓝细菌门(Cyanobacteria)和纤线杆菌科(Ktedonobacteraceae)等细菌类群与丛赤壳科(Nectriaceae)、枝孢菌科(Cladosporiaceae)和葡萄穗霉科(Stachybotryaceae)等真菌类群(图3~4)。绿弯菌门包括光营养型和非光营养型,还可分为自养、异养和混合营养类群,在富营养条件下可以利用简单有机物进行光能异养生长,促进土壤C、N、S等元素循环,提高土壤中的养分含量[25]。纤线杆菌科是绿弯菌门中的一个分支,现已知的纤线杆菌(Ktedonobacteria)均为革兰氏阳性需氧菌[26]。研究表明纤线杆菌科(Ktedonobacteraceae)是秦岭油松根际土壤微生物群落的核心类群,可能在维持根际土壤细菌群落结构和功能方面发挥重要作用[27]。蓝细菌门中有许多类群具有固氮功能,可替代部分尿素减少氮的损失并维持水稻产量[28]。真菌丛赤壳科(Nectriaceae)中有许多类群是植物和人类病原体,但也有一些类群广泛用作生物降解剂和生物防治剂[29];枝孢菌科(Cladosporiaceae)能够在盐碱地土壤中维持较高的相对丰度,具有较强的养分和水分吸收能力[30];葡萄穗霉科(Stachybotryaceae)中多种类群是动植物的致病菌,然而,其中一些种属也可产生有益的次生代谢物质,具有很大的开发价值[31]。上述被富集的细菌和真菌类群均具有一定的养分循环能力或产生次生代谢产物的能力,可能在土壤养分循环过程中发挥重要作用。
已有研究表明,土壤微生物与水果果实品质具有一定的相关性。如吴倩[32]发现湖南各产区橘园土壤细菌、真菌与树体营养以及果实品质呈显著正相关;官雪芳等[4]发现少数革兰氏阴性菌和好氧指示细菌的脂肪酸标记及生态指数与甜橙果实糖酸比、固酸比存在显著正相关关系;Chai等[33]发现苹果园土壤放线菌与其果实可滴定酸含量呈正相关;也有研究表明接种丛枝菌根真菌和根际促生菌可以增加草莓果实糖分、芳香化合物、营养元素的浓度[34]。土壤物理化学性质及根系分泌物可以影响土壤微生物群落,真菌和细菌群落共同在土壤物质的代谢、有机质的分解、养分的转化和循环、平衡土壤养分供应等过程中发挥作用,为植物生长提供营养物质,进而影响果实品质。本研究中,土壤真菌和细菌群落对橙子品质存在直接影响和间接影响(图5),这种影响可能是由于在各种理化因素的长期作用下,微生物群落形成了一种平衡且稳定的相互关系,它们共同在土壤物质循环过程中发挥作用。微生物是土壤中最活跃的组成,在维系陆地生态系统地上-地下相互作用,支撑陆地生态系统碳、氮元素循环的过程中发挥着不可替代的作用[35]。但如何通过平衡施肥,在供给植物营养的同时,调控土壤微生物发挥作用,使土壤-植物-微生物良性互作,促进植物生长,提高果实品质,还需要进一步深入研究。
4 结论
不同品质冰糖橙果园土壤化学性质存在显著差异,高品质冰糖橙根围土壤中的有机质、全磷、全钾、交换型钙镁含量显著高于普通冰糖橙。不同品质冰糖橙果园土壤细菌和真菌群落多样性和组成结构没有显著差异,但少数细菌和真菌类群的丰度发生了变化,其对冰糖品质的影响尚不明确。PLS-PM分析表明,对橙果实品质影响较大的是土壤化学性质(主要是TK、TN和OM)和土壤微量元素(主要是EMg),土壤中的细菌和真菌群落结构对橙子品质的影响相对较小。

