LncRNA XLOC_015132对山羊黑色素沉积的影响及其lncRNA-miRNA-mRNA轴的预测
付 琳 刘 丽 杨 恒 王高富 任航行 周 鹏董贤文 张 丽,*
(1 重庆市畜牧科学院/重庆市山羊工程技术研究中心,重庆 402460;2 重庆化工职业学院,重庆 401228; 3西南大学动物医学院,重庆 402460)
长链非编码RNA(long noncoding RNA,lncRNA)是大于200 nt的一种非编码RNA。根据lncRNA与其靶基因在染色体上的位置关系,可以将lncRNA分为5个亚类:正义、反义、双向、基因间和内含子lncRNA[1]。研究显示,lncRNA可以通过转录、后转录和翻译水平在多种癌症[2]、炎症[3]、纤维化[4]、血管生成[5]的发展和进程中发挥正向或反向的调控作用。黑色素瘤是一种常见的皮肤恶性肿瘤,目前对黑色素相关lncRNA功能的研究,大多来源于黑色素瘤及其细胞系,在恶性黑色素瘤中,lncRNA可通过多种机制发挥作用,其可能通过调控相关信号分子诱导上皮间质转化、激活或抑制关键蛋白活性改变细胞外基质性能、或激活PI3K/AKT、Wnt/β-catenin、MAPK等信号通路活性,促进黑色素瘤的侵袭和转移[6]。
LncRNAXLOC_015132是与色素调控密切相关的重要lncRNAs,其在不同肤色山羊皮肤组织间存在显著差异表达,与其同时被鉴定到的还有呈现高度组织特异性和功能特异性的LncRNAXLOC_15448、HOTAIR等[7]。研究发现,LncRNAXLOC_15448可能通过XLOC_15448/miR-182-5p/MITF轴参与酉州乌羊皮肤黑色素细胞的生长及黑色素的沉积[8],HOTAIR可能通过与HOXD10互作调控山羊皮肤黑色素细胞的分化与黑色素生成[9]。LncRNA可通过互作分子调控黑色素的沉积。Wei等[10]对黑色素瘤和皮肤痣的对比发现,UCA1能够负调控抑癌基因miR-507,miR-507基因同时抑制叉头盒M1(forkhead-boxM1,FOXM1)基因转录表达,推断UCA1通过miR-507-FOXM1轴促进恶性黑色素瘤的生长和转移。Ding等[11]研究发现,NEAT1海绵化miR-23a-3p能够调节靶蛋白Krueppel样因子3(krueppel-like factor 3,LF3)的表达;KLF3又被证明与多种肿瘤相关,推测NEAT1可能通过miR-23a-3p/KLF3 轴促进恶性黑色素瘤增殖、迁移和侵袭,表明lncRNA-miRNA-mRNA轴在黑色素瘤的增殖、生长和转移中起到关键作用。但LncRNAXLOC_015132与色素沉积间的分子调控关系还鲜有报道。
酉州乌羊是迄今人们发现的唯一一种全身乌皮,眼、鼻、嘴、肛门、阴门等处可视黏膜也为乌色表型的山羊,是研究人类皮肤、黏膜黑变病的理想医学模型[12]。本研究以酉州乌羊为试验对象,酉州本地白山羊作为对照,研究LncRNAXLOC_015132基因在不同肤色上样组织中的表达特性,并选取B16-F10小鼠黑色素瘤细胞作为细胞水平验证对象,研究LncRNAXLOC_015132在黑色素瘤细胞增殖阶段的表达情况,旨在通过对LncRNA XLOC_015132互作分子的预测,以及其靶基因功能的生物信息学分析,初步对LncRNA XLOC_015132调控黑色素沉积的功能探索提供理论依据。
1 材料与方法
1.1 试验材料
选择重庆市酉阳土家族苗族自治县酉州乌羊国家级保种场中,饲养条件和日粮结构一致,年龄相近(3~4周岁)、体重20~25 kg的酉州乌羊及本地白山羊各3只,采集心脏、肝脏、脾脏、肺、肾脏、大脑、背黑线处皮肤、腿肌等组织。将采集后的组织统一编号,经液氮处理后,于-80℃条件下长期保存。同时,因原代山羊黑色素瘤细胞未培养成功,本研究选取B16-F10小鼠黑色素瘤细胞作为细胞水平验证对象,验证LncRNAXLOC_015132在黑色素瘤细胞增殖阶段的表达情况,B16-F10小鼠黑色素瘤细胞来源于重庆市山羊工程技术研究中心。黑色素瘤细胞增殖培养基使用RPMI1640培养基,购自北京gibco公司;胎牛血清购自新西兰HyClone公司。
1.2 引物设计与合成
根据前期转录组测序得到LncRNA XLOC_015132序列,其全长为1 158 bp[7]。通过同源序列检索,LncRNA XLOC_015132序列位于山羊基因组第25号染色体(NC_030832.1)rs3666465~rs3667620位置。搜索NCBI 中已经公布的山羊和小鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的相应序列,使用软件Prime 5.0设计引物(表1),用于实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)试验。引物由上海生工合成。
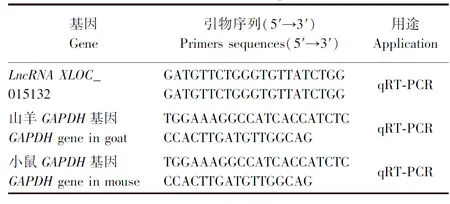
表1 引物序列Table 1 Primer sequence
1.3 B16-F10黑色素细胞培养
将小鼠皮肤黑色素瘤细胞系B16-F10,用含10%胎牛血清的RPMI1640培养基进行细胞复苏,以T25细胞培养瓶进行培养,观察细胞的生长状况并拍照,待细胞融合度达80%左右,使用0.25%胰酶消化后,离心收集细胞,以1.0×105个·mL-1的浓度铺板于六孔板中,每个板3个重复,置于5% CO2、37℃的培养箱中培养,隔天换一次培养基,观察细胞生长状况,于1、3、5和7 d各取一板细胞用于提取RNA。
1.4 RNA的提取与反转录
利用RHAiso Plus(TaKaRa,大连)提取各个样本总RNA,使用D2000r超微量分光光度计 (赛默飞世尔科技, 美国)检测总RNA的浓度与纯度,用2%琼脂糖凝胶电泳检测完整性。使用LnRcute LncRNA cDNA第一链合成试剂盒PrimeScript RT reagent Kit with gDNA Eraser (TaKaRa,大连), 将RNA反转录成cDNA,并置于-20℃冰箱保存。
1.5 实时荧光定量PCR(qRT-PCR)
按照SYBR Premix Ex Taq荧光定量检测试剂盒(TaKaRa,大连)说明书,进行目的基因的qRT-PCR试验。qRT-PCR反应体系为20 μL:模板cDNA 2 μL(25 ng·μL-1)、2 × SYBR Premix Ex Taq(Tli RNaseH Plus)10 μL、ROX Reference Dye Ⅱ 0.4 μL、上下游引物各0.4 μL(10 μmol·L-1)、RNase ddH2O 6.8 μL。反应程序:95℃预变性30 s;95℃变性5 s,60℃延伸35 s,40个循环。
1.6 生物信息学分析
利用NCBI(https://www.ncbi.nlm.nih.gov/)和 miRBase(http://www.mirbase.org/)查询靶基因和miRNA序列以及lncRNA靶miRNA预测。使用在线网站TargetScan 7.2 (http://bibiserv. techfak. unibielefeld. de/rnahybrid/)、miRWalk(http://mirwalk.umm.uni-heidelberg.de/)和miRBase用于miR-150-5p靶基因预测分析,取三者预测基因的交集,利用DAVID (https://david.ncifcrf.gov/)资源数据库进行GO注释分类和富集分析,利用KEGG Pathway进行基于信号通络富集分析。
1.7 数据统计与分析
采用2-△△Ct方法对qRT-PCR结果进行处理,应用统计软件SPSS 22进行方差分析和显著性t检验,组内比较使用多重比较,不同小写字母表示差异具有统计学意义(P<0.05)。
2 结果与分析
2.1 LncRNA XLOC_015132基因组织表达谱情况
以心脏组织为对照,对酉州乌羊和本地白山羊各组织进行LncRNAXLOC_015132基因的qRT-PCR试验,结果显示,LncRNAXLOC_015132在本地白山羊(图1-A)和酉州乌羊(图1-B)不同体组织中均有不同程度的表达。

注:A:本地白山羊; B:酉州乌羊。不同小写字母表示差异显著(P<0.05)。下同。Note: A: Youzhou white goat. B: Youzhou dark goat. Different lowercase letters showed significant difference (P<0.05).The same as following.图1 本地白山羊和酉州乌羊不同组织LncRNA XLOC_015132的相对表达量Fig.1 The relative expression of LncRNA XLOC_015132 mRNA in tissues of Youzhou white goat and Youzhou dark goat
LncRNAXLOC_015132基因在本地白山羊组织中的表达量由高到低依次为心脏、肌肉、肺、大脑、肝脏、皮肤、肾脏、脾脏组织。LncRNAXLOC_015132基因在心脏和肌肉中的表达量显著高于其他组织,在肺中的表达量显著高于脾脏、肾脏和皮肤组织,在大脑和肝脏组织中的表达量显著高于脾脏组织,在脾脏、肾脏和皮肤组织中的表达量差异不显著。
LncRNAXLOC_015132基因在酉州乌羊心脏中的表达量最高,其次为肺、肌肉、大脑、皮肤、肾脏、肝脏、脾脏组织。LncRNAXLOC_015132基因在心脏中的表达量显著高于其他组织,在肺中的表达量显著高于除肌肉外的其他组织,在肌肉、大脑、皮肤、肾脏中的表达量显著高于脾脏组织,在肾脏、皮肤和肝脏组织中的表达量差异不显著。
2.2 LncRNA XLOC_015132在成年酉州乌羊和本地白山羊相同组织的表达量比较
对LncRNAXLOC_015132基因在酉州乌羊和本地白山羊同一组织的表达情况进行比较,以本地白山羊各组织作为对照,结果如图2所示。LncRNAXLOC_015132基因在酉州乌羊脾脏、肺、肾脏、大脑、皮肤组织中的表达量显著高于本地白山羊,其余组织中的表达量差异不显著,其中LncRNAXLOC_015132基因在酉州乌羊和本地白山羊皮肤中的表达量丰度差异最大。
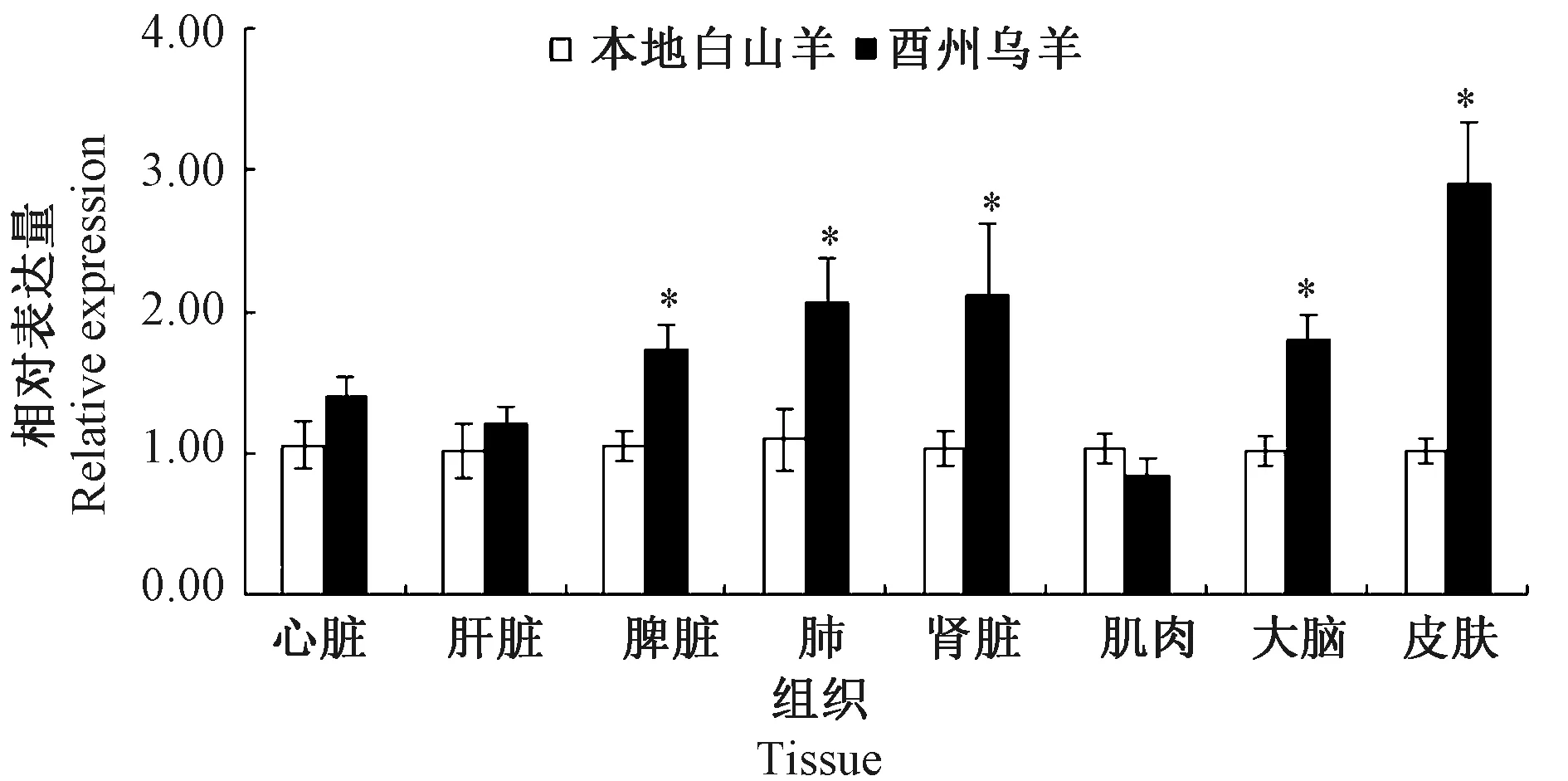
注:内参基因:山羊甘油醛-3-磷酸脱氢酶基因(GAPDH)。*表示与本地白山羊组织相比差异显著(P<0.05)。Note: Reference gene: Glyceraldehyde-3-phosphate of goat(GAPDH). *indicate significant difference compared with Youzhou white goat at 0.05 lvel.图2 本地白山羊和酉州乌羊同一组织LncRNA XLOC_015132的相对表达量Fig.2 The relative expression of LncRNA XLOC_015132 mRNA in the same tissue of Youzhou white goat and Youzhou dark goat
2.3 LncRNA XLOC_015132小鼠B16-F10黑色素细胞增殖阶段的相对表达情况
应用qRT-PCR检测小鼠B16-F10黑色素细胞在增殖介质中培养1、3、5和7 d时LncRNAXLOC_015132基因的表达,用小鼠GAPDH内参基因的表达量进行校正。结果发现,LncRNAXLOC_015132的表达量随着B16-F10黑色素细胞培养时间的延长而逐渐增长(图3),暗示LncRNAXLOC_015132的递增表达可能与B16-F10黑色素细胞的增殖相关。
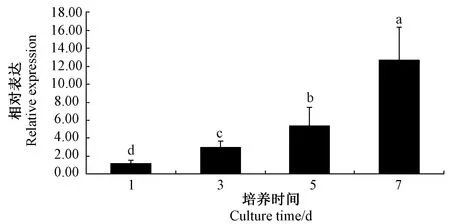
注:内参基因:小鼠甘油醛-3-磷酸脱氢酶基因(GAPDH)。Note: Reference gene: Glyceraldehyde-3-phosphate of mouse(GAPDH).图3 LncRNA XLOC_015132在B16-F10细胞增殖阶段的相对表达量Fig.3 Relative expression of LncRNA XLOC_015132 in the proliferation phase of B16-F10 cells
2.4 LncRNA XLOC_015132在黑色素瘤致病过程中互作分子的预测
2.4.1LncRNAXLOC_015132靶miRNA预测 运用miRBase在线软件预测得到与LncRNAXLOC_015132结合的miRNA家族共16个,包括miR-6089、miR-4131-3p、miR-1587、miR2644、miR-3262、miR-3260-5p、miR-1285、miR-306/306-5p、miR-150/150-5p、miR319d/319h、miR-12301-5p、miR-12308b-3p、miR-1630、miR-2196、miR399a、miR3 627d,其中LncRNAXLOC_015132与多个物种的miR-150/150-5p有结合位点,如表2所示。

表2 LncRNA XLOC_015132靶miRNA统计Table 2 Statistics of target miRNA gene of LncRNA XLOC_015132
多篇文献报道,miR-150-5p可作为黑色素瘤增殖、侵袭、转移、诊断和预后的生物标志物[13-17]。结合2.2结果,将miR-150-5p作为LncRNAXLOC_015132的重要候选互作序列,进行LncRNA-miRNA-mRNA轴的预测分析,探究LncRNAXLOC_015132基因的调控作用。
2.4.2 miRNA预测靶基因预测和分析 利用miRBase在线数据库查找miR-150-5p序列,对比发现人、小鼠、大鼠等物种的miR-150-5p成熟体序列“U U U G G C A A U G G U A G A A C U C A C A CU”在各物种之间高度保守。利用TargetScan 7.2、miRWalk和miRBase预测鼠miR-150-5p的潜在靶基因,选取靶基因的交集基因作为候选miRNAs的靶标基因。结果发现,3种软件共同存在的miR-150-5p的靶基因数为46个(图4和表3),这些基因被用于后续GO注释条目和KEGG通路富集分析。
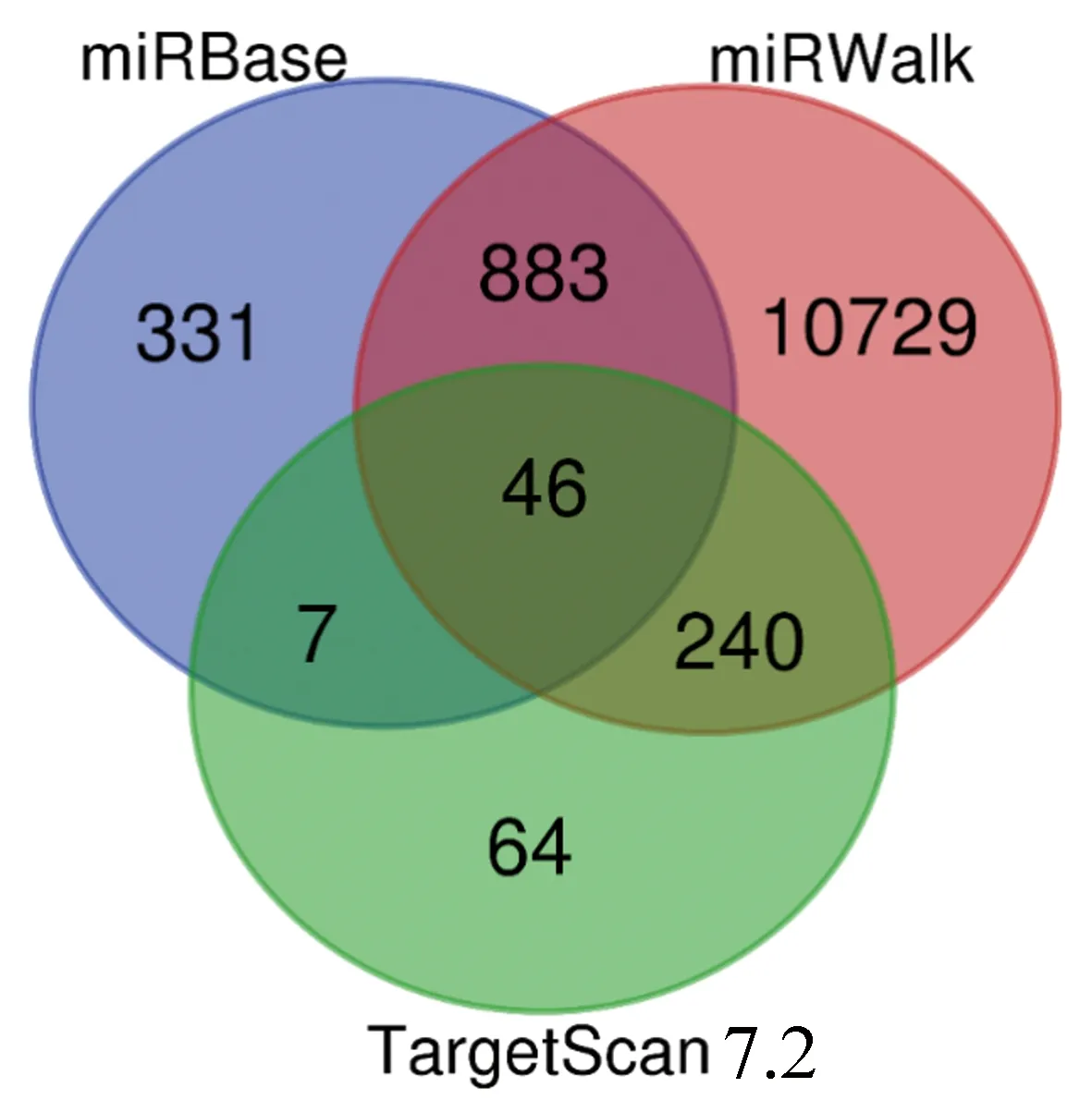
图4 miR-150-5p靶基因交集预测Fig.4 The intersection prediction of miR-150-5p target genes
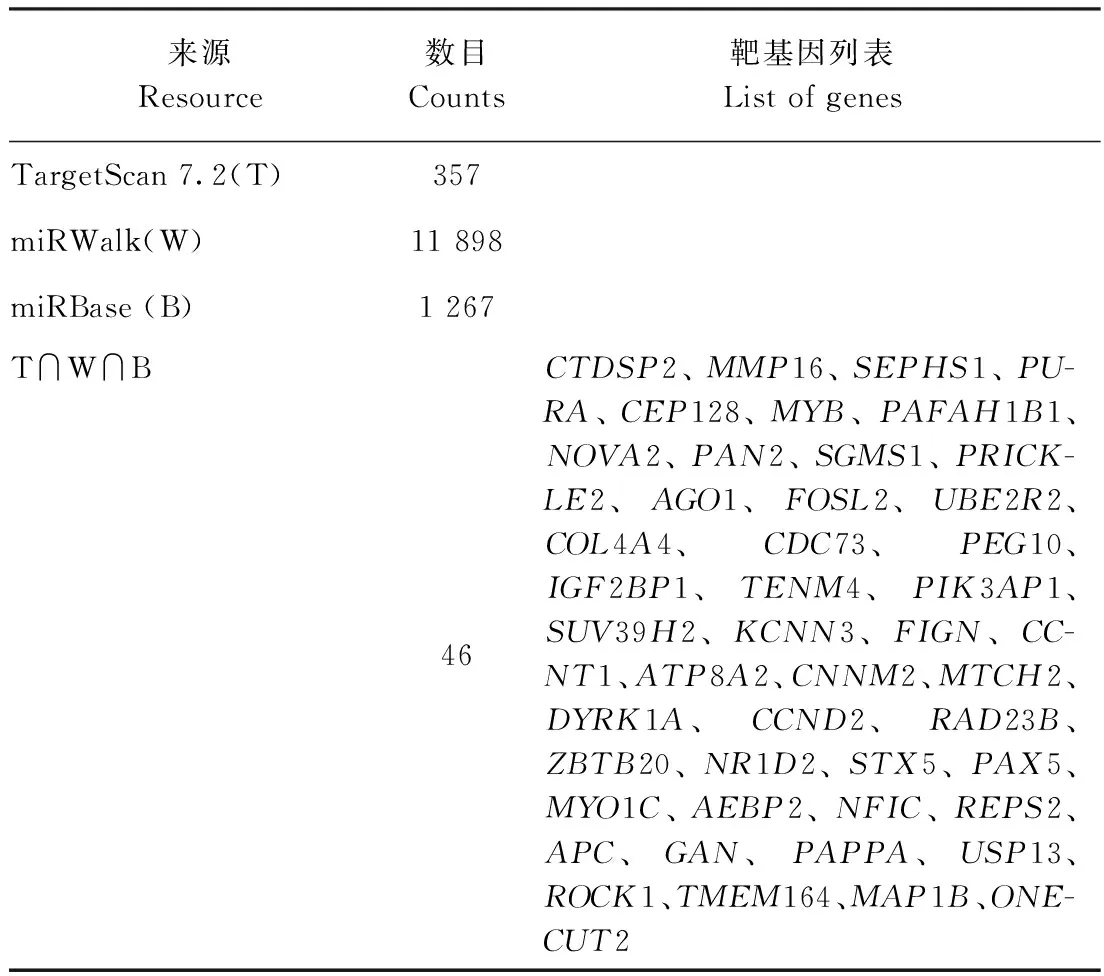
表3 mus-miR-150-5p的靶基因预测统计Table 3 Statistics of target gene of miR-182-5p
2.4.3 靶基因GO富集分析及代谢通路分析 对上述获得的46个靶基因集合进行分子功能、生物学过程、细胞组成层面的注释分类和富集分析,如图5所示。靶标基因GO富集显示涉及大量的生物学调控过程,如对生物过程的调控、信号、定位、细胞增殖、免疫以及色素沉积等;分子功能主要富集在结合、催化活性、转录和翻译调节等;细胞组成主要富集在细胞、细胞器、胞外区、膜等。
同时,对上述基因的KEGG信号通路富集分析和KEGG通路网络分析(图6、图7),结果发现大量癌症候选靶标基因在Wnt、PI3K-AKT、Hippo、Hedgehog信号通路等显著富集,如重组人细胞周期蛋白D2(G1/S-specific cyclin-D2,CCND2)(图7),在通路网络中起到关键作用。
3 讨论
近年来,lncRNAs因在致癌和癌症进展中起到的重要作用而被广泛关注,目前已在数百种肿瘤中发现了lncRNAs的异常表达。皮肤作为人体重要屏障、分泌和免疫的最外层器官,其恶性黑色素瘤的发病率和病死率不断上升[8]。近年来已发现多种黑色素候选lncRNA,如lncRNA HOX转录反义RNA(HOX transcript antisense RNA,HOTAIR)[18]、H19[19]、黑素瘤高表达非编码RNA(melanoma highly expressed non-coding RNA,MHENCR)[20]等都被报道在恶性黑色素瘤组织中表达增加或缺失,参与恶性黑色素瘤侵袭与转移途径。本研究中,LncRNAXLOC_015132在酉州乌羊和本地白山羊组织中广泛表达,其在酉州乌羊皮肤组织的表达量显著高于本地白山羊,此结果与Ren等[7]的研究一致。LncRNAXLOC_015132基因随小鼠B16-F10黑色素细胞的培养时间延长而表达量逐渐增长,也暗示了LncRNAXLOC_015132可能参与黑色素瘤细胞的增殖。本研究中LncRNAXLOC_015132的表达模式还与山羊黑色素沉积候选lncRNA,如LncRNAXLOC_15448和LncRNAHOTAIR基因在酉州乌羊皮肤组织中的表达特征一致,LncRNAXLOC_15448通过参与黑色素细胞的增殖调控黑色素的沉积过程[8],LncRNAHOTAIR基因通过调控黑色素细胞的分化参与黑色素的沉积[9]。因此,本研究推测LncRNAXLOC_015132可能通过正向调控黑色素细胞的增殖调控山羊皮肤黑色素的沉积过程。
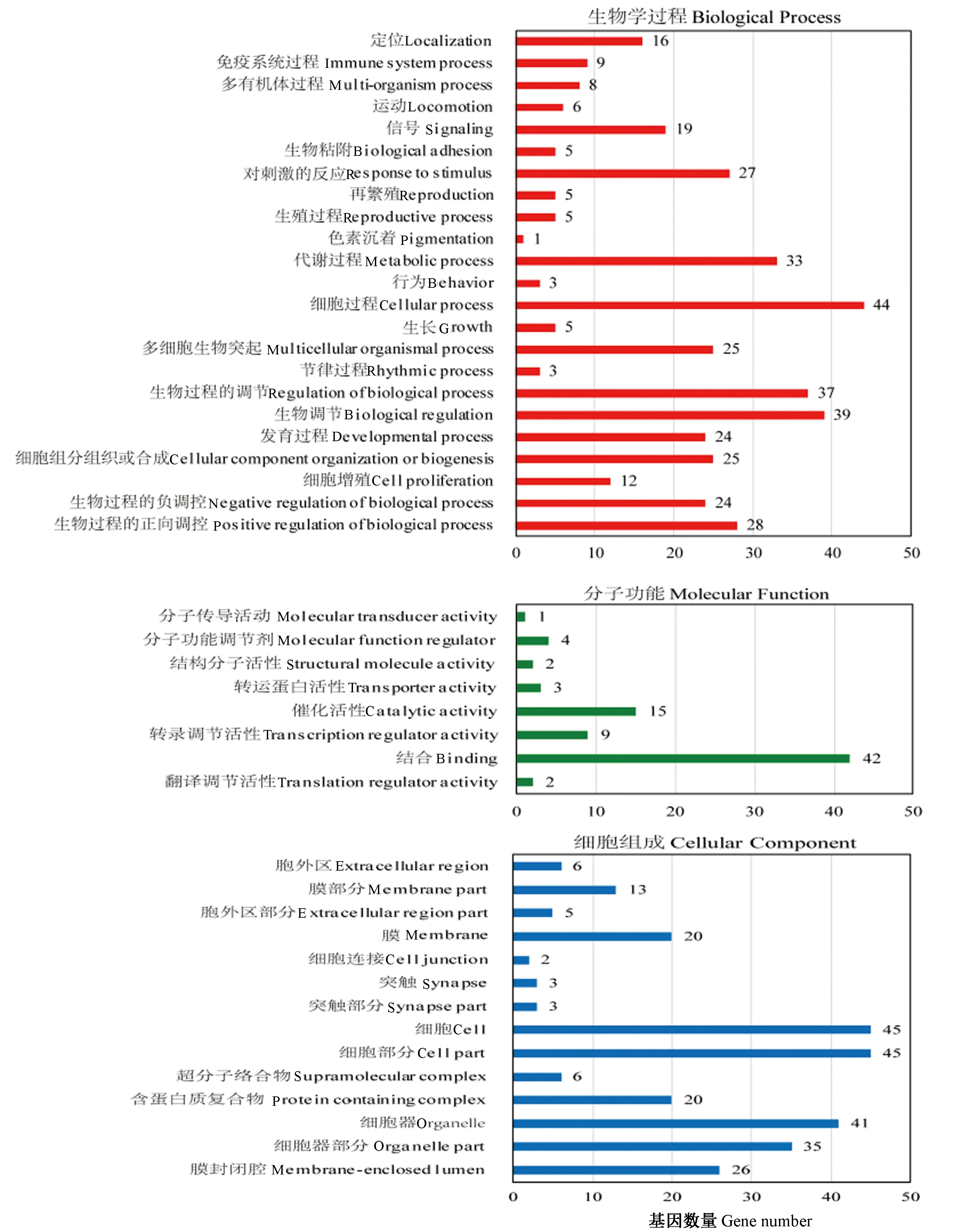
图5 miR-150-5p靶基因GO富集分析Fig.5 GO enrichment analysis results of miR-150-5p target genes
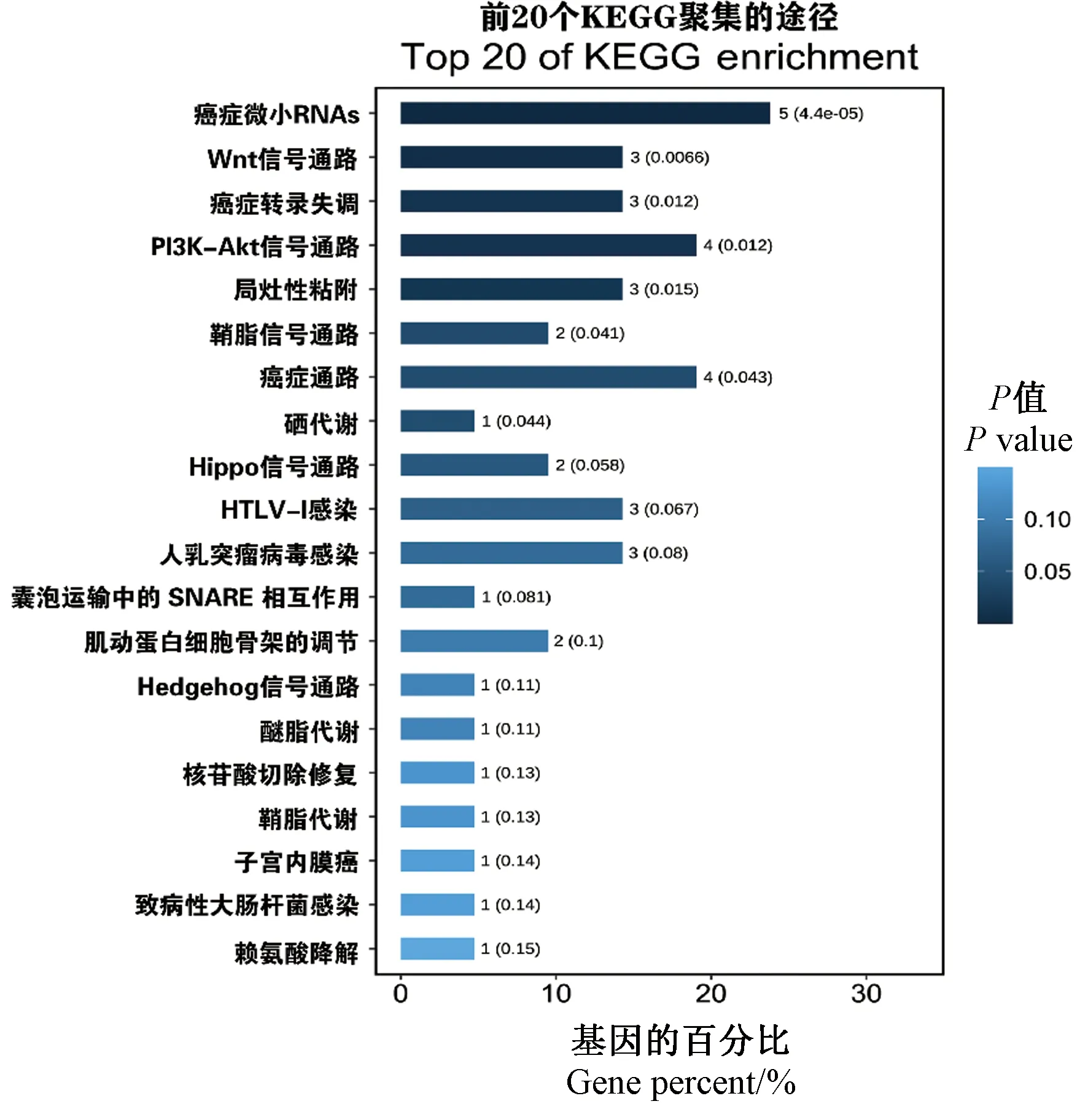
图6 miR-150-5p靶基因KEGG通路富集分析Fig.6 KEGG Pathway enrichment results of miR-150-5p target genes
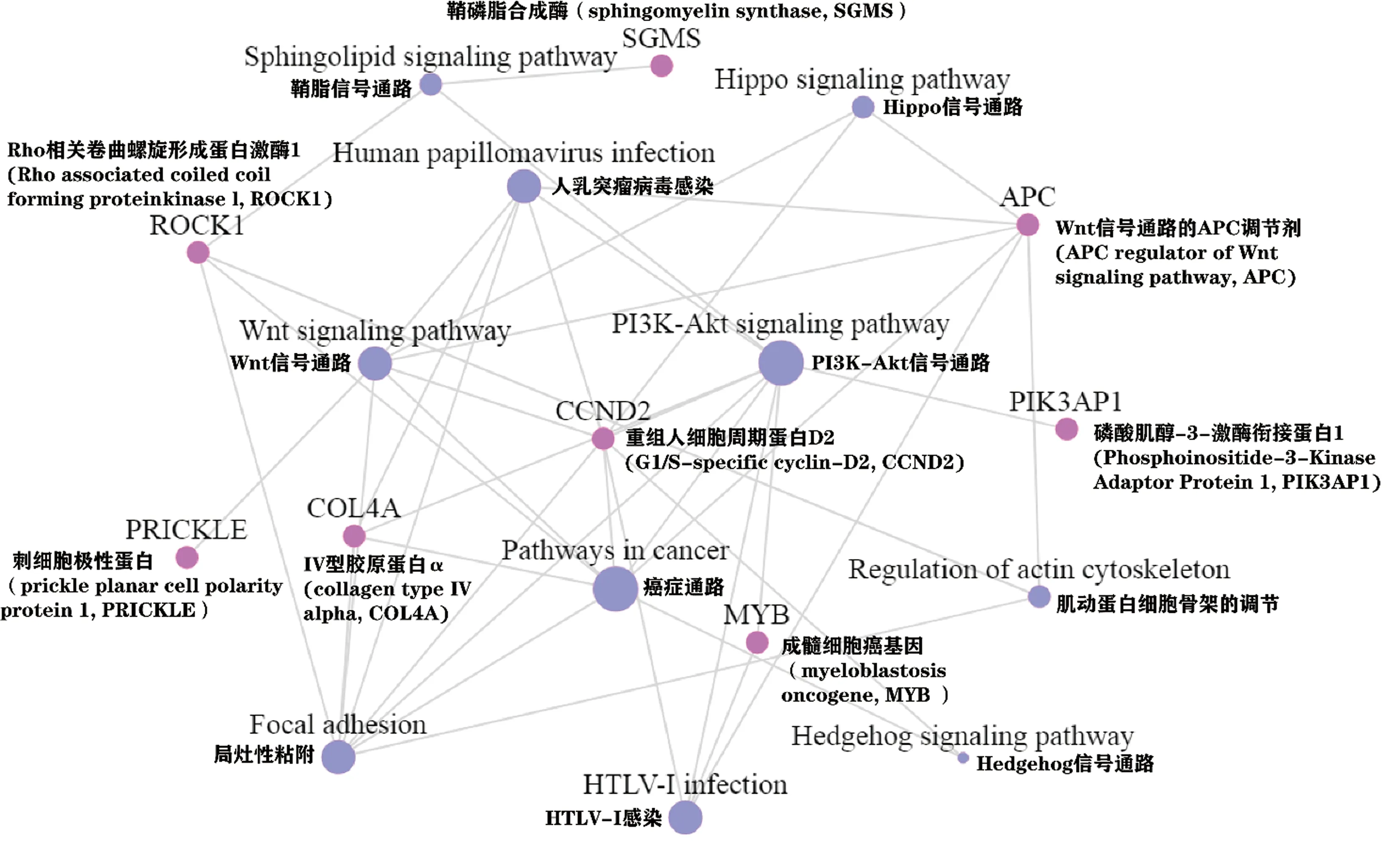
注:玫瑰红色圆圈代表信号通路,紫色圆圈代表靶基因,圆圈的大小代表通路靶基因的数量,Note: Rose red circle represent signal pathways, purple circle represen target genes, the size of the circle represent the number of genes in the pathway target图7 mus-miR-150-5p靶基因KEGG通路网络分析Fig.7 KEGG Pathway enrichment results of mus-miR-150-5p target genes
本研究中,miR-150-5p作为LncRNAXLOC_015132的靶标分子,与黑色素瘤的增殖、侵袭、转移、诊断息息相关。在黑色素瘤中,miR-150通过下调转录因子成髓细胞癌基因(v-myb avian myeloblastosis viral oncogene homolog,MYB)抑制黑色素瘤细胞的增殖、迁移和侵袭[21]。miR-150-5p通过直接靶向黑色素瘤细胞中SIX1抑制细胞的增殖、迁移和侵袭[22]。miR-150-5p不仅是皮肤黑色素瘤转移相关的潜在生物标志物,而且与肿瘤细胞存活的时间有关[23]。因此,miR-150-5p作为LncRNAXLOC_015132的靶标分子可能参与抑制靶基因的表达或调控细胞存活时间进而影响黑色素的沉积。miR-150-5p靶基因的GO分析显示,其主要在细胞、细胞器、胞外区发挥结合、催化活性、转录和翻译调控等分子功能,参与生物调节、细胞增殖及色素沉积等生物学进程的调控。而CCND2作为本研究中miR-150-5p的靶基因,能够被miR-182和转录因子NF-kB下调从而参与黑色素瘤细胞的增殖、侵袭和转移[24-25]。因此,LncRNAXLOC_015132的互作分子miR-150-5p可能通过抑制CCND2下调参与黑色素瘤细胞的增殖过程,调控皮肤黑色素的沉积。研究发现,lncRNAs和miRNAs可以通过多种靶位参与肿瘤的发生过程,其作用方式如lncRNAs作为miRNA海绵/诱饵分子;lncRNAs和miRNAs相互促进;lncRNA和miRNA相互抑制;miRNA作为lncRNA的负调节剂等。如Liang等[26]发现lncRNA-ZFAS1对黑色素瘤有促肿瘤作用,并且ZFAS1/miR-150-5p/RAB9A轴能够调控黑色素瘤细胞的增殖、凋亡、迁移和侵袭。LncRNA-MEG3通过调节miR-21/E-cadherin轴促进黑色素瘤的生长、转移和形成[27]。结合本研究生物信息学分析结果及前人研究报道,推测LncRNAXLOC_015132/miR-150-5p/CCND2轴可能在黑色素沉积过程中发挥重要的调控作用,但LncRNAXLOC_015132作用于miR-150-5p/CCND2的方式还需要进一步研究。
本研究KEGG富集分析显示,LncRNAXLOC_015132/miR-150-5p的靶基因,如CCND2,在PI3K-AKT、Wnt等信号通路中起到关键枢纽作用。PI3K/AKT通路的异常激活与细胞增殖、存活、迁移、侵袭、转移和肿瘤生长显著相关[28]。Wnt通路的失调影响包括癌症在内的各种疾病发生[29]。前人研究发现,少数lncRNAs通过直接或间接的方式促进PI3K-AKT、Wnt信号通路活性来发挥其功能[30-31]。LncRNAFER1L4通过促进抑癌基因PTEN(gene of phosphate and tension homology deleted on chromsome ten)表达来抑制蛋白激酶B(protein Kinase B,AKT)活性[32]。LncRNABC087858通过上调转录因子ZEB1(Zinc-finger E-box binding homeobox 1,ZEB1)和Snail(Zinc-finger transcriptional factor snail,Snail)参与PI3K/AKT信号通路和上皮间质转化[33]。miR-34a-5p与LncRNAC2dat1负相关,通过抑制沉默调节蛋白1(silent mating type information regulation 2 homolog 1,Sirt1)使p38/ERK/AKT和Wnt信号通路失活[34]。LncRNAMEG3作为内源性海绵分子与miR-127结合调控靶基因ZEB1,促使骨肉瘤细胞的生长和转移,其中miR-127和ZEB1都参与激活JNK和Wnt信号通路[35]。因此,LncRNAXLOC_015132的靶分子miR-150-5p也可能通过靶基因CCND2调控PI3K-AKT、Wnt等信号通路,促进黑色素瘤细胞增殖,但具体机制还有待进一步研究。
4 结论
本研究发现LncRNAXLOC_015132在山羊各组织中广泛表达,其在酉州乌羊皮肤中的表达显著高于本地白山羊;在小鼠B16-F10黑色素瘤细胞中,LncRNAXLOC_015132的表达量随着黑色素细胞的增殖呈递增趋势,结果显示LncRNAXLOC_015132可能与黑色素沉积存在正相关关系。对LncRNAXLOC_015132靶标分子的生物信息学分析显示,LncRNA XLOC_015132/miR-150-5p/CCND2轴可能在黑色素沉积中发挥重要作用,其机制可能是LncRNAXLOC_015132通过miR-150-5p/CCND2激活PI3K-AKT、Wnt等信号通路,促进黑色素细胞的增殖,调控黑色素的沉积过程。

