荧光示踪及斜向组织切片展示小鼠内侧缰核-脚间核神经环路投射
马梦欣 常 欣 李 燊 吴 燕 吴海涛 刘 磊
(1.首都医科大学基础医学院神经生物学系,北京100069;2.军事科学院军事医学研究院 军事认知与脑科学研究所 军事认知与应激医学研究室,北京 100850)
内侧缰核(medial habenular nucleus,MHb)至脚间核(interpeduncular nucleus,IPN)神经环路与脑内众多神经环路一样,在调控大脑生理功能方面发挥重要作用。以往研究[1]显示,缰核损伤的大鼠在莫里斯水迷宫(空间学习和记忆的一项测试)中比对照组大鼠游得更快,缰核损伤的大鼠可能对压力反应较为敏感,并且被损伤的大鼠只有在足部电击的强度较高(高应激)状态下,才表现出主动回避学习受损,而此大鼠在低压力条件下,回避学习行为却不受影响,这表明缰核损伤的大鼠对应激诱导的学习障碍更敏感。同样,对后屈束(fasciculus retroflexus,Fr)连接组织造成损伤,则会导致大鼠血浆皮质酮浓度的慢性升高[2]。综上所述,MHb-IPN神经环路的主要功能是调节动物在应激状态下的学习和决策能力。另外,一些使用大鼠、小鼠和斑马鱼进行MHb损伤相关的研究[3]结果显示,MHb-IPN通路在调节空间学习和记忆、恐惧获得、被动和主动回避学习以及焦虑方面具有重要作用。
缰核(habenula nucleus,Hb)被第三脑室[4]前后、背侧和后方包围。Hb有两个明显的成对分裂,即内侧和外侧两部分。每个部分都有不同的神经纤维的传入和传出连接,包括彼此之间的相互连接[5]。两侧缰核对应亚区之间存在大量的纤维联系,形成缰连合。缰核是前脑与中脑及脑干信息传递的中继站,前脑的传入纤维主要经髓纹到达缰核,而缰核的传出纤维则主要经Fr投射至中脑和脑干,这为其参与不同的功能提供了环路基础[6]。MHb腹侧的投射性神经元主要为谷氨酸与乙酰胆碱共释放的神经元IPN的中间区域,背侧则主要为谷氨酸与 P 物质(substance P,SP)共释放的神经元,主要投射到脚间核周边区[7]。尽管许多研究使用了腺相关病毒的顺行和逆行追踪方法,但还未精准地确定以上两个脑区以及连接组织出现在同一水平面下所能呈现完整的环路投射的脑组织切割角度,本文通过对脑组织进行角度切割处理,利用小鼠脑组织切片,荧光成像方法进行系统的方法介绍,为MHb-IPN投射环路的结构分析和功能研究提供有力技术手段,具有一定的实用借鉴价值。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
8周龄野生型(wild type, WT)成年雄性C57BL/6小鼠以及8周龄ChAT-Cre;Ai9红色荧光报告小鼠均采购于北京斯贝福生物技术有限公司,获得审批的实验动物许可证号为SCXK(京)2019-0010。均饲养于军事医学研究院实验动物中心[SYXK(军)2017-0023],动物实验及相关操作获军事医学研究院实验动物伦理委员会批准(批准号:IACUC-DWZX-2020-668),符合医学实验动物管理实施细则。
1.1.2 主要实验仪器与设备
PCR 仪(德国Eppendorf公司),冰冻切片机(美国Thermo公司),常温台式离心机(德国Eppendorf公司),恒温水浴箱(北京长风仪器仪表公司),激光共聚焦显微镜(日本Olympus公司),立式高压蒸汽灭菌器(上海申安医疗器械厂),凝胶成像仪(美国Alphared公司),微量注射(中国瑞沃德公司),玻璃电极(美国Sutter公司),立体定位仪(中国瑞沃德公司)等。
1.1.3 主要实验试剂
4%(质量分数)多聚甲醛(中国索莱宝公司),75%(体积分数)乙醇(中国利尔康医疗公司),MgCl2、NaCl(中国国药集团公司),冰冻切片包埋剂(日本樱花公司),盖玻片(中国中衫金桥公司),含DAPI 封片剂(中国中衫金桥公司),戊巴比妥钠(中国国药集团公司),载玻片(中国中衫金桥公司),蔗糖(美国Thermo公司)等。
1.1.4 实验工具病毒信息表
所用腺病毒顺行示踪的含人突触蛋白元件的绿色增强荧光腺相关病毒(adeno-associated virus human synapsin enhanced green fluorescent protein,AAV-hSyn-EGFP),逆向示踪的绿色增强荧光重组腺相关病毒(recombinant adeno-associated virus2-retro-enhanced green fluorescent protein,rAAV2-retro-EGFP),详见表1。

表1 腺病毒列表Tab.1 Adenovirus list
1.2 实验方法
1.2.1 小鼠基因型鉴定
1)基因组制备:①基因提取: 消毒眼科剪刀快速剪下约0.5 mm 的鼠尾和脚趾,取下的组织样品放在 1.5 mL EP 管中,注意标记 EP 管上小鼠标号。②配制裂解液:蛋白酶 K(2 μL)+Mg2+缓冲液(10 μL)+H2O(88 μL),每个EP管内总体为 100 μL 体系,向放入组织并编好号的EP管中加入裂解液,离心机瞬时离心(确保样品置于裂解液中)。③ 56 ℃水浴锅裂解 5~6 h 或过夜。④取出后放入电磁炉 100 ℃煮沸样品 10 min。⑤放入离心机12 000 r/min,5 min后置于 4 ℃保存。⑥制备反应体系并放入PCR 仪中扩增。扩增条件为Ai9基因:94 ℃热变性2 min,然后94 ℃变性20 s,65 ℃复性15 s,68 ℃延伸15 s,共35个循环,最后72 ℃延伸2 min,8 ℃保温。ChAT基因:94 ℃热变性3 min,然后94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸30 s,共35个循环,最后72 ℃延伸2 min,8 ℃保温。
2)基因型鉴定:①制备琼脂糖凝胶:称质量2 g的 2%(质量分数)琼脂糖凝胶溶于 100 mL 1×TAE 后,置于锥形瓶中微波炉加热溶解后,稍作冷却加入10 μL Gel Red 核酸染料后混匀,进行插排梳、倒板,直至完全冷却,液体转为固体后拔梳。②上样:每排第一个孔上加入标记条带Marker 10 μL,后面依次加入扩增后的样本体系液。③电泳程序: 电压140 V,时间30 min。④紫外线下照胶,记录结果,并核对小鼠编号,选取符合条件的基因型小鼠,进行后续实验。
1.2.2 统计学随机分组方法
使用SPSS 13.0软件对入组对象进行编号,为了使上述分组结果具有重现性,在分组之前设定随机种子,然后通过生成一列随机数字并将其命为Random,利用Rv-Uniform函数在设定范围内生成一系列随机数字,最后根据随机数字大小进行排序分组,使用Visual Binning功能快速分组,命名为新划分的组别名称,即可得到随机分组结果。
1.2.3 实验小鼠分组
ChAT-Cre;Ai9荧光报告小鼠则根据基因鉴定结果依次选出5只,设为荧光报告小鼠组(A组);将10只WT小鼠采用1.2.2中的分组方法随机分配到B、C两组,给予不同的病毒注射,其中B为顺行病毒示踪组,C为逆行病毒示踪组,每组各5只。
1.2.4 重组腺相关病毒载体(adeno-associated virus,AAV)病毒注射前手术准备过程
1)动物手术前麻醉、备皮:①小鼠腹腔注射浓度为1%(质量分数)的戊巴比妥钠进行小鼠麻醉。②用单层剃须刀片刮掉小鼠头顶上的毛发。③将小鼠放在加热垫上,以保持稳定的体温(注:小鼠麻醉后不能调节体温,将其放在加热垫上可以避免手术过程中体温明显下降)。④在小鼠的眼睛上涂上红霉素软膏,以防止手术中眼部的干涩以及强光照射导致的不适。⑤使用70%(体积分数)乙醇对头部皮肤进行消毒。
2)动物固定以及病毒注射准备:①将小鼠的门牙固定在立体定向仪上适配器的前夹上,调整适配器的位置,使耳杆可以很容易地插入耳道,使头部较平稳地固定住(注:确保小鼠头部牢固地固定在适配器的前夹上)。②用手术刀做一个1.5 cm的前后切口。③用含0.9%(质量分数)氯化钠注射液(以下简称生理盐水)的无菌棉签轻轻擦拭以清洁头骨表面,确保前后囟点以及颅骨缝清晰可见。④将玻璃电极中注满矿物油,用热熔胶固定于10 μL的微量注射器上,并排出管内以及玻璃电极内所有气泡。将制好的微量注射器固定于微量注射泵上吸取适量病毒准备注射。
1.2.5 脑立体定位及病毒微量注射
1)脑立体定位与注射坐标:脑立体定位与注射坐标示意图详见图1A、B、C。
2)颅钻开颅:①将针尖移动到前囟点调平零点,作为三个轴的参照点,从这一点确定其他坐标。②通过前后囟点显示的高度,调整头部至水平。③根据小鼠脑图谱册定位至MHb坐标位点后利用颅骨钻进行直径0.5 mm的浅小孔(切勿钻入大脑,防止皮质损伤)(图1 D),同上操作,在IPN位点也进行钻孔(图1 E)。
3)AAV病毒微量注射方法:①随后将注射器插入到已钻好孔处MHb目标脑区(图1 F)、IPN目标脑区(图1G)进行病毒注射。②MHb病毒注射具体坐标为:小鼠脑背侧到腹侧(dorsal-ventral,DV):-2.50 mm、前端到后端(anterior-posterior,AP):-1.06-2.06 mm、内侧到外侧(medial-lateral,ML):0.25 mm(图1B);IPN具体坐标为:DV:-4.65 mm、AP:-3.45~-3.52 mm、ML:0.00 mm(图1C)。③顺行示踪病毒:AAV-hSyn-EGFP注射速度为8 nL/min,注射量为80 nL,逆行示踪病毒:rAAV-retro-EGFP注射速度为30 nL/min,注射量为300 nL。等待病毒注射完成后至少停针10 min后缓慢移出。④手术完成后缝合切口,等待小鼠苏醒,病毒注射完成后饲养3周后心脏灌流后取脑。
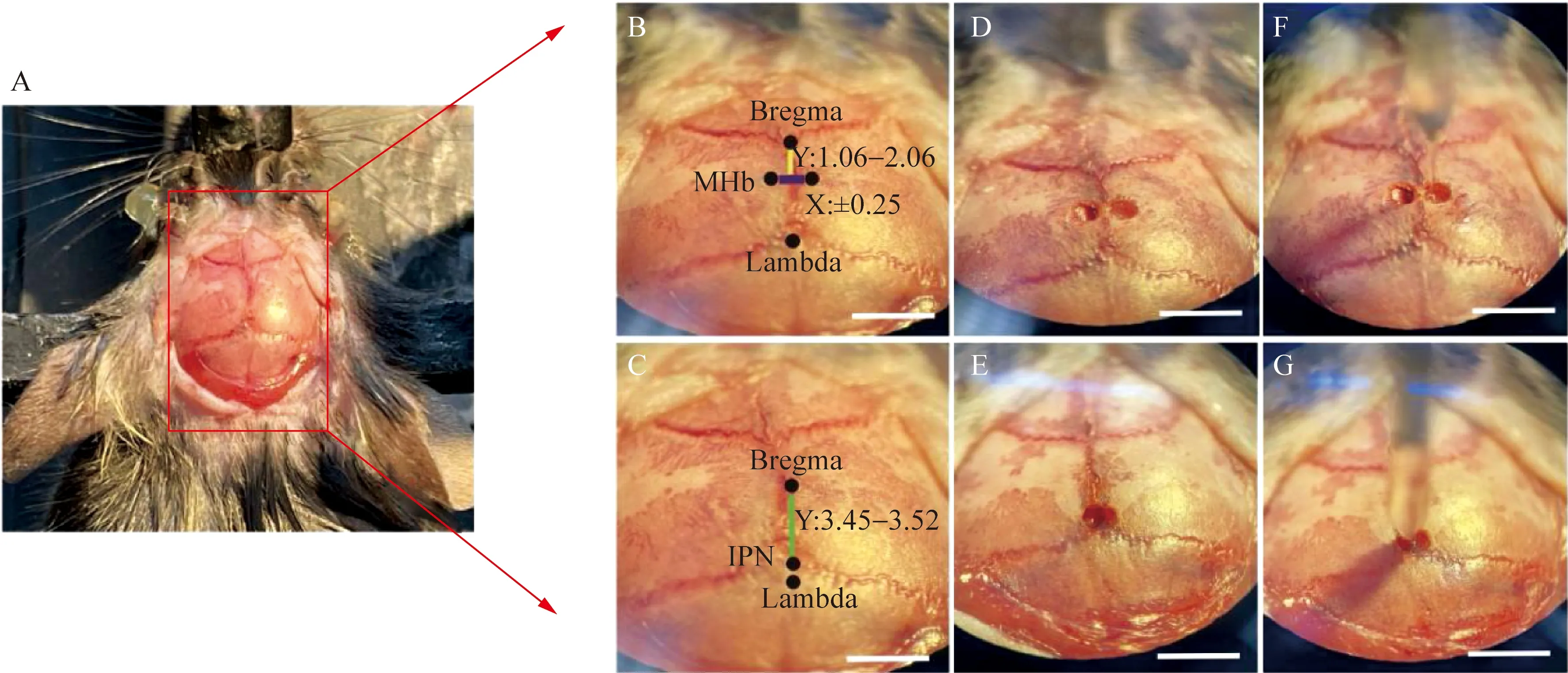
图1 立体定位注射腺病毒到成年小鼠内侧缰核和脚间核区域Fig.1 The virus was injected stereoscopically into the medial habenular nucleus and interpeduncular nucleus regions of adult mice
1.2.6 小鼠脑组织切片样本制备
1)小鼠脑组织灌流固定:①首先称小鼠体质量,按照体质量腹腔适量注射1%(质量分数)的戊巴比妥钠进行深度麻醉,等待小鼠深度麻醉后,小心剪开小鼠胸腔,充分暴露心脏。②分别用生理盐水和4%(质量分数)多聚甲醛从左心室缓慢灌流(在通风橱进行),出现肝脏完全变白,右心耳处无血液流出以及推入 4%(质量分数)多聚甲醛溶液致小鼠尾巴轻轻颤动,小鼠四肢僵硬状态后,即完成灌流过程。③随后将脑组织完整取出,放入4%(质量分数)多聚甲醛溶液中,于4 ℃冰箱中后固定24 h。
2)脑片制备步骤:①固定完成后,依次用15%(质量分数)和30%(质量分数)浓度的蔗糖溶液进行梯度脱水,直至脑组织样品沉入蔗糖溶液底部,约48 h。②取出脑组织后用滤纸仔细吸干表面的蔗糖溶液.首先将脑组织两侧部分组织平行切割,两侧厚度约0.1 mm,保证整体组织的矢状面放置在平面时较为稳定,方便切割操作(图2A,B)。③将其以矢状呈现面放置在已制作好的34°平行切割角度的具有防水层的底板上(图2C),矢状脑组织切割完成后(图2D~F),随后以冠状切片方向将脑组织放入脑组织冻存模具中(图2 G),使用聚乙二醇和聚乙烯醇(optimal cutting temperature compound,OCT)在冰冻切片机中进行包埋固定(图2 H)。④等待30 min后,样品彻底固定后,使用冰冻切片机切成厚度一般为40 μm的冠状脑片,贴在载玻片上晾干防止掉片。⑤最后使用PBS清洗3次,每次5 min,摇床转速为200 r/min。将含有DAPI的封片剂滴在玻片上进行封片,尽量避免气泡,然后用指甲油密封。
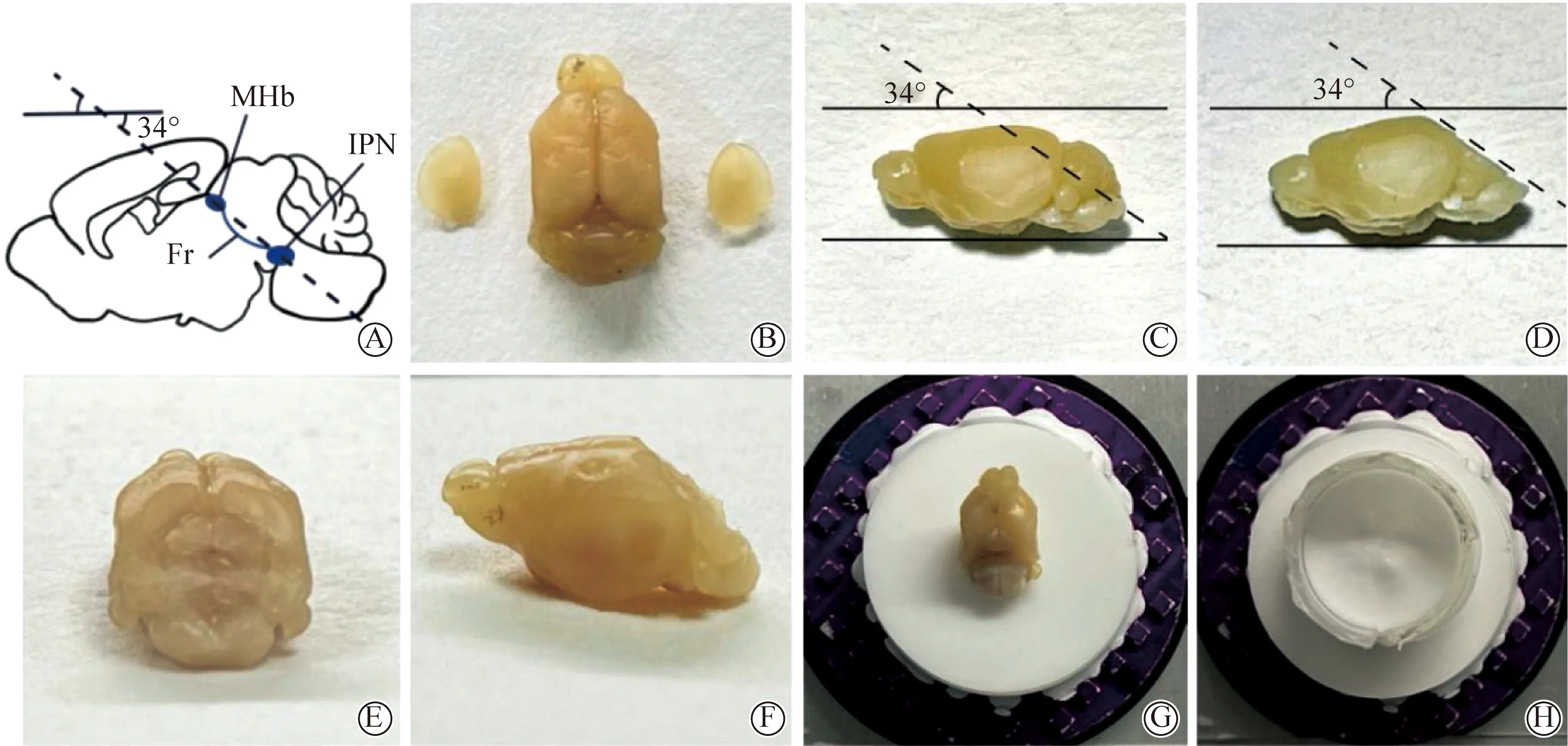
图2 小鼠斜向切片脑组织样本修整以及制备Fig.2 Trimming and preparation of brain tissue samples from oblique sections of mice
1.2.7 荧光成像及数据分析
将封片后并晾干的小鼠脑组织切片用荧光共聚焦显微镜进行图像采集。首先对样本进行断层扫描,以获得高分辨率光学切片图像,选用10×光学镜头,在软件中选中Z-stack,显示Multidimensional acquisition菜单,在此菜单分别设置起止点,常用start/end设置起止点模式,在图像预览时设置成像范围的起点和终点,同时设置光学扫描切片之间的间隔层数,若无确定把握可参考Optimal功能设置间隔层数和数量,采用系统推荐数值。下一步进行目标视野范围下大视野拼图过程,对目标区域按照设置进行每个局部组织的层扫,结束后拼接成完整成像,如图3整体图像拼接大小为9(长)×6(宽)左右。最后得到完整拼接图后,导出图像并利用Adobe Illustrator软件下的文字和套索工具结合艾伦(Allen brain)小鼠脑图谱册对比分析,确定图像中的解剖结构,对目标脑区区域较为准确地做出标记。
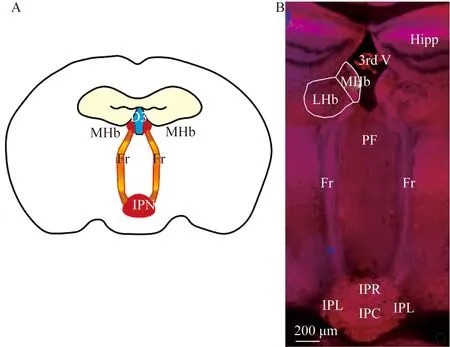
图3 ChAT-Cre;Ai9红色荧光报告小鼠MHb-IPN环路投射Fig.3 ChAT-Cre;Ai9 red fluorescence report mouse MHb-IPN projection display
2 结果
AAV是一种强大的工具,该技术在神经科学研究领域具有广泛应用价值,腺病毒可用于特定脑区靶向注射从而发现上下游所关联的脑区,在MHb区域注射顺行示踪病毒(AAV2/9-hSyn-EGFP)用以示踪其下游IPN脑区(图4),在IPN注射逆行示踪病毒(rAAV2-retro-EGFP)用以追踪其上游MHb脑区(图5)。分别注射绿色荧光病毒至小鼠大脑两个脑区,最后根据斜切的矢状荧光图均显示MHb-IPN有稳定的投射关系,是以两条后屈束(Fr)从MHb区投射到下游IPN区。
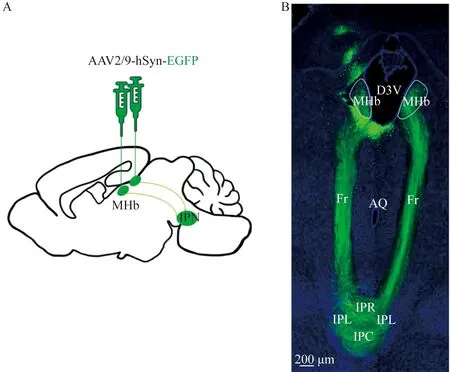
图4 MHb(双侧)注射顺行示踪病毒AAV2/9-hSyn-EGFP投射结果Fig.4 AAV2/9-hSyn-EGFP injected into bilateral MHb region was traced to IPN display
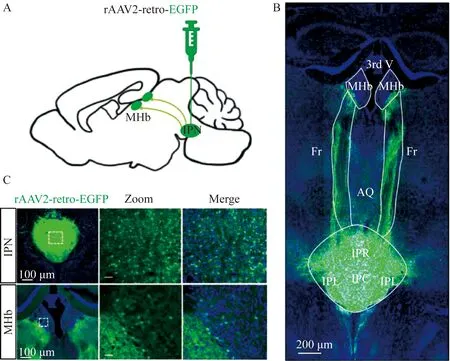
图5 IPN注射逆行示踪病毒rAAV2-retro-EGFP投射结果Fig.5 Retrograde tracing of IPN injected virus rAAV2-retro-EGFP
3 讨论
在内侧缰核-角间核通路存在大量乙酰胆碱能的神经投射,本研究通过利用腺病毒工具以及ChAT-Cre;Ai9报告小鼠来展示在特定的角度34°斜向切片的技术下MHb-IPN两脑区之间通过后屈束(Fr)连接结构形成的完整的上下游投射关系。
首先,MHb-IPN环路上存在非常多且重要的功能联系,Hb是前脑和中脑及脑干之间信息传递的中继站,与前额叶、隔核、被盖和脑干的单胺类核团有广泛的纤维联系[8]。因为这些脑区与精神障碍、情绪和认知功能密切相关,所以缰核在神经和精神疾病中的作用越来越受到关注。现有研究[9]显示,缰核在神经病理性疼痛、抑郁症、药物成瘾和精神分裂症等多种神经、精神疾病中发挥作用。
IPN比大脑的其他任何部分都表现出更依赖胆碱能神经传递的过程[10-11],但IPN对乙酰胆碱的利用途径还未清晰确定,但可能主要来自MHb的投射[12]。MHb区神经元和投射到IPN中央和中间亚核的末端区中都存在大量的ChAT[13-15]。然而,MHb也释放其他神经调节剂,包括SP物质,也称速激肽 1[16-17],广泛分布于扣带回皮质、海马、杏仁核和下丘脑的各个区域,这可能与应激和情感反应的调节有关[18],研究者们将逐渐揭示缰核参与精神障碍相关疾病的分子及环路机制,并不断开发以缰核为靶点的治疗措施。
脑内神经环路是实现情感与记忆的生物学基础,大脑高级功能的实现依赖于多种神经元之间的相互投射,而这些投射所构成的神经环路会对接收到的复杂信息进一步传递与处理。想要揭示情感包括记忆在内的脑功能原理以及脑疾病发病机制,首先需要掌握相应神经环路的结构与功能信息[19]。能够深入了解特定的神经网络与发展、行为和学习的关系一直是神经科学的一个重要目标,随着影像学、分子生物学和光遗传学等技术的发展和应用,利用新型技术去了解大脑中MHb-IPN特定环路投射发挥的功能和机制作用,以及单个分子在这个环路中的影响,逐渐成为了热门的研究领域,但是这些问题在一定程度上的解决也依赖于神经环路水平上的示踪和功能研究,同时以上的神经生物学研究的成功实施需要具有高度针对性、高效和精确的方法。
在具体实验操作中需要注意以下技术细节,例如①在对脑组织进行修正和切割时,使用吸水滤纸能够吸附组织表面的液体,一方面在多维度进行切割操作时不易造成切割失误,同时能提高切割角度的准确性;②小鼠脑组织在脱水过程时,要尽量保证脱水完全,以减少后期在冷冻过程中产生的冰晶,一方面加快了冷冻速度,另一方面组织细胞的形态结构就保存的越好,贴在载玻片上的脑组织切片的表面气泡数量少并且质量高,同时在镜下所呈现出的图像质量也越高;③首次调整刀片与包埋组织夹角角度后,后续不可再次调整角度,以保证整个组织平面尽量以相同的角度与刀片接触,避免偏差;④冰冻温度和时间是切片的关键环节,温度不宜过冷或过高,小鼠脑组织质地比较嫩,温度不宜过低,-7 ℃~-10 ℃即可,冰冻时间取决于OCT包埋剂变为不透明状的时间,不宜预先冷冻或过久冷冻,防止发生洗片过程出现脱片现象;⑤在保证MHb两侧病毒注射剂量一致的情况下,两侧荧光强度不同,可能是由于病毒注射后,玻璃电极需要在脑内停留10 min,在留针时间内和抽针过程中,病毒液体可能有部分渗漏导致,但实际注射深度确在MHb区范围以内,理论上不影响目标区域的示踪及观察。
大脑神经环路结构的精细解析是研究大脑功能的基础,而传统解析MHb-IPN投射的神经环路结构的方法,是将冷冻后的脑组织按照常规冠状或矢状切法,将组织切成20~30 μm厚度的脑组织薄片,附着在载玻片上,随后在光学显微镜下观察和多层拍照,但是这种传统方法花费人力、物力以及时间更多,并且会将神经纤维切断,很难完整地展示每一张切片上连续的纤维,从而导致部分有效信息丢失,观察到的结果与真实结果之间,往往存在部分偏差,不利于精准解析全脑的解剖学结构。
综上,本文验证了MHb-IPN神经环路投射关系并介绍了一种能够精准把握脑组织切片角度并完整展示MHb-IPN神经环路投射的组织切片技术方法。通过对小鼠整体脑组织三个面不同角度和厚度的切割,可以实现将MHb、IPN和Fr三部分完整地呈现并且展示出整体的连接结构,能够在同一水平面下较为清晰地观察到以上两个脑内深部核团中的神经元活性以及细胞分泌水平的变化,并且可进行直观地分析和差异比较,在全脑尺度上获得精确的MHb-IPN神经环路结构信息,为研究两个重要核团连接之间发挥的功能和探索两者存在的神经环路调控机制提供了直观、精准的观察和分析手段。本技术将为内侧缰核区域相关投射的神经环路结构与功能研究提供有效环路投射成像技术支撑。

