134例生长受限胎儿产前诊断结果分析
侯 磊 王小新 刘丽恒 张为远 王 欣
(首都医科大学附属北京妇产医院/北京妇幼保健院产科, 北京 100026)
胎儿生长受限(fetal growth restriction,FGR)是指各类原因所导致的胎儿体质量低于同孕龄平均体质量第10百分位数或低于同孕龄平均体质量的2个标准差。国内外研究[1-2]报道FGR的发生率为3%~10%,FGR胎儿的围产期病死率较高,不仅在孕期可能出现死胎,出生后新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome,NRDS)、低体温、脑出血及智力障碍等远近期并发症发生风险也显著增加。
FGR的病因很复杂,可以简要归结为母体、胎儿和胎盘三大因素,胎儿因素又称为内因性FGR,包括染色体病、基因病、病毒感染等胎儿本身因素所导致的FGR。对于FGR胎儿的非整倍体研究已非常广泛,以往研究[3]显示,19%的FGR是由于染色体病导致的,约90%的18-三体、30%的21-三体胎儿有FGR表现,Yaegash等[4]报道了39.2%的Turner综合征可伴发胎儿生长受限,Snijders等[5]的研究显示26周前三倍体是导致FGR的最常见的染色体异常,而26周后最常见的染色体异常为18-三体。18-三体、21-三体和Turner综合征是除了三倍体以外最常见的导致妊娠早期FGR合并胎儿畸形的非整倍体。
近年来,随着染色体技术的不断发展,研究[6]显示基因拷贝数变异(copy number variations,CNVs)是基因组疾病中最常见的类型,主要的临床特征除内脏器官畸形外,尚合并智力发育异常、精神行为改变等。国内外研究[7]显示,对超声异常胎儿的致病性CNV检出率达6.0%~27.4%,有极高的临床意义,鉴于此,母胎医学及基因学会指南[8]建议,胎儿存在一种以上结构异常建议常规行CNVs检测。以往的研究[9]还显示,半数以上的病理性CNVs的孩子在胎儿期表现出生长发育迟缓,因此,对于FGR胎儿进行CNVs检测将在很大程度上减少染色体病胎儿的出生。本文对134例FGR胎儿进行了核型联合低覆盖度大规模平行测序技术(copy number variation sequencing, CNV-seq)的检测,以明确生长受限胎儿CNV的检出率。
1 对象与方法
1.1 研究对象
将2013年1月1日至2016年12月31日间来首都医科大学附属北京妇产医院产前诊断中心就诊,胎儿超声提示胎儿生长受限并知情同意接受产前诊断的134例孕妇作为研究对象,孕周18~32周,中位数孕周为25周。产前诊断的方法包括羊水穿刺102例,脐血穿刺30例,流产物送检2例。 胎儿生长受限诊断标准依据《胎儿生长受限专家共识》[10]。孕妇术前常规遗传咨询并签署知情同意书。本研究利用的研究信息不含有使受试者的身份被直接识别或通过与其相关的识别物识别的信息,属于免除伦理审查。
1.2 资料收集
收集研究对象的一般情况、指征、血清筛查结果、遗传室结果、超声结果等。羊水穿刺、脐带血穿刺及绒毛穿刺均由本院产前诊断中心完成,送检单位为本院遗传实验室。羊水诊断:妊娠18~23+6周经腹羊膜腔穿刺取羊水30 mL。脐血诊断:妊娠24周后经腹脐静脉穿刺取血2 mL。所有介入性产前诊断均在超声定位下进行,按照常规方法进行细胞培养、收获、制片及核型分析。
1.3 基因拷贝数变异的检测
将50 ng基因组 DNA进行片段化处理,获得大小为 300 bp的DNA片段,构建测序文库[11-12],使用 Illumina公司的HiSeq 2000平台进行测序,36 bp单端测序,测序深度0.1倍,产生800万条的测序序列。使用Burrows-Wheeler算法将所有测序序列与hg19基因组进行比对分析[13]。根据文献[14]记载的数据处理和分析算法,将最少20个测试样本进行内部比较,互相作为参考。以60 kb为基本测序单元,对大约500万条测序序列进行分析。以标准化测序读取密度的log2值为y轴,以相对连续的60 kb测序单元为x轴,绘制CNV-seq检测结果图。然后,依据每条染色体的长度计算log2平均值。
数据经查询DGV、DECIPHER、OMIM、UCSC以及Pubmed公共数据库资源。致病性CNV根据美国医学遗传学与基因组学会(American College of Medical Genetics and Genomics,ACMG)的诊断标准,将CNVs分为3大类5级:①致病性CNVs (pathological copy number variations,pCNVs);②良性CNVs;③临床意义未明的CNVs;④可能致病性CNVs;⑤可能良性CNVs[15]。
1.4 统计学方法
数据采用SPSS 22.0软件进行处理。计数资料采用频数及率描述。计数资料组间比较采用χ2检验或Fisher精确检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 生长受限胎儿的染色体异常检出情况
134例胎儿生长受限病例中总的染色体异常为13例(9.7%),其中18-三体2例,13-三体1例,其他染色体异常1例,致病性基因拷贝数变异9例。其他染色体异常者是1例27岁孕妇,颈项透明层厚度(nuchal translucency, NT)增厚3.0 mm,绒毛穿刺CNV-seq无异常,25周表现为FGR、双侧脑积水、颅内囊肿、双侧唇裂、内脏转位、右位心、双肾回声增强、左肾多囊、左足内翻行核型检查为46,XN,der(3)t(1;3)(p26)[3]/46,XN[46]。孕妇要求终止妊娠后引产。
将胎儿生长受限病例分为孤立性胎儿生长受限(胎儿只有生长受限一项超声异常)及综合征性胎儿生长受限(胎儿除生长受限外尚有其他超声软指标或结构异常),结果显示孤立性生长受限胎儿的染色体异常发病率为7.3%(3/41),综合征性生长受限胎儿的染色体异常发病率为10.8%(10/93),两者差异无统计学意义(P=0.762),详见表1。
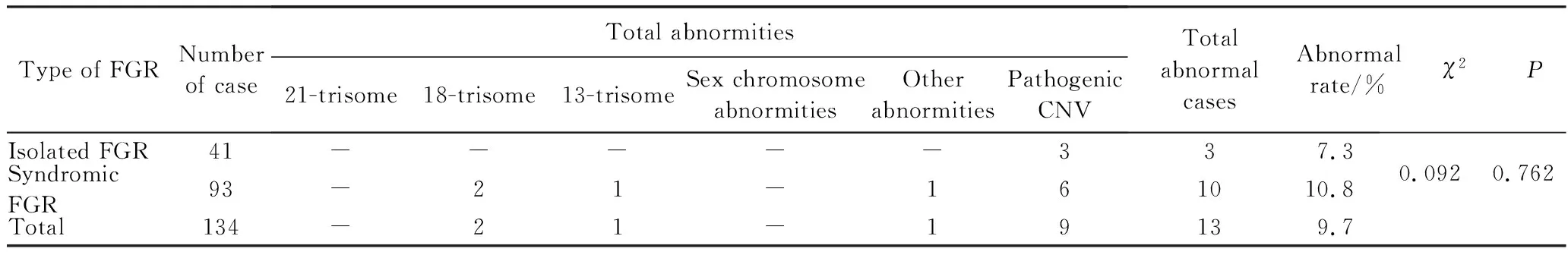
表1 不同类型FGR胎儿染色体异常检出率Tab.1 Chromosome abnormities of fetus suffered from FGR
将生长受限胎儿并其他超声软指标及结构异常汇总后发现,胎儿生长受限最常见的伴发异常为心脏异常,两者同时出现时染色体异常发病率为33.3%(7/21),其次为消化系统、泌尿系统及颅内结构异常,其中,染色体异常发病率较高的是FGR伴发泌尿系统异常,染色体异常检出率为31.3%(5/16),不同伴发表现的生长受限胎儿染色体异常检出率差异无统计学意义(P=0.145),详见表2。

表2 不同伴发表现的FGR胎儿染色体异常检出率Tab.2 Abnormal ultrasound combined with FGR
2.2 生长受限胎儿的基因拷贝数变异检出情况
134例标本中共检出致病性CNV 9例,均为新发突变(表3)。3例为孤立性FGR,6例为综合征性FGR。9例患者中,4例为Wolf-Hirschhorn综合征(Wolf-Hirschhorn syndrome, WHS)(病例1~4),其余有3例为已知微缺失综合征,包括1q21.1微缺失综合征、16p12.1微缺失综合征、8p23.1微缺失综合征(病例5~7),病例8缺失片段涉及3个功能基因,病例9涉及27个功能基因,评级均为致病性。
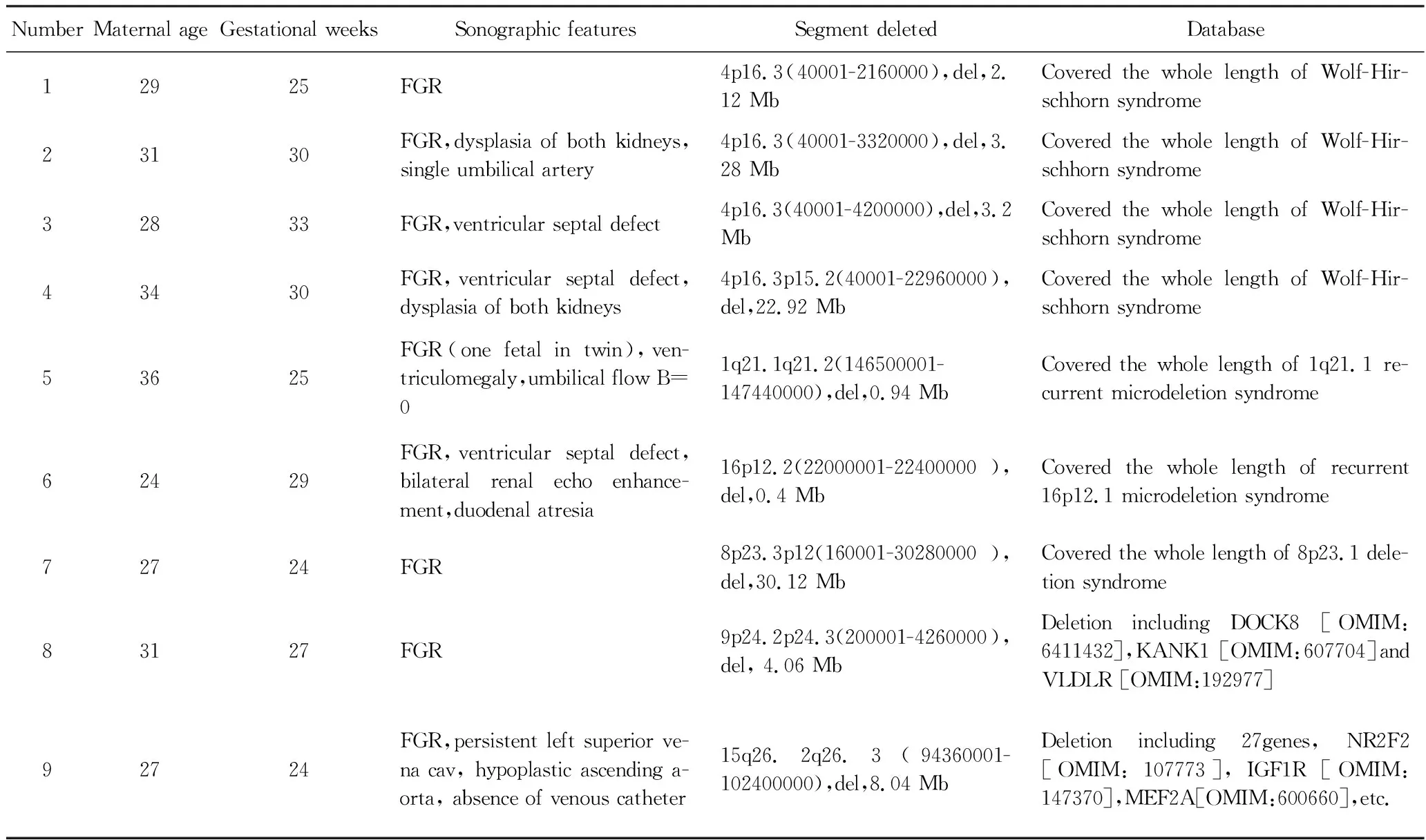
表3 FGR胎儿病理性基因拷贝数变异Tab.3 FGR with pathogenic CNVs
标本中还检出致病性未知病例3例。病例1,孕妇30岁,因孤立性FGR于33周行脐血穿刺,核型无异常,CNVs提示6q24.1(140960001-142020000)重复片段大小为1.06 Mb,为父源性。数据库有3例该重复片段患者,临床表现为整体发育迟缓;病例2,孕妇29岁,孕32周,胎儿偏小,心室强回声,双肾盂宽、持续右脐静脉行脐血穿刺,显示17p12(13220001-13620000)缺失,片段大小为0.4 Mb,数据库中未找到相关信息,为母源性;病例3,孕妇33岁,孕23周,FGR,行羊水穿刺,显示2q22.1(137860001-138000000)缺失片段大小为0.14 Mb,数据库中未找到相关信息,孕妇无携带,父亲拒绝检测。
3 讨论
以往研究[7,16-17]显示,CNVs的检测可以增加FGR胎儿4.8%~5.5%的染色体异常检出率。本研究结果与以往研究结果一致,提示FGR胎儿病理性CNVs的检出率高于核型,CNVs可增加3.7%的染色体异常检出率,因此,在FGR的产前诊断中一定不能忽略CNVs的检测。
本文研究还显示,综合征性FGR检出率(10.8%)高于孤立性FGR(7.3%),同以往研究一致,但差异无统计学意义,提示临床工作中也需要重视孤立性FGR的染色体病发病风险。Shaffer等[18]应用染色体微阵列(chromosomal microarray analysis, CMA)检测251例FGR产前标本发现,孤立性FGR为2.7%,综合征性FGR检出率为10.3%。Borrell等[7]对133例FGR的研究显示,孤立性及综合征性FGR的病理性CNVs检出率分别是10.0%及10.5%。Brun等[19]对143例FGR的胎儿进行基因拷贝数的检测结果显示,病理性CNVs的检出率达7%,均为综合征性FGR。吴坚柱等[20]使用CMA分析了32例FGR样本,发现孤立性FGR组、综合征性FGR组的异常检出率分别为14.3%和33.3%。马玉红等[21]的研究显示,孤立性FGR组胎儿病理性CNVs检出率为9.1%,综合征性FGR组为22.7%。综合以往研究结果,孤立性FGR检出率为2.7%~14.3%,综合征性FGR检出率为10.3%~33.3%,检出率差异较大,考虑与样本量及病例选择有关。
本研究显示,孤立性FGR中的3例染色体异常均为病理性CNVs,Zhu等[22]的研究也有相似的发现,在孤立性FGR胎儿中,病理性CNVs的检出率(33.3%)高于核型异常的检出率(16.75%),以上结果提示孤立性FGR更需要行CNVs的检测。
An等[16]的研究显示,以24周为界,将FGR分为早发型及晚发型,早发型(<24+0周) FGR的病理性CNVs检出率为9.6%,与晚发型(24~33 周)的FGR(9.3%)差异无统计学意义。本研究中<24+0周孕妇42例,共检出2例,检出率4.8%,≥24周孕妇92例,共检出11例,检出率为12.0%,提示晚发型FGR的产前诊断也不容忽视。
目前己知的可以引起胎儿生长发育迟缓的微缺失微重复综合征己超20多种,其中包括Williams-Beuren综合征、WHS、22q综合征等。以往研究[7]显示,FGR胎儿中最常见的微缺失微重复综合征为22q11.2重复综合征、Xp22.3缺失综合征及7q11.23缺失综合征(Williams-Beuren 综合征),特别是在孤立性FGR胎儿中,这三类异常的总检出率甚至超过核型异常。而本研究中,WHS检出率最高,为4例,甚至超出非整倍体检出率。Blanco等[23]对27例WHS患者研究分析,发现92%的WHS患儿在孕期存在胎儿生长受限。Zhen等[24]的研究显示,6例WHS胎儿中有5例出现FGR,最早在孕21周时出现生长迟缓。WHS缺失区包含的WHSC1基因编码位于核内的具有组蛋白甲基转移酶活性的转录调节蛋白,参与早期胚胎的发育,与出生前及出生后生长发育迟缓相关。
本研究中还发现3例已知微缺失综合征,包括1q21.1、16p12.1、8p23.1,以往的FGR研究[18]显示,FGR所涉及的片段有4p16.3、7q11.2、12p13.3、19p13.3,分布在不同的染色体,且无明确的规律性,进一步显示了FGR不仅与染色体结构异常或非整倍体有关,还涉及不同染色体亚显微结构异常。通过本研究可以看出,FGR是基因拷贝数变异相关度极高的疾病,随着数据的积累,基因拷贝数变异的检测也为新综合征的发现提供了坚实的基础。

