黑翅土白蚁菌圃微生物对蚁巢伞生长的影响
朱娅宁,羊桂英,周琪欢,谢晓俊,漆梦雯,沈 毅,莫建初
(浙江大学 昆虫科学研究所 农业部作物病虫害分子生物学重点实验室,浙江 杭州 310058)
蚁巢伞属Termitomyces是一类与白蚁共生的真菌,隶属担子菌门Basidiomycota伞菌亚纲Agaricomycetidae离褶伞科Lyophyllaceae[1],常于雨季自白蚁菌圃内破土而出,俗称鸡枞菌,其味道鲜美、经济价值高,但目前尚未开发出可行的人工栽培模式。白蚁菌圃内细菌种类相对丰富,主要有拟杆菌门Bacteroidetes、厚壁菌门Firmicute、放线菌门Actinobacteria、变形菌门Proteobacteria、螺旋体门Spirochaetes等,这些细菌在菌圃中超过85%[2]。白蚁菌圃由上层至中层,纤维素及半纤维素的相对含量保持稳定,自下层起,约69%不溶碳水化合物消失,并伴随可溶性单糖及寡糖增加[3-4]。PAULY等[5]研究表明:仅依靠白蚁自身难以完全降解木质纤维素,推测菌圃微生物也参与了木质纤维素的降解[6]。
蚁巢伞是白蚁菌圃内优势共生真菌,通过高通量测序手段证实菌圃内其他杂菌占比仅0.03%,杂菌中常见的有枝孢属Cladosporium、木霉属Trichoderma和伞状霉属Umbelopsis等[7]。菌圃开始消亡后,炭角菌属Xylaria及其他真菌会快速取代蚁巢伞占领整个菌圃[8]。但也有研究证实:菌圃中存在助益蚁巢伞的真菌,如云南地白蚁 Hypotermes makhamensis菌圃中的真菌Gigantropanus sp.[9]、胖身土白蚁Odontoterme obesus后肠中的构巢曲霉Aspergillus nidulans[10],两者均能与蚁巢伞协同降解木质纤维素。本研究参考SAWHASAN等[9]的对峙培养手段,探讨了菌圃细菌与蚁巢伞的互作关系,并使用高效液相色谱法分析了菌圃细菌降解木质纤维素能力与相应生成产物,旨在用“以菌促菌”的新思路探索蚁巢伞生长出菇的奥秘。
1 材料与方法
1.1 材料
1.1.1 供试材料来源 供试黑翅土白蚁 Odontotermes formosanus 蚁巢采自福建省三明市大田县,室内 26 ℃避光饲养。供试蚁巢伞分自黑翅土白蚁蚁巢,为实验室留存蚁巢伞菌株,经分子鉴定为Termitomyces heimii,GenBank登录号为KF302100[11]。菌圃外源细菌分离自铁皮石斛Dendrobium officinal,为贝莱斯芽孢杆菌 Bacillus velezensis。
1.1.2 细菌分离培养基 1/5 LB 固体培养基:胰蛋白胨 2.000 g、酵母提取物 1.000 g、氯化钠 2.000 g、琼脂粉14.000 g、蒸馏水1 L,pH 5;1/10 LB固体培养基:除琼脂粉外,其余依照1/5 LB培养基,配方减半,pH 5。
1.1.3 真菌分离培养基 1/5 马铃薯葡萄糖琼脂培养基 (PDA):马铃薯 40.000 g、葡萄糖 4.000 g、琼脂粉 14.000 g、蒸馏水 1 L,pH 5;1/10 PDA:除琼脂粉外,其余物质依照 1/5 PDA培养基,配方减半,pH 5;1/5 改良马丁固体培养基:蛋白胨 1.000 g、酵母提取物 0.400 g、葡萄糖 4.000 g、磷酸氢二钾0.250 g、七水硫酸镁 0.125 g、琼脂粉 14.000 g、蒸馏水 1 L,pH 5;1/10 改良马丁固体培养基:除琼脂粉外,其余物质依照1/5 改良马丁固体培养基,配方减半,pH 5。倒平板时,向上述培养基中添加无菌水稀释后的氨苄青霉素和卡那霉素,至两者在培养基中终质量浓度分别为20.000和50.000 mg·L-1。
1.1.4 其他培养基 玉米麸皮纤维素液体培养基:玉米粉 20.000 g、麸皮 10.000 g (玉米粉及麸皮煮熟后过 4 层纱布过滤)、磷酸氢二钾 1.000 g、七水硫酸镁 0.500 g、纤维素粉末 5.000 g、蒸馏水 1 L,pH 5;玉米麸皮双倍琼脂固体培养基同上述配方配制,不加纤维素粉末、琼脂粉28.000 g,pH 5。
1.2 微生物分离
1.2.1 采集菌圃 取上、中、下层菌圃各 0.050 g 混合。制备菌圃悬液:取 0.010 g 混合菌圃于 2 mL 离心管,加入1 mL无菌水,涡旋3次,每次30 s,静置5 min,取上清液。同时,将菌圃悬液系列梯度稀释为100、10-1、10-2、10-3用于后续试验。
1.2.2 细菌分离 取 300 μL 稀释梯度为 10-1、10-2、10-3的菌圃悬液,加入 1/5 LB 固体培养基与 1/10 LB固体培养基后涂布均匀,设3组重复,28 ℃避光普通环境下培养2~3 d,并统计该培养条件下菌圃细菌的数量,菌株纯化2次后4 ℃保存。
1.2.3 真菌分离 取小块菌圃,于 1/5 PDA 培养基、1/10 PDA 培养基、1/5 改良马丁培养基和 1/10 改良马丁培养基上,菌圃块间距为2 cm,设3组重复。取300 μL稀释梯度为100、10-1、10-2的菌圃悬液,分别加入上述培养基后均匀涂布,设3组重复,培养条件同1.2.2的细菌,同时统计该培养条件下菌圃真菌的数量。
1.3 微生物鉴定
1.3.1 细菌鉴定 提取菌株 DNA,选取通用引物 27F 和 1492R 扩增细菌 16S rRNA 基因片段,扩增条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30 次循环;72 ℃ 5 min。聚合酶链式反应(PCR)产物送浙江尚亚生物技术有限公司测序,测序结果通过BLAST (http://www.ncbi.nlm.nih.gov)在线比对、鉴定菌株。
1.3.2 真菌鉴定 纯化后真菌培养5 d后送浙江尚亚生物技术有限公司,提取真菌基因组DNA,以其为模版,选取通用引物ITS1与ITS4扩增真菌ITS序列,测序后通过BLAST (http://www.ncbi.nlm.nih.gov)在线比对、鉴定菌株。
1.4 细菌对蚁巢伞生长影响
1.4.1 制备菌圃细菌菌液 将分离菌圃细菌及贝莱斯芽孢杆菌分别接种至玉米麸皮纤维素液体培养基,于28 ℃、150 r·min-1普通环境下避光摇培24~28 h后,使用分光光度计调整细菌菌液浓度,选取吸光度D(600)为0.15时的细菌菌液作为种子液。取1 mL种子液分别加入100 mL培养基中,条件同上摇培5 d 后,8 000 r·min-1离心 10 min,取上清液备用。
1.4.2 制备玉米麸皮细菌菌液固体培养基 在直径 60 mm 培养皿中加入 5 mL 灭菌后菌液上清液,再加入5 mL玉米麸皮双倍琼脂固体培养基,摇晃至培养基均匀凝固。接种:灭菌打孔器取直径为5 mm的蚁巢伞菌饼接入玉米麸皮细菌菌液固体培养基中,于28 ℃普通环境下避光培养15 d,不同实验组设3组重复。阳性对照:将灭菌菌液替换为灭菌葡萄糖溶液(20 g·L-1);阴性对照:将灭菌菌液替换为无菌水;中性对照:将灭菌菌液替换为灭菌后、过滤后玉米麸皮纤维素液体培养基;杂菌对照:将灭菌菌液替换为过滤后贝莱斯芽孢杆菌灭菌菌液。
1.4.3 蚁巢伞生长情况测定 蚁巢伞菌丝生长速率测定:蚁巢伞在不同玉米麸皮细菌菌液固体培养基中培养至15 d时,十字交叉法记录菌丝直径,并计算生长速率。蚁巢伞生长形态观察:蚁巢伞在玉米麸皮细菌菌液固体培养基中培养至20 d时,照相记录生长形态。
1.5 高效液相色谱法测定细菌菌液中糖类物质
1.5.1 待测液准备 可溶性糖类物质标准品溶液:6 种可溶性糖标准品经过 (45±1) ℃ 干燥恒量后,分别称取1.000 g (精度0.100 mg)至100 mL容量瓶中,完全溶解后用少量无菌水定容,过0.22 μm水系滤头过滤。待测样品:取灭菌后细菌上清液,过0.22 μm水系滤头过滤。中性对照:取灭菌后玉米麸皮液体培养基,过0.22 μm水系滤头过滤。
1.5.2 高效液相色谱法检测条件 将可溶性糖类物质标准品溶液、待测样品及中性对照送浙江大学化学分析测试平台,使用高效液相色谱-示差折光检测仪(HPLC-RID)检测糖类物质种类与含量。仪器及检测条件如下:色谱仪为Waters 1525型液相色谱仪;检测器为Waters 2414示差折光检测器(美国Waters公司);糖柱为 BENSON 2000-0 BP-OA Organic Acid Column (7.8 mm×300.0 mm,日本);流动相为去离子水;进样量为 50 μL;柱温为 80 ℃;检测器温度为 40 ℃;流速为 0.8 mL·min-1。
1.6 蚁巢伞与菌圃内其他真菌对峙培养
1.6.1 平板对峙法[9]将 100 mm 1/5 改良马丁培养基分为 2 个半圆区域,将直径为 5 mm 的蚁巢伞菌饼接种于一侧中心,28 ℃避光培养10 d后接种杂菌至另一侧,相同条件对峙培养20 d,设3组重复。
1.6.2 菌圃杂菌记录 移除菌圃内蚁王蚁后,在环境湿度为 100%,温度为 28 ℃ 避光放置,每隔 24 h拍照记录。
2 结果与分析
2.1 白蚁巢菌圃内细菌和真菌的分离鉴定
本研究从白蚁蚁巢菌圃中共分离19株细菌,分属厚壁菌门与变形菌门,在1/5 LB固体培养基中,菌圃中可培养细菌数为1.3×108个·g-1。BLAST比对细菌16S rRNA基因序列,其中15株属于厚壁菌门,分别为巨大芽孢杆菌 Bacillus megaterium (4 株)、阿氏芽孢杆菌 Bacillus aryabhattai (3 株)、蜡样芽孢杆菌 Bacillus cereus (3 株)、蕈状芽孢杆菌 Bacillus mycoides (1 株)、土杨芽孢杆菌 Bacillus toyonensis(4 株); 另 外 4 株 属 于 变 形 菌 门 , 分 别 为 Burkholderia sp. (待 定) (2 株)、Burkholderia sp. (1 株)和Cupriavidus sp. (1 株)。
本研究从蚁巢中分离出7个属,共12种真菌杂菌,在1/5 改良马丁培养基中,菌圃中可培养真菌数为2.8×104个·g-1。通过BLAST比对真菌ITS序列,并结合形态学特征,分离的真菌分别为短密木霉菌Trichoderma brevicompactum、暗孢节菱孢菌 Arthrinium phaeospermum、绿木霉菌 Trichoderma virens、Penicillium pimiteouiense、小孢产丝齿菌 Hyphodontia microspora、Coniochaeta fasciculata、歧皱青霉菌Penicillium steckii、 枝 状 枝 孢 菌 Cladosporium cladosporioides、Cladosporium velox、Paecilomyces sp. 和Ophiostomatales sp.、短密青霉菌 Penicillium brevicompactum。
本研究发现:使用菌圃碎片进行真菌分离时,木霉属菌丝快速铺满培养基(图1A)。当菌圃悬液稀释至100再涂布后,培养基中分离得到的杂菌占比较大(图1B),稀释至10-1时,培养基中分离到的蚁巢伞占比提高(图1C),而稀释至10-2时,培养基中仅存在蚁巢伞分离株(图1D),且对照组中未分离到杂菌(图1E)。菌圃杂菌仅在菌圃碎片及100菌圃悬液分离培养基中出现,推测菌圃内杂菌孢子占比较小;菌圃悬液大量稀释再涂布仍能分离到蚁巢伞,推测菌圃内蚁巢伞孢子占比较大。

图1 黑翅土白蚁菌圃内真菌的分离Figure 1 Fungi separated from the fungus-combs of O. formosanu
2.2 菌圃细菌菌液对蚁巢伞生长影响
2.2.1 菌圃细菌菌液对蚁巢伞菌丝体生长的影响 从表1可知:除巨大芽孢杆菌和阿氏芽孢杆菌外,所有的厚壁菌门细菌发酵液均可极显著提升蚁巢伞菌丝生长速率,最高可使生长速率提升0.033 cm·d-1(P<0.01)。变形菌门细菌 Burkholderia sp. (待定)、Burkholderia sp. 对蚁巢伞存在轻微抑制作用,但差异不显著。

表1 不同菌圃细菌处理对蚁巢伞菌丝体生长的影响Table 1 Effects of different bacterium treatments on the mycelium growth of T. heimii
2.2.2 菌圃细菌菌液对蚁巢伞形态的影响 菌圃厚壁菌门细菌菌液均能在一定程度上促进蚁巢伞生长。其中巨大芽孢杆菌、阿氏芽孢杆菌和蜡样芽孢杆菌发酵菌液加入培养基后可促使蚁巢伞菌丝纠结凸起,呈现圆弧状纽结(图2A、图2B和图2C)。而其余厚壁菌门细菌蕈状芽孢杆菌和土杨芽孢杆菌发酵菌液加入后,菌丝虽无凸起(图2D和图2E),但菌丝生长面积扩大。
菌圃变形菌门细菌菌液可在一定程度上抑制蚁巢伞生长。Burkholderia sp. (待定)细菌菌液对蚁巢伞生长有明显抑制作用,表现为培养基中蚁巢伞菌丝层几乎消失(图2F)。而Burkholderia sp. 和Cupriavidus sp. 细菌菌液加入后,蚁巢伞菌丝层仅仅轻微变薄(图2G和图2H)。
厚壁菌门细菌对蚁巢伞生长有促进作用,这与加入葡萄糖溶液的阳性对照组相似(图2I),较中性对照(图2J)和蒸馏水的阴性对照(图2K)生长更旺盛。与菌圃内源性细菌菌液表现有所不同,外源厚壁菌门细菌贝莱斯芽孢杆菌菌液既不抑制也不促进蚁巢伞的生长,但对其有强致畸作用,表现为蚁巢伞菌丝畸变,完全无法生长(图2L),推测菌圃外源细菌对蚁巢伞生长产生不利影响,白蚁对其有一定选择作用。
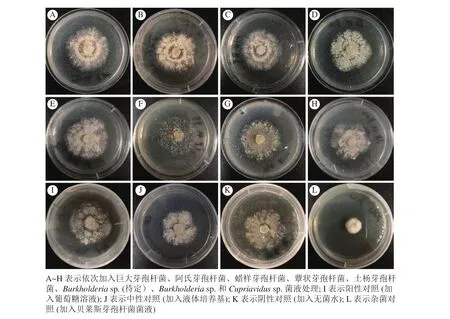
图2 不同菌液处理下蚁巢伞形态变化Figure 2 Morphological changes of T. heimii under fungus-combs bacterial fermented broths treatment
2.3 高效液相色谱分析
由于蚁巢伞利用木质纤维素能力较低,偏好利用简单糖类物质[8],故本研究选取了6种组成相对简单的可溶性糖类物质,测定高效液相色谱出峰时间。表2表明:单糖及双糖出峰时间集中在6~8 min。

表26 种常见的简单糖类物质高效液相色谱出峰时间Table 2 Retention time of six simple carbohydrates by high performance liquid chromatography (HPLC)
使菌丝纽结凸起的巨大芽孢杆菌、阿氏芽孢杆菌和蜡样芽孢杆菌菌液在6~8 min有明显出峰(图3A、图3B和图3C),对照表2各糖类物质的出峰时间可判断菌圃细菌菌液中生成了大量可溶性简单糖类物质,如单糖和双糖,推测这些简单糖类物质对促进蚁巢伞菌丝纽结凸起有一定作用。而能促进蚁巢伞生长、却无法促其菌丝纽结的蕈状芽孢杆菌和土杨芽孢杆菌菌液在6~8 min有轻微出峰,同时在4~5 min有显著出峰(图3D和图3E),推测出峰时间为4~5 min的新生成可溶性糖类物质仅能促进蚁巢伞菌丝生长而无法促进菌丝纽结。综上,出峰时间为6~8 min的糖类物质更易被蚁巢伞利用,出峰时间为4~5 min的糖类物质次之。前者能助益蚁巢伞菌丝纽结凸起,在蚁巢伞出菇方面有一定的促进作用。
变形菌门细菌 Burkholderia sp. (待定)、Burkholderia sp. 和 Cupriavidus sp. 发酵菌液在 4~5 min 和 6~8 min均有出峰(图3F、图3G和图3H),本应促进蚁巢伞生长,但却在一定程度上抑制了菌丝生长,具体表现为菌丝层变薄,甚至几乎不生长。可推测这3种细菌菌液中均生成了一定的抑制物质,其中Burkholderia sp. (待定)发酵菌液中生成的强抑制物质在灭菌后仍有抑制活性,较为稳定。
总体而言,菌圃细菌发酵菌液的色谱峰总面积均显著高于中性对照(图3I),说明菌液中可溶性糖含量增加,证实菌圃细菌可降解培养基中的木质纤维素,并转化生成可溶性糖类物质。
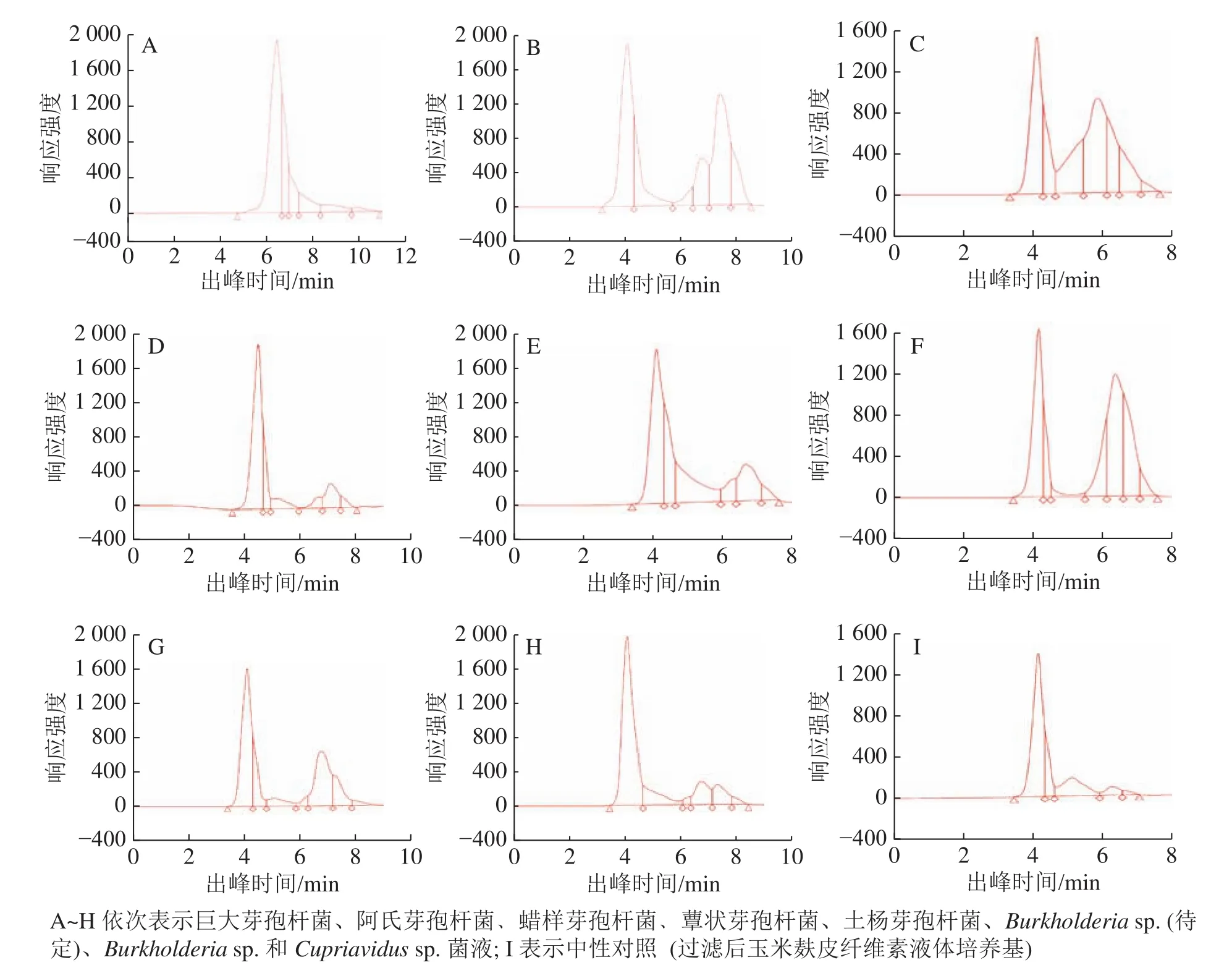
图3 菌圃细菌菌液高效液相色谱分析图Figure 3 High performance liquid chromatography (HPLC) analysis of bacterial fermentation broths in the termite fungus-combs
2.4 蚁巢伞和菌圃内其他真菌对峙培养
蚁巢伞自身抗杂菌能力较弱,无法抑制其他菌圃杂菌的生长(图4)。此外,菌圃杂菌也无法促进蚁巢伞的生长,这与SAWHASAN等[9]的结果相悖,可能是采用不同培养基所导致的。生长速度越快的杂菌对蚁巢伞影响越大,表现为蚁巢伞快速被杂菌侵染,无法正常生长;生长速度较慢的杂菌对蚁巢伞生长影响较小,但与对照相比杂菌仍产生了一定的抑制作用。

图4 蚁巢伞与黑翅土白蚁菌圃内其他真菌对峙培养试验Figure 4 Antagonistic culture of T. heimii with other fungi separated from the fungus-combs
2.5 白蚁巢群消亡后真菌杂菌生长情况
菌圃消亡后杂菌将快速侵占菌圃(图5)。自菌圃消亡后,菌圃内幼蚁的活动能力降低,在蚁巢消亡后生长速度较快的真菌如青霉属Penicillium和木霉属Trichoderma对蚁巢的威胁和影响最大,它们将快速生长、入侵直至菌圃完全被包裹。这些杂菌在自然界中普遍存在,但在有白蚁活动的菌圃内却受到抑制、无法生长,而自巢群消亡开始,杂菌迅速占领菌圃,推测菌圃的低含水量以及白蚁分泌的部分抑菌物质是抑制杂菌生长的两大主要原因。

图5 菌圃消亡后 5 d 内菌圃中真菌类杂菌生长情况Figure 5 Fungi growth in 5 days after deaid termite fungus-combs
3 讨论
厚壁菌门为菌圃中的五大主要细菌类群之一,在不同时期菌圃内该门类细菌占比会发生一定变化[12]。在无蚁巢伞子实体生长的黑翅土白蚁蚁巢中,厚壁菌门细菌占比较有蚁巢伞子实体生长的蚁巢更大[13],推测厚壁菌门细菌对蚁巢伞出菇有促进作用。本研究也证实:菌圃厚壁菌门细菌菌液确对蚁巢伞菌丝生长及纽结有利,而同属厚壁菌门的外源细菌贝莱斯芽孢杆菌对蚁巢伞有强致畸作用,推测为了保证蚁巢伞正常生长,白蚁对菌圃内微生物有一定选择性。目前共发现330种大白蚁亚科Macrotermitinae菌培白蚁[14],其低龄工蚁以菌圃内植物材料以及菌丝瘤(蚁巢伞菌丝及分生孢子纠集而成)为食[8],菌丝瘤的存在能调节白蚁食物组成的碳氮比[15]。作为食物的菌丝瘤若不加以调控,可能会无休止地生长,影响白蚁自身生存,因此推测白蚁可能通过调控菌圃内细菌种群来控制菌丝瘤大小,使其不过度生长,易于白蚁食用。
白蚁对菌圃微生物有一定的选择性[6,12],而Burkholderia sp. (待定)虽能强烈抑制蚁巢伞生长,但由于存在于菌圃内,并不会被“排外”,加之其抑制蚁巢伞生长的代谢产物非常稳定,故Burkholderia sp. (待定)或其代谢产物可考虑为一种生物防治手段,通过抑制蚁巢伞的生长,阻碍蚁巢存续。
木质纤维素在历经白蚁肠道微生物作用之后,由菌圃内微生物继续降解,并最终生成可溶性多糖,供蚁巢伞和白蚁利用[8]。本研究采用pH 5的玉米麸皮纤维素培养基在模拟菌圃环境的同时还为菌圃细菌提供了一定养分,木质纤维素的加入则更有利于探索菌圃细菌降解木质纤维素的能力以及相关代谢产物对蚁巢伞生长的影响。蚁巢伞自身缺少独立降解木质纤维素的能力,且其分泌的木质纤维素降解酶种类也较为有限[16],反观菌圃内细菌却能通过产生大量木质纤维素降解酶的方式参与协同高效降解木质纤维素[17]。LI等[3]研究发现:上、中、下层菌圃分别失去了13%、45%、60%的木质素,而葡糖糖却相应地增加了14%、28%、42%。以上研究均与本研究结果相吻合:菌圃细菌具有降解木质纤维素、生成可溶性单糖和寡糖的能力,菌圃细菌和蚁巢伞在降解木质纤维素方面有上下游协同作用,且生成的简单可溶性糖类物质如葡萄糖等对蚁巢伞生长有促进作用。
OTANI等[7]通过高通量测序证实:菌圃内蚁巢伞占菌圃真菌的99.90%,而其余20个属真菌仅占0.07%。本研究也表明:菌圃中蚁巢伞孢子数量确实远大于其他真菌,菌圃中存在部分常见的霉菌,在菌圃消亡后将对菌圃造成一定威胁。同时OTANI等[7]发现:大部分杂菌与鸡纵菌共培养后生长受到抑制,但本研究结果却与之相悖,蚁巢伞几乎无法抑制杂菌生长。KATARIYA等[18]研究表明:白蚁能够分泌抗菌肽抑制菌圃杂菌,这与本研究推测结果相吻合,即相比蚁巢伞,白蚁才是外来杂菌的主要防御者。
本研究初步分析了菌圃中单个微生物对蚁巢伞生长的影响。今后需要从多个菌圃微生物对蚁巢伞生长的影响为切入点,深入研究“以菌促菌”的思路,以促进人工条件下大量培育蚁巢伞。

