医疗废弃物电子束辐照灭菌处理效果
朱焕铮 张涛 韩筠松 陈海 何仕均
1(中广核达胜加速器技术有限公司 苏州 215214)
2(中广核达胜科技有限公司 苏州 215214)
医疗废弃物是医院、诊所等卫生机构在医疗以及其他相关活动中产生的具有直接或者间接感染性和其他危害的废物[1-2]。医疗废弃物中可能含有大量病原微生物和传染性病毒[3],如果处置不当极易对土壤、水域、大气造成不同程度的污染,危害人们的身体健康,因此,医疗废弃物被列入《国家危险废物名录》(2021年版)[4],感染性废弃物代码为841-001-01。2019年底,新型冠状病毒肺炎(COVID-19)的传播导致医疗废弃物产生量大幅增加[5]。目前,国内疫情虽然已经得到有效遏制,但仍有局部爆发。因此,医用废弃物亟需有效灭菌处理,否则很容易出现二次污染,甚至成为病毒的传播源[6]。
依照国家相关法规,所有医疗垃圾和医疗污水都必须进行消毒处理。目前,医疗废弃物的处理技术主要有焚烧处置(热解焚烧[7-8]、回转窑焚烧[9]和磁化裂解[10])、非焚烧处置(高温蒸汽处理[11-12]、化学处理[13]、微波处理[14]、等离子体法[15]和辐照[16])。随着经济的发展,全球资源日益紧缺,在做好消毒的前提下,实现部分医疗废弃物的资源化利用,有可能成为未来新的处理方式[17]。
电离辐照作为一项成熟的消毒灭菌技术,在医疗器械、制药、食品及海关检验医用材料等各个领域已经有了广泛的应用[18]。电离辐照消毒灭菌的原理主要是作用于生物大分子上的高能射线,可以引起生物大分子的电离和激发,使DNA 或RNA 分子链断裂、碱基脱落和氢键断裂,或使机体的核酸、蛋白质和酶等具有生命功能的物质结构破坏等,导致微生物新陈代谢紊乱或中断[19],引起微生物死亡。同时,医疗废弃物中含有的水分子在吸收剂量后,会发生激活和电离,产生一系列的活性粒子。这些活性粒子可以与微生物体内的生理性活性物质发生一系列的氧化还原作用,最终引起微生物基体物理、化学和生理机能的变化,实现消毒与灭菌。
本文主要开展医疗废弃物电子束灭菌的效果实验,研究吸收剂量和医疗废弃物材质对微生物灭活效果的影响,为后续电子束灭菌技术的应用提供理论和技术支持。
1 材料与方法
1.1 材料
1.1.1 菌种
实验所用微生物指示菌为短小芽孢杆菌ATCC27142, 批 次 211110, 菌 数 1.07×109CFU/mL;枯草芽孢杆菌ATCC9372,菌株批次21071905,菌数3.80×108CFU/mL,北京北纳创联生物技术研究院。
1.1.2 试剂
实验所用试剂为0.9%无菌氯化钠溶液,批次H21062603,广西裕源药业有限公司;胰酩大豆脓琼脂培养基(TSA),批次200904,北京陆桥技术股份有限公司。
1.1.3 仪器
卧式高压蒸汽灭菌锅,型号YX-600W,上海三申医疗器械有限公司生产;生化培养箱,型号SPX-300B,上海琅玕实验设备有限公司生产;生物安全柜,型号BHC-1300ⅡA2,阿尔泰实验室设备(北京)有限公司生产;电子加速器,型号RHODOTRON-TT200, 生产厂家 Ion Beam Applications S.A.。
1.1.4 染菌载体和模拟医疗废弃物材料
染菌载体为2 cm×2 cm玻璃盖玻片,医疗废弃物模拟物为裁剪至Φ2 cm的棉球、2 cm×2 cm的纱布、2 cm×2 cm的SMMS无纺布手术服、长约4 cm的输液管。
1.1.5 剂量片B3
薄膜剂量计。
1.2 方法
1.2.1 耗材灭菌
盖玻片采用高压蒸汽灭菌,灭菌温度为121 ℃,灭菌时间30 min。用于实验的棉球、手术服、输液管、纱布为环氧乙烷灭菌后的产品。
1.2.2 标准菌株准备
从医用冷藏冰箱中取出短小芽孢杆菌和枯草芽孢杆菌定量菌株,冷却至常温备用。
1.2.3 盖玻片染菌与装配
实验组:在一次性无菌培养皿(90 mm)中放置灭菌盖玻片,吸取10 μL定量工作菌液均匀涂抹在盖玻片上后,将培养皿置于生物安全柜中干燥(温度18~26 ℃,湿度45%~65%),之后将培养皿盖上后,用封口膜将培养皿侧边密封。将密封后的培养皿用双面胶固定在塑料板表面,每个样品设置3个平行样。阳性对照组:与实验组操作一致。阴性对照组:在一次性无菌培养皿(90 mm)中分别放置灭菌盖玻片,不添加工作菌液,但在生物安全柜中与实验组和阳性对照组干燥相同时间。剂量片的布放:在实验组、阳性对照组和阴性对照组的每块硬塑料板表面分别放置等同于实验组数量的薄膜剂量片,用于检测辐照过程中实际吸收剂量。剂量片的装载模式同实验组,置于无菌培养皿(90 mm)并密封。
1.2.4 医疗废弃物模拟物染菌与装配
实验组:分别在一次性无菌培养皿(90 mm)中放置灭菌后的棉球、手术服片、输液管、纱布片,然后分别吸取10 μL定量工作菌液均匀涂抹在上述载体上后,置于生物安全柜中干燥(温度18~26℃,湿度45%~65%),干燥后将培养皿盖上,并用封口膜将培养皿侧边密封,将密封后的培养皿用双面胶固定在塑料板表面,每个样品设置3 个平行样。阳性对照组:与实验组操作一致。阴性对照组:在一次性无菌培养皿(90 mm)中分别放置灭菌棉球、手术服片、输液管、纱布片,不添加工作菌液,但在生物安全柜中与实验组和阳性对照组干燥相同时间。剂量片的布放:在实验组、阳性对照组和阴性对照组的每块硬塑料板表面分别放置等同于各组实验样数量的薄膜剂量片,用于检测辐照过程中实际吸收剂量。剂量片的装载模式同实验组,放置于无菌培养皿(90 mm)并密封。
1.2.5 辐照
将所有样品干燥处理后,在中广核达胜加速器技术有限公司辐照车间进行辐照。电子束扫描宽度86 cm,调节束流强度(3.6~8 mA)和传输速度(8.6~2.1 m/min)得到需要的吸收剂量。短小芽孢杆菌的辐照吸收剂量梯度设定为3 kGy、5 kGy、10 kGy、15 kGy、20 kGy 和25 kGy,枯草芽孢杆菌的辐照吸收剂量梯度设定为2 kGy、3 kGy、5 kGy、10 kGy、15 kGy和20 kGy。阳性对照组和阴性对照组:同批实验样送至辐照车间,在电子加速器不开机的状态下传输。
1.2.6 样品回收与计数
以无菌操作转移实验样品至10 mL 洗脱液中,采用不同倍比稀释法将洗脱液稀释至合适的稀释度,于漩涡振荡器振荡2 min后备用;产品洗脱液1 mL,接种于1 个平板。每平板注入约20 mL TSA,30~35°C 培养3~7 d。阳性对照组和阴性对照组:重复同样操作。计数:按菌落计数原则进行计数,再乘以稀释倍数,计算出每个样品的菌落数(CFU/SIP)。
1.2.7 吸收剂量
将辐照后的标准薄膜计量测试片进行测量,得出真正的吸收剂量。根据GB/T 25306—2010 辐射加工用电子加速器工程通用规范[20]中的剂量不均匀性公式所示,计算吸收剂量的不均性见式(1)。

式中:Ux为吸收剂量的不均匀性,%;Umax为最大吸收剂量,kGy;Umin为最小吸收剂量,kGy。
2 结果
2.1 吸收剂量对短小芽孢杆菌灭活效果的影响
辐照结束后,取出辐照箱里的B3 薄膜剂量计,测定吸光度并计算实际吸收剂量,然后根据公式计算剂量不均匀性。如表1所示,剂量的不均匀性最小为2.76%,最大为4.15%,剂量具有较好的平行性。

表1 吸收剂量的不均匀性Table 1 Nonuniformity of absorbed dose
电子束通过直接或间接作用产生的活性粒子破坏微生物的DNA、细胞内膜的蛋白质和脂肪(磷脂)分子,导致微生物新陈代谢紊乱、中断,引起微生物死亡,实现消毒与灭菌[21]。由表2 可以看出,随着吸收剂量的升高,短小芽孢杆菌的致死率逐渐增大,存活短小芽孢杆菌的菌落不断减少。当吸收剂量为3.4 kGy 时,菌落总数从9.13×106CFU/SIP降至2.92×105CFU/SIP;吸收剂量达到13.6 kGy 时,短小芽孢杆菌杀灭对数值达到6,电子束杀灭短小芽孢杆菌的效果较为显著。王海宏等[22]研究发现,在吸收剂量为2.36 kGy 时,电子束辐照使短小芽孢杆菌带菌量从6.75×104CFU/g降至4.80×102CFU/g,较本实验的辐照杀灭效果更好。分析原因可能为辐照时短小芽孢指示菌的介质不同,文献中短小芽孢杆菌的介质为生理盐水,辐照过程中水分子电离产生的活性自由基对短小芽孢杆菌的杀灭有一定的促进作用。

表2 吸收剂量对短小芽孢杆菌灭活效果的影响Table 2 Effect of absorbed dose on the inactivation of Bacillus pumilus
2.2 短小芽孢杆菌D10值
D10值是在一定电离辐射条件下,杀死90%原有残存活菌数时所需剂量[23],通过D10值可以了解微生物对射线的抵抗力,从而制定合理的吸收剂量和辐照工艺[19]。短小芽孢杆菌对射线具有较强的耐受力,因此在辐照过程中常被用作指示菌,以短小芽孢杆菌的杀灭来表征辐照灭菌的效果,同时根据它的D10值来确定辐照灭菌的剂量。
由图1可以看出,辐照处理后存活短小芽孢杆菌菌落总数对数值与吸收剂量呈线性负相关。通过数据线性回归分析,得到回归方程,由回归方程计算得D10为2.45 kGy。
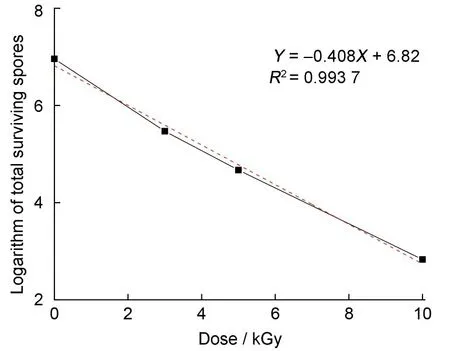
图1 吸收剂量与短小芽孢杆菌存活菌落对数的关系Fig.1 Effect of medical waste material on the inactivation of Bacillus pumilus
钱思敏等[24]研究发现,用短小芽胞杆菌E601株芽胞制作的电离辐射灭菌生物指示剂,对电子直线加速器照射的D10值为1.85 kGy。本文辐照的目标菌株为短小芽孢杆菌辐照灭菌D10值与文献报道的芽孢杆菌芽孢的D10值有较大差异,分析原因为菌片的干燥程度、载体的种类、辐照的均匀度以及初始微生物浓度等因素影响。孔秋莲等[25]也证实了这一点,电子束辐照易杀灭存在于生理盐水中的短小芽孢杆菌芽孢,其D10值为0.93 kGy;而存在于干滤纸片上的芽孢电子束辐照杀灭的D10值为2.75 kGy。因此研究载体对辐照杀灭微生物效果的影响,对于控制和杀灭医疗废弃物中的微生物污染物具有一定的指导意义。
2.3 医疗废弃物材质对短小芽孢杆菌灭活效果的影响
由表3可以看出,医疗废弃物模拟物材质对短小芽孢杆菌的提取与分离存在一定的影响。阳性对照实验数据中,盖玻片上芽孢存活数接近理论上稀释后菌液的浓度,其次是输液管。部分棉球样品上检测的芽孢存活对数值小于6,分析原因主要是盖玻片和输液管表面比较光滑,棉球比较粗糙,对芽孢有一定的吸附作用,影响了后续的分离检测。

表3 医疗废弃物材质对短小芽孢杆菌灭活效果的影响Table 3 Effect of medical waste material on the inactivation of Bacillus pumilus
辐射对附着在医疗废弃物上的短小芽孢杆菌都有较好的杀灭作用,菌株的致死率随吸收剂量增大而明显升高。当吸收剂量为9 kGy时,可以发现,不同医疗废弃物上的短小芽孢杆菌的杀灭效果不同,其中,纱布上短小芽孢杆菌的杀灭率为71.54%,盖玻片上的杀灭对数值最小,短小芽孢杆菌菌落下降比率从大到小依次为纱布、棉球、无纺布、输液管和盖玻片,分析原因:可能为辐照后纱布上存活微生物较盖玻片提取分离的难度更大,导致检测到存活的微生物浓度偏低。在吸收剂量为13.6 kGy 时,盖玻片、手术服、输液管和纱布上的短小芽孢杆菌均已完全灭活。
2.4 吸收剂量对枯草芽孢杆菌灭活效果的影响
枯草芽孢杆菌是一种革兰氏阳性菌,常被作为医疗用品消毒处理的微生物指示菌[26-27],如现行HJ 228—2021 医疗废弃物化学消毒集中处理工程技术规范[28]和HJ 229—2021医疗废弃物微波消毒集中处理工程技术规范[29]均将其作为灭菌效果的指示菌。由表4可以看出,本组实验剂量的不均匀性在2%~4%。由表5 可以看出,随着吸收剂量的升高,枯草芽孢杆菌存活的菌落数量逐渐减少。当吸收剂量为2.50 kGy 时,菌落总数从1.3×106CFU/SIP 降至1.13×104CFU/SIP;当吸收剂量达到10.50 kGy 时,枯草芽孢杆菌杀灭对数值达到6。与短小芽孢杆菌相比,辐照对枯草芽孢杆菌杀灭的效果更为显著。

表4 吸收剂量的不均匀性Table 4 Nonuniformity of absorbed dose

表5 吸收剂量对枯草芽孢杆菌灭活效果的影响Table 5 Effect of absorbed dose on the inactivation of Bacillus atrophaeus
2.5 枯草芽孢杆菌的D10值
由图2可以看出,辐照处理后存活枯草芽孢杆菌菌落总数对数值与吸收剂量线性相关。通过数据线性回归分析,得出D10为1.22 kGy。

图2 辐照吸收剂量与枯草芽孢杆菌存活菌落对数的关系Fig.2 Effect of absorbed dose on the inactivation of Bacillus atrophaeus
有资料显示,γ 射线灭活枯草芽孢杆菌的D10值为1.7~2.5 kGy[30-31]。韩伟等[32]研究不同化妆品基质对辐照灭活枯草芽孢杆菌的效果,发现彩妆粉中的枯草芽孢杆菌的D10值最高达0.48,与本实验研究存在一定差异,分析原因可能是基质的含水率引起枯草芽孢杆菌D10的不同。
2.6 医疗废弃物材质对枯草芽孢杆菌灭活效果的影响
由表6可以看出,医疗废弃物模拟物材质对短小芽孢杆菌的提取与分离存在一定的影响。阳性对照组实验数据中,盖玻片上初始枯草芽孢杆菌菌落数对数值为6,其次为输液管,棉球上检出的初始枯草芽孢杆菌菌落对数值为5,分析原因主要为医疗废弃物的粗糙程度不同所致。当吸收剂量为5.5 kGy 时,附着在输液管中的枯草芽孢杆菌的杀灭对数值达到6,枯草芽孢杆菌菌落下降比率从大到小依次为输液管、盖玻片、棉球和无纺布。较短小芽孢杆菌,枯草芽孢杆菌的辐照耐受性略低。当吸收剂量达到10.5 kGy 时,枯草芽孢杆菌的杀灭对数值全部达到6。

表6 医疗废弃物材质对枯草芽孢杆菌灭活效果的影响Table 6 Effect of medical waste material on the inactivation of Bacillus subtilis
骆琦[33]研究也发现,在吸收剂量为12 kGy时,枯草芽孢杆菌的杀灭对数值接近7,辐照后电镜照片显示枯草芽孢杆菌表面由光滑、平整变为凹陷和褶皱,说明电子束对枯草芽孢杆菌细胞造成严重破坏。
有资料证明,因微生物种类不同,其抗辐射性的能力可发生上百倍的差别,甚至同一菌群的不同菌株抗辐射能力亦不同,因此选择合适的指示菌是必要的。目前,在世界范围内,用于辐照灭菌的生物指示菌尚未统一。但目前在医疗废弃物处理技术规范中使用最多的为枯草芽孢杆菌,通过本文研究发现,枯草芽孢杆菌对电子束的耐受值较短小芽孢杆菌更低,因此辐照技术处理医疗废弃物工程实践中,选用短小芽孢杆菌作为指示菌较枯草芽孢杆菌更具有代陈表性。
3 结论
辐照杀灭短小芽孢杆菌和枯草芽孢杆菌菌落6个对数值,所需的吸收剂量分别为13.6 kGy 和10.5 kGy,短小芽孢杆菌和枯草芽孢杆菌的D10值分别为2.45 kGy和1.22 kGy,短小芽孢杆菌较枯草芽孢杆菌的辐照耐受性更高。医疗废弃物的材质对于短小芽孢杆菌和枯草芽孢杆菌的提取分离具有不同的影响,可能存在辐照后存活微生物无法提取和分离完全,导致实测灭活效果偏大的现象。
作者贡献说明朱焕铮和何仕均提出了本文的研究思路和试验方案;朱焕铮和张涛完成了本工作中辐照和微生物分析检测试验及论文的撰写;韩筠松协助完成辐照及微生物分析检测试验;陈海为数据分析整理和论文撰写提供了指导。所有作者均已阅读并认可该论文最终版的所有内容。

