人工智能在宫颈病变诊断及治疗中的应用进展与挑战
武爱媛,热米拉·热扎克*,乔友林,2
宫颈癌在全球妇女癌症发病率和死亡率中均位居第四[1],宫颈癌患者主要分布在中低收入国家(low-and middle-income countries,LMICs)[2]。中国作为人口大国,宫颈癌疾病负担较大。2018年,中国宫颈癌新发病例在全球占比最大,仅次于印度[2]。自2000年之后,其发病率和死亡率均呈逐年升高的趋势,如此严重的疾病负担已成为全球健康不平等的重要指标[3]。世界卫生组织(World Health Organization,WHO)总干事在2018年5月发起并制定了消除宫颈癌的全球防控策略[4],且明确提出联合国2030年针对宫颈癌研究的可持续发展目标。这一策略的提出将会加速更多的国家全面防控宫颈癌的步伐。随着计算机的发展,人工智能(artificial intelligence,AI)技术越来越多地应用于医学诊断中,如计算机断层扫描(computed tomography,CT)成像、三维重建、磁共振(magnetic resonance-diffusion tension imaging,MRI)、细胞跟踪与定位等。GULSHAN等[5]通过AI分析视网膜图像,诊断出糖尿病性视网膜病变。ESTEVA等[6]通过深度卷积神经网络 (convolutional neural networks,CNNs)对临床图像进行皮肤病变分类,结果表明其与具有资质的21位皮肤科医生的诊断正确率相同。在2018年,CHILAMKURTHY等[7]采用313 318张图像进行颅脑CT颅内病变检测分析,从而使计算机算法自动化分类成为可能。以上研究提示,AI应用于医学有较好的前景。本文就AI在宫颈病变的筛查、诊断及临床治疗预测方面中的应用进展与挑战进行综述。
1 AI在细胞学筛查中的应用
在过去50多年来,包括中国在内的许多国家或地区采用基于宫颈细胞学的筛查策略[8-9]。随着人乳头瘤病毒(human papillomavirus,HPV)和宫颈癌病因关系的明确,HPV检测操作简单、灵敏度高,已被推荐作为宫颈癌的初步筛查方法[10]。但由于宫颈细胞学检测具有更高的特异度,在宫颈癌筛查和分诊中仍较重要[11]。目前基于人群的宫颈细胞学检测仍面临着众多挑战,如缺乏合格的细胞病理学家、工作量过大、灵敏度相对较低和诊断一致性差等问题。AI技术的发展具有解决上述宫颈细胞学筛查瓶颈的巨大潜力。
2018年有学者用AI系统对巴氏细胞涂片图像进行自动化筛查,发现当识别正常或异常细胞时,AI系统的诊断准确率分别超过99.27%和98.5%;但由于当时计算机算法存在一定缺陷,导致细胞分类精度较低[12]。近两年计算机在处理速度、内存量、可访问性以及图像捕获和显示技术等方面取得了显著进步。2020年,BAO等[13]研究发现AI辅助细胞学检测模型与资深细胞学家相比,二者具有相似的灵敏度和较高的特异度;而与基层医院的细胞学医师相比,具有高灵敏度和高特异度。在HPV阳性女性中,与人工阅读相比,该AI模型提高了识别宫颈上皮内瘤变1级(cervical intraepithelial neoplasia grade 1,CIN 1级)及以下病变的特异度,且灵敏度没有降低。之后又有研究对基于人群筛查的70万女性的细胞学图像进行训练并验证,发现该AI模型和人工阅读的一致性为 0.947(P<0.001)[14]。在不除外高级别鳞状上皮内病变(high grade squamous intraepithelial lesion,HSIL)的非典型鳞状上皮细胞或HSIL的女性时,AI模型检出CIN 2级及以上(CIN 2+级)病变的灵敏度明显高于人工阅读(P<0.001),且实际高于人工阅读5.8%,特异度稍降低。
此外,为了揭示AI模型具有用于大规模人群宫颈癌筛查的可行性,TANG等[15]开发了一台AI显微镜用于识别低级别鳞状上皮内病变(low grade squamous intraepithelial lesion,LSIL)和HSIL,其灵敏度分别从0.837、0.830提高至0.923、0.917(P<0.001),研究表明AI显微镜可为宫颈细胞学筛查提供实时辅助,预示着该项技术辅助细胞学医师提高诊断宫颈细胞学的有效率和准确性成为可能。WENTZENSEN等[16]开发了一种基于云计算的全玻片成像平台,该平台是以活检病理为金标准制作了p16/Ki-67双重染色细胞学涂片的AI模型;研究发现与巴氏细胞学相比,该模型可以减少1/3的阴道镜转诊患者(41.9%与60.1%,P<0.001)。
以上研究表明,利用AI的方式建立相关的数学模型可对细胞做出检测,以判断其是否发生病变。AI辅助诊断系统在宫颈细胞学检测中的应用情况见表1[13-18],其稳定性、实用性均较强,可以减少不必要的阴道镜转诊。
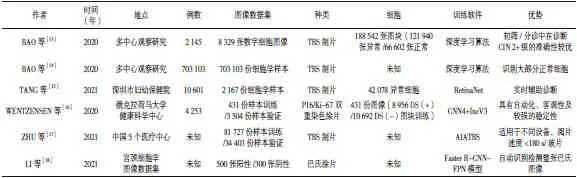
表1 AI辅助诊断系统在宫颈细胞学检测中的应用情况Table 1 Application of AI-assisted diagnostic system in cervical cytology detection
高灵敏度的AI辅助诊断与高特异度的宫颈细胞学筛查相结合在真实世界中实用性较强,揭示了AI辅助细胞学应用于宫颈癌筛查或分诊中的潜在价值,主要如下:
(1)用于大量正常宫颈细胞学的筛查。在普通人群中,宫颈细胞学结果阴性占比超过95%,异常仅占3%~5%[19],使得人工阅片的假阴性较高,而AI与人工阅片相比,对正常宫颈细胞学的筛查具有较高的符合率,自动化Thin Prep成像仪也支持该结果[20]。人工阅片结果中细胞学结果正常的女性占比超过99%,其可被AI辅助排除,类似于Focal Point系统25%的细胞学涂片无需进一步检查[21];另外,AI辅助细胞学系统对异常细胞学检出率接近5%,比国家组织的宫颈癌筛查计划(液基薄层细胞学检测报告系统3.2%)高20%,甚至高于发达国家[19],由此,AI用于检查多数最可能为正常的自然人群细胞学涂片,间接增加对阳性细胞学涂片的关注,进而显著减轻了病理学医师阅片的工作量。
(2)提高诊断准确性。细胞学医师虽在诊断中起决定作用,但不同医师的主观性及异质性差异较大[22],日常阅片工作中存在无穷尽地寻找细胞涂片、对异常细胞保持持续警惕、可重复性差等一系列问题,AI辅助细胞学系统与人工阅片的双重结合为解决这些困难提供了机会[12]。有研究发现AI模型检出CIN 2级和CIN 3+级的准确率分别达到92.6%和96.1%,显著高于或接近人工阅读[13],更有力地证明AI可以辅助细胞学医师更准确地筛查宫颈发育不良细胞。
(3)提高诊断效率[15,17]。通过AI可加强细胞学技术、诊断质量控制,降低单片的筛查时间,提高宫颈细胞学筛查的诊断效率,使每个显微镜视野的推理和标注时间短至 200 ms[15]。
(4)提高病变检出率。AI系统与p16/Ki-67双重染色细胞学涂片相结合,其阳性率低于巴氏细胞学和人工双重染色,且具有相同的灵敏度和更高的特异度(P<0.001)[16],从而提高CIN及以上病变的检出率,降低假阴性率,减少漏诊率,增加细胞学与活检病理结果的一致性。
(5)通过远程网络实现辅助诊断,解决不同地理区域卫生资源不平等问题。曾有报道采用AI辅助细胞学系统对自然人群的宫颈癌筛查进行阅片[23],现国内也利用AI系统完成了70万自然人群的筛查阅片[14],由此表明该阅片模式具有可行性,潜在揭示该模式有望成为首选筛查方案,使更多LMICs人群受益。
(6)辅助规范化培训病理学专业的初学者。培训细胞学医师周期长,而AI显微镜可用于培训或成为初学者的虚拟助手。对非专业实践的学员可从教学文件或经高年资细胞学医师筛选出典型细胞学涂片,通过AI显微镜实时辅助提示异常细胞;还可标记涂片中非确定细胞以寻求指导。AI显微镜可帮助初学者更快地掌握各种异常细胞并减少假阴性,尤其LSIL及以上(LSIL+)病变[15]。
(7)数据积累。现代计算机技术的迅速进步、数据的积累可使AI系统、机器学习、神经网络学习更智能,使用更广泛。
当然机遇与挑战并存,AI细胞学辅助诊断系统真正用于临床还存在诸多的挑战[24],例如:
(1)AI兼容问题。临床上细胞学产品众多,品质参差不齐;制片方式多样,如单层膜式、多层沉降式、多层离心电片;玻片质量欠佳,如细胞分布不均、细胞重叠、涂片厚、背景模糊(黏液、细菌以及污染物)、染色质量不均衡等。
(2)扫描质量的标准化问题。目前存在扫描仪参数不同、扫描层数及时间受限、扫描倍数不统一等问题,因此欠缺可靠的扫描技术标准也是影响算法的重要因素。
(3)数据集不一。图像标注主观性强,一致性低;现有从业人员不具备相应资质,导致阅片水平不同,造成标注准确性不稳定;对于病理的有效性和正确性没有监管机制;大量的低质量甚至无效数据充斥着各个研发厂家;对于有争议的病例,并没有标准的符合和剔除规定。
综上所述,当前AI在宫颈癌筛查中的快速普及面临着数据透明度、质量及解释等方面的挑战。虽然目前有关AI细胞学辅助诊断系统的研究主要基于回顾性数据集,但相信新型的AI算法指导的前瞻性研究会将AI推向宫颈癌筛查的前沿。在未来,希望AI算法适用于各种染色方案、多种型号设备以及不同制片标准的细胞学样本,进而辅助细胞学医师尽可能识别各种组织来源的异常细胞,同时辅助诊断各类炎性疾病,自动识别各种感染性细菌以及病毒,缩短诊断周期,提高识别效率;另外,希望国家推出免费的AI图像云平台,辅助初级细胞学医师学习相关专业知识,快速提升技能,缩短学习周期,使医生有效的为更多患者服务;最后,与AI有关的伦理及法律法规问题尚待解决,需明确使用规范,使界限更加清晰,诊断结果的责任界定更加明确,结果的解释性更具说服力。
2 AI在阴道镜中的应用
在高收入国家,通过初次筛查、阴道镜检查和治疗能够有效预防CIN,使宫颈癌的发病率显著降低[25]。传统的阴道镜检查曾在指导宫颈活检中起着重要作用,但目前由于缺乏经验丰富的阴道镜医师及阴道镜医生诊断主观性大、对宫颈病变分级诊断能力低等原因,阴道镜检查已成为限制LMICs执行筛查任务的主要瓶颈问题。同时,在短时间内提升阴道医生专业能力的难度较大[26]。幸运的是,AI,尤其是基于图像识别的机器深度学习已被广泛用于医疗服务中[27-28]。AI与高清成像的阴道镜相结合,基于图像识别的自动诊断,具有提高阴道镜复制和宫颈癌筛查性能的巨大潜力。
随着互联网的普及、数据的积累、计算力的提升、算法的发展,AI技术取得了长足发展[29]。AI辅助阴道镜的研发成功提高了临床诊断效率和准确性。SATO等[30]早期进行了一次试点研究,验证了AI电子阴道镜对宫颈病变的诊断准确性达到了50%,反映了其潜在的可行性。美国国立癌症研究院学者HU等[31]采用99 843 张宫颈图像作为训练集供AI电子阴道镜学习,以病理结果为金标准,发现其识别CIN 2级和CIN 3级的受试者工作特征曲线下面积(area under the curve,AUC)分别为0.70和0.69。以324例病例作为测试数据,研究发现AI电子阴道镜辅助诊断系统识别CIN 2+级的AUC值为0.91,传统宫颈照相技术为0.69,传统细胞学为0.79,HPV 检测技术为0.82,传统宫颈照相技术与AI电子阴道镜辅助诊断系统相比差异均有统计学意义(P<0.001),该研究结果预示着AI电子阴道镜辅助诊断系统具有潜在的临床应用前景。MIYAGI等[32]研究发现采用CNN算法的AI分类模型和肿瘤学医师诊断HSIL的准确率分别为0.823和0.797,灵敏度分别为0.800和0.831,特异度分别为0.882和0.773,结果显示差异无统计学意义,但潜在表明AI分类模型的性能可能优于肿瘤学医师。该团队在第2年依旧利用该AI分类模型,通过阴道镜图像与HPV分型相结合,对经病理证实的宫颈鳞状上皮内病变进行分类,AI阴道镜结合HPV分型的AUC为0.963,灵敏度为0.956,特异度为0.833[33],进一步揭示了AI阴道镜与HPV分型相结合对HSIL/LSIL进行诊断具有可行性。CHO等[34]开发训练并验证的CNN模型用于CIN分级,目的是自动对阴道镜图像上的宫颈肿瘤进行分类,结果发现在CIN分级中Resnet-152判断高级别与低级别病变的AUC值为(0.781±0.020),需活检的病灶均在图上予以有效标注(P<0.001),该研究表明AI具有用于自动读取阴道镜图像的潜力。有学者正在积极研发AI电子阴道镜辅助诊断系统[35],有研究表明该AI模型与病理结果的符合率高于阴道镜医生与病理结果的符合率(82.2%与65.9%,P<0.001),其对HSIL及以上(HSIL+)病变的诊断灵敏度也高于阴道镜医生检查结果(71.9%与60.4%),而特异度相似(93.9%与94.9%)[36]。LIU等[37]开发并验证了一种基于深度学习的计算机辅助诊断系统模型,研究发现AI模型区分正常和LSIL+的AUC值为0.953,灵敏度为0.932,特异度为0.846;区分HSIL及以下病变和HSIL+的AUC值为0.900,灵敏度为0.823,特异度为0.800,结果表明AI模型的诊断准确度较高。因此,AI技术具有很大的前景,见表2。AI辅助诊断系统在阴道镜检查中的主要优点有:
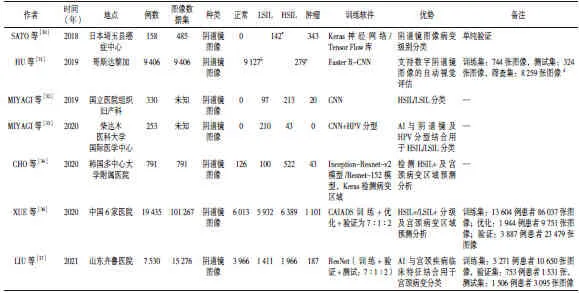
表2 AI辅助诊断系统在阴道镜检查中的应用情况Table 2 Application of AI-assisted diagnosis system in colposcopy examination
(1)不受主观因素影响。影响阴道镜诊断的主观因素众多,单凭借医生只能通过主观经验和阴道镜检查技能对结果进行判断,而AI技术可对宫颈病变图像进行动态时序分析[36],可避免主观因素的影响。
(2)提高诊断能力。AI电子阴道镜辅助诊断系统可对其诊断结果提供科学的解释依据,告知医生给出诊断的具体原因,提示医生是否需要活检以及活检数量和活检位置的确定,极大地提高医生的诊断能力。
(3)可重复性及诊断效率高。AI不受环境条件和疲劳程度的影响,可重复性及诊断效率高,不仅减轻了医生的工作负担,而且缓解了患者的就诊压力,解决了优质医疗资源分配不均等问题。
但目前AI在阴道镜辅助诊断系统的应用也面临着诸多的挑战[26]:
(1)周期较长,费用高。宫颈病变的标注和病理诊断结果的质控均需要消耗阴道镜和病理医生大量的精力,也需要细胞学专家、阴道镜专家、病理学专家、流行病专家、产品工程师、AI工程师一起跨学科合作。
(2)宫颈数据质量问题。目前LMICs的阴道镜图像需求增加,势必将产生大量阴道镜图像数据集,因阴道镜设备类型不同及检查实践中采用描述性术语不统一,需要对其标签、注释、分类及质控进行有效管理。
(3)研发动态成像AI分析的必要性。目前开发AI模型大多只采用静态阴道镜检查图像,导致提取宫颈病变特征的有效信息存在偏差,进而影响AI模型的诊断准确性。因此,如何将AI模型嵌入到现有的传统阴道镜成像设备中使其成为动态成像AI分析也是目前存在的挑战之一。
(4)AI对诊断结果的可解释性及医患关系中的责任。目前AI诊断结果的可解释性较差,AI模型的黑匣子缺乏对同业者的说服力。另外,AI对宫颈疾病的解释涉及医学伦理和法律法规等多个领域[38],诊断结果的责任界定应更加明确。
总之,AI对阴道镜的智能诊断起到重要的影响。尽管众多技术存在道德及法律等问题,但数字阴道镜与AI的结合可为宫颈癌的预防带来令人振奋的变化。AI辅助阴道镜检查除可以识别CIN病变外,还可以辅助阴道镜医师识别尖锐湿疣、外阴及阴道上皮内病变、放疗后或子宫切除后的阴道病变等多种疾病,具有广泛适用性,有望提高诊断效率。AI辅助阴道镜检查可以帮助阴道镜专家改善其诊断性能,优化临床工作流程,并减轻阴道镜医师和医院的压力。构建基于云平台的AI辅助阴道镜可以创建一个新颖的宫颈癌筛查模型,并为LMICs的许多地区提供平等的宫颈癌诊断工具。提供免费云平台供初学者学习识别更多种类的宫颈病变图像,并设立测试环节,有望在较短时间内提升其专业技能。最后,希望所有的研究机构或大学将AI算法转化为临床应用和公共卫生服务,推动AI引导的阴道镜进入健康市场,助力消除宫颈癌的全球目标。
3 AI在宫颈恶性肿瘤诊断及预后预测过程中的应用
HU等[31]使用神经网络系统在阴道镜图像中确定受检者是否存在严重宫颈发育不良,该方法优于子宫动脉造影。因此,AI使得“即查即治”的方法成为可能,特别是在缺乏病理学专业知识及可靠的持续性护理的低资源环境中。
近些年,有些学者利用MRI图像来预测宫颈癌分期的研究。SOUMYA等[39]构建了非线性支持定量机(support vector machine,SVM)分类模型,通过24例MRI图像预测局部晚期宫颈癌的诊断及临床分期,结果发现T2矢状图像与T1及T2轴向图像相比,T2矢状图像预测准确率最高(81%)。NITHYA等[40]使用5种机器学习算法对宫颈癌的诊断准确率为97%,其中C5.0和随机森林分类器表现相当好。WANG等[41]构建了SVM模型,用于预测根治性子宫切除术证实的淋巴结转移,该模型与96例患者根治性子宫切除术前的MRI T2加权像(T2WI)和扩散加权成像(DWI)特征相结合,预测淋巴结转移的AUC为0.89,进而能够预测辅助化疗、放疗或免疫治疗中受益的患者。MATSUO等[42]依据宫颈癌复发患者的基线特征和实验室检查数据预测患者的3个月及6个月生存率,结果发现157例患者中102例复发宫颈癌患者死于宫颈癌(65%),AI模型预测患者生存率的AUC为0.74;此外,结果还发现AI模型的预测效果优于线性回归模型。MATSUO等[43]还通过768例宫颈癌患者的肿瘤特征和实验室检查数据来预测患者的无进展生存期和总生存期,结果发现AI模型的预测能力优于Cox比例风险回归模型[44]。
综上所述,AI在宫颈恶性肿瘤的诊断及预后预测中取得了实质性的突破,详见表3。但仍存在以下的问题:

表3 AI在宫颈恶性肿瘤的诊断及治疗预后中的应用Table 3 Application of AI in the diagnosis and prognosis of cervical malignancy
(1)数据集相对较少[45-47]。目前大多数研究数据集单一,缺乏代表性,PERGIALIOTIS等[46]建议在未来可采用国家和国际环境中的多中心研究,获取大量患者的数据信息,有助于构建稳健的算法。
(2)单中心回顾性研究的数据集规模小且缺乏外部验证。ACHARYA等[48]建议使用更大的、高质量的数据库进一步验证所提出算法的准确性 。
(3)对某一领域的不熟悉可能会成为研究本身的技术障碍。ZHANG等[49]指出目前更严峻的挑战是深度学习专家的临床知识有限和临床专家的深度学习知识有限。
基于以上现存的挑战,目前在宫颈癌的诊断及治疗的临床实践中,更多的是依靠临床医生的精准判断、采取适宜的治疗方案来提高患者生存率。希望未来出现具有多中心并包含MRI/CT/正电子发射计算机断层显像临床参数的大样本数据,通过测试优化及内外部验证,使得AI在宫颈癌诊治中的应用更具有说服力。同时,应注重建立免费AI的云服务平台,使初学者尽快提升专业技能,辅助医技人员的诊断决策,给予临床医师相应的指导建议,使其成为“多能一专”的临床医师,从而更好地服务更多患者。有必要强调的是,在使用AI相关产品过程中应通过有关法律、法规明确伦理及责任问题,重点指出AI仅起辅助作用,而非起决定作用。
4 结语
随着计算机技术的飞速发展,AI已经应用于医学领域的各个方面,希望未来的AI相关产品可以适用于各种设备、各种试剂,具有泛化能力且高质量的临床性能。建立免费的AI云服务平台,提供诊断解释依据,并给予重点标记,以供相关专业的初学者学习,缩短学习周期,使更多的患者受益。使AI在宫颈癌防控领域具有更多的用途,减少医务人员工作负担的同时提高诊断准确性及效率。明确AI的可解释性及伦理责任问题,制定更加清晰且明确的使用规范,使AI更好地为人类健康服务。
作者贡献:武爱媛进行文章的构思与设计,提出主要分析指标,负责检索文献、撰写论文;热米拉·热扎克进行论文的修订、质量控制及审校;乔友林对文章整体负责,监督管理。
本文无利益冲突。
本文链接:
人工智能(AI)已广泛应用于各个领域,如面部识别、自动驾驶汽车等,本文在医学领域中也应用广泛,如视网膜图像辅助诊断糖尿病性视网膜病变,临床图像辅助诊断皮肤病变等,本文重点介绍AI在宫颈病变的筛查、诊断及临床治疗预后方面中的应用进展与挑战。通过AI与细胞学图像、阴道镜图像、宫颈肿瘤的磁共振、计算机断层扫描、正电子发射计算机断层显像图像相结合,首先,可辅助医师提高其诊断准确性及病变检出率,达到提升工作效率的目的;其次,AI可协助基层医院及初级医师,提高诊断效率,缩短诊断周期;最后,利用AI可预测宫颈恶性肿瘤的临床分期、淋巴结转移、复发及临床预后等。
AI在应用过程中仍面临诸多挑战:(1)AI对设备、试剂、图像的兼容问题;(2)AI的训练、验证及测试需大量且高质量的图像;(3)AI对诊断结果的可解释性及医患关系的责任问题。

