血流感染凝固酶阴性葡萄球菌的耐药性及耐药基因检测
李 磊,王延梅
1.滕州市疾病预防控制中心艾滋病防治科,山东滕州 277599;2.滕州市妇幼保健院儿童康复科,山东滕州 277599
随着重症患者高强度抗菌药物的广泛使用和介入等相关开放性操作的广泛开展,凝固酶阴性葡萄球菌(CNS)所致的血流感染发病率逐渐升高并且呈现出明显的多重耐药性,这不仅增加了治疗的困难程度和成本,而且潜在的院内交叉感染趋势给医院感染管理提出了新的挑战[1-3]。有文献报道,CNS在革兰阳性球菌所致的感染中,检出率占比逐年升高,已达革兰阳性球菌总检出率的30%以上,特别是耐甲氧西林的CNS(MRCNS),其所占比例高达90%,故对CNS进行耐药基因的研究逐渐成为临床关注的重点[2,4]。亦有研究指出,在重症患者中,特别是老年和儿童患者,在接受介入治疗或者存在留置通道的情况下,其MRCNS的感染更加普遍[5],由于该类患者在药物的选择使用上受到更多的限制,故迫切需要更多耐药基因的相关研究,以更加全面地认识相关菌株和更好地服务临床。本研究尝试探讨血流感染CNS的耐药性和耐药基因,并对可能发生的MRCNS血流感染进行危险因素分析。
1 材料与方法
1.1菌株来源 选择2017年1月至2020年1月临床分离的CNS菌株共107株。详细记录每株菌株的来源,对应患者的一般资料,包括体温、白细胞数量、基础疾病、导管使用、血清降钙素原水平、血培养报阳时间、血培养送检次数和阳性次数、抗菌药物使用和预后转归情况,根据文献判断其是否为污染菌[6]。将血培养分离的CNS菌株均转种于菌株保存管,置于-70 ℃冰箱冻存,行双人双锁管理并进行使用登记和记录。
1.2菌株鉴定和药敏试验 使用美国BD公司的全自动血培养仪进行血液培养,血培养报阳后记录报阳时间,并进行革兰染色镜检和报阳瓶的菌株分离培养,进入病案系统记录患者的相关临床资料,分离培养后的纯菌落使用质谱仪(布鲁克公司)进行细菌鉴定。完成鉴定的菌株进行体外药敏试验,采用纸片扩散法(Kirby-Bauer纸片扩散法)和E-test法进行药敏试验,药敏纸片来自Oxoid公司,E-test试剂条来自郑州安图生物工程股份有限公司,营养琼脂平板使用MH平板,购买自广州迪景微生物科技有限公司。药敏结果根据美国临床实验室标准化协会2020年版(CLSI-2020)的标准进行判定。耐甲氧西林的判定亦采用CLSI-2020的标准。质控菌株为金黄色葡萄球菌(ATCC25923和ATCC43300),购买自国家临床检验中心。
1.3耐药基因检测
1.3.1菌株DNA的制备 首先将菌株保存管复温,并挑取少量的CNS菌悬液接种于MH平板上,培养16 h后,选取单个CNS菌落全部溶于含溶菌酶的核酸溶解缓冲液(TE)中,振荡后37 ℃处理30 min,随后100 ℃处理15 min,最后以12 000 r/min高速离心10 min,取上清液,-20 ℃保存待用,相关试剂购买自天根生化科技(北京)有限公司。
1.3.2基因扩增体系与条件 基因扩增的仪器使用珠海黑马扩增仪,试剂使用赛默飞世尔的全套试剂,包括DNA聚合酶(Taq酶)、脱氧核糖核苷酸(dNTPs)、镁离子等。扩增体系设定为25 μL,其中包括2倍浓度的预混溶液12.5 μL,Taq酶1 μL,正反向引物各1 μL,细菌DNA 1 μL,无菌双蒸水补足总体系至25 μL,混匀电离后放入扩增仪中。反应条件设置为:95 ℃预变性5 min;95 ℃变性30 s、52 ℃退火30 s、72 ℃延伸45 s,共35个循环;最后72 ℃延伸5 min,同时设置阴性对照和阳性对照。阴性对照无DNA模版,其他成分均相同;阳性对照是含目的基因片段的DNA基因组。根据是否扩增出目的条带来确定基因阳性菌株,扩增产物进行1.5%凝胶电泳,紫外线灯下观察扩增产物并记录结果。
1.3.3耐药基因引物 检测耐药基因的引物,包括耐β-内酰胺酶类基因mecA、耐四环素类基因tetM、耐氨基糖苷类基因aac(6′)/aph(2′)和aph3′-Ⅲ、耐大环内酯类基因ermA和ermC、耐消毒剂类基因qacA/B/C和耐喹诺酮类基因gyrA。基因引物见表1。

表1 PCR引物序列与产物长度
1.4统计学处理 使用Whonet5.0软件对107株CNS菌株进行耐药性分析,数据分析使用SPSS17.0统计软件。计数资料以例数或百分率表示,比较采用χ2检验或者Fisher检验;不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用秩和检验;采用Logistic回归进行影响因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1菌株特征 107株菌株均从患者血培养中分离,其中表皮葡萄球菌42株,溶血葡萄球菌31株,人葡萄球菌23株,头状葡萄球菌11株。107株中最终确定为感染菌株70株(感染组),37株为可疑污染菌株(可疑组),即根据患者的临床表现和检查结果等判断,污染的可能性大,但仍然执行药敏试验,报告药敏结果,可疑污染菌株占比为34.6%。菌株来源患者的性别分布为男63例,女44例;科室分布为重症监护室64例,肾内科23例,神经外科8例,儿科8例,其他科室4例。70株感染菌株中MRCNS为53株,37株可疑污染菌株中MRCNS为32株,两组MRCNS所占比例的差异有统计学意义(P<0.05)。
2.2两组菌株耐药性的比较 两组菌株在青霉素G、克林霉素、红霉素、呋喃妥因、万古霉素、利奈唑胺、替考拉宁以及奎奴普丁/达托霉素的比较中,耐药率差异无统计学意义(P>0.05)。在庆大霉素、左旋氧氟沙星、环丙沙星、莫西沙星、复方磺胺甲噁唑和四环素的比较中,感染组的耐药率明显低于可疑组,差异有统计学意义(P<0.05),见表2。

表2 两组菌株耐药性的比较
2.3两组菌株的耐药基因携带率比较 两组菌株耐β-内酰胺酶类基因mecA、耐氨基糖苷类基因aph3′-Ⅲ、耐大环内酯类基因ermA和ermC的携带率比较,差异无统计学意义(P>0.05);而在耐喹诺酮类基因gyrA、耐四环素类基因tetM和耐氨基糖苷类基因aac(6′)/aph(2′)的携带率比较中,可疑组明显高于感染组,差异有统计学意义(P<0.05);感染组耐消毒剂类基因qacA/B/C的携带率为62.9%,明显高于可疑组,差异有统计学意义(P<0.05)。见表3。
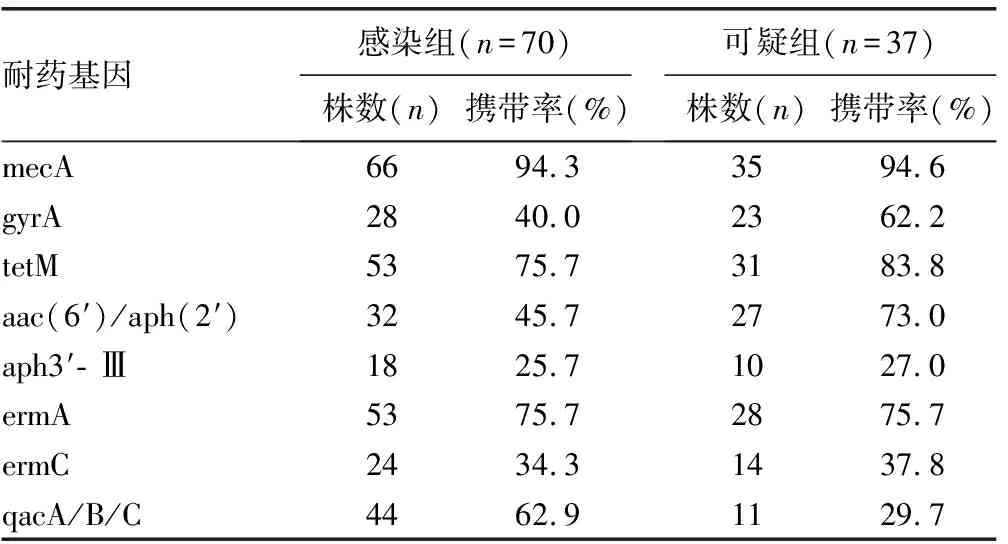
表3 两组菌株的耐药基因携带率比较
2.4耐药基因mecA的PCR电泳图 将耐药基因mecA进行PCR扩增,然后进行凝胶电泳成像,可见11条泳道,从左至右分别是指示条带M(分别为50、100、150、300、500、600、1 000、1 500 bp),阴性对照N,检测菌株S,阳性对照P,检测菌株S和阴性对照N。见图1。

注:M为指示条带,N为阴性对照,S为待测菌株,P为阳性对照。
2.5两组菌株的消毒剂最小抑菌浓度比较 未携带qacA/B/C基因的两组菌株对苯扎溴铵、氯己定和戊二醛的最小抑菌浓度比较,差异无统计学意义(P>0.05)。感染组携带qacA/B/C基因的菌株,其最小抑菌浓度明显高于可疑组(P<0.05)。见表4。

表4 两组菌株的消毒剂最小抑菌浓度比较[M(P25,P75),μg/mL]
2.6影响患者临床结局的单因素Logistic回归分析 以患者死亡或者放弃治疗为不良转归,以好转出院或者转入普通病房为良好转归,分析两组患者的年龄、性别、耐药基因携带等临床资料对转归结局的影响,回归分析发现,年龄和qacA/B/C基因是CNS感染患者临床结局的影响因素(P<0.05)。见表5。

表5 影响患者临床结局的单因素Logistic回归分析
3 讨 论
随着血流感染相关诊疗技术的不断发展,CNS的感染越来越受到重视,虽然血培养相关诊疗指南中关于CNS的解读仍然较为谨慎,初次单套单瓶检出的CNS是污染菌的可能性大,但是临床更加倾向于继续进行鉴定和药敏试验,并根据药敏结果和患者的临床资料进行全面判断[2]。从本研究也可以看出,CNS的检出主要集中于重症和儿童患者,这类患者具有明显的潜在感染可能,原因可能是抵抗力低下、静脉通道开放和高强度抗菌药物的使用[7]。本次纳入研究的107株CNS中确定是感染菌株的有70株,可疑污染菌株37株,占比为34.6%,这说明血培养检出的CNS中65.4%是感染菌,其所占的比例较高,及早地报告药敏结果和选择合适的敏感药物具有明显的积极意义,这也为临床相关诊疗提供建议,即需要对血培养检出的CNS给予足够的重视。
在本研究中,将感染组和可疑组进行分组比较,发现两组菌株的抗菌药物耐药率存在明显的差异,在庆大霉素、左旋氧氟沙星、环丙沙星、莫西沙星、复方磺胺甲噁唑和四环素的比较中,感染组的耐药率明显低于可疑组(P<0.05)。这可能是由多方面的原因导致的,其一,感染组和可疑组的菌株数均不足,在小样本中,差异可能被放大;其二,两组菌株的来源不同,故其耐药性存在差异;其三,两组菌株耐药基因携带率不同,故其耐药性不同[8-12]。随后,研究者观察其耐药基因的携带情况,结果显示,在耐喹诺酮类基因gyrA、耐四环素类基因tetM和耐氨基糖苷类基因aac(6′)/aph(2′)的携带率比较中,可疑组明显高于感染组(P<0.05),说明可疑组具有更高的耐药基因携带率,而且同一菌株携带多种耐药基因的现象亦存在,这需要给予更多关注[10,13-16]。tetM基因的耐药机制主要是编码外排泵蛋白和核糖体保护蛋白,gyrA基因的耐药机制主要是改变酶的空间结构,阻止药物进入作用区和改变喹诺酮-酶-DNA的复合物进而失效,aac(6′)/aph(2′)基因的耐药机制主要是产生钝化酶,使药物钝化失活[17]。
本研究结果显示,感染组的耐消毒剂类基因qacA/B/C携带率明显高于可疑组(P<0.05),说明感染组菌株具有更加明显的抗消毒剂能力。抗消毒剂能力的获得主要是靠消毒剂外排蛋白的产生,由qac家族基因表达,其主要是qacA、qacB和qacC 3种。有研究指出,CNS的qacA、qacB和qacC在超过50%的菌株质粒中存在,在本研究中检出比例为62.9%,高于文献报道,说明耐消毒剂类基因的携带正在变得越来越普遍[18-20]。耐消毒剂类基因的检出给临床工作者强烈的提示,菌株有获得耐消毒剂的能力,需在保护患者的同时注意自身防护。本研究还对3种消毒剂的最小抑菌浓度进行比较,发现感染组携带qacA/B/C基因的菌株其消毒剂最小抑菌浓度明显高于可疑组(P<0.05),说明需要对CNS菌株的耐消毒剂类基因检测和控制给予更多的关注[21]。本研究经Logistic回归分析发现,年龄和qacA/B/C基因是CNS感染患者临床结局的影响因素。
综上所述,血流感染的CNS在药物耐药性、耐药基因携带和耐消毒剂水平方面存在明显的特点,携带qacA/B/C基因的CNS血流感染患者转归不良,应给予足够重视。

