绞股蓝皂苷减轻脂多糖诱导大鼠肾上腺嗜铬细胞瘤细胞系PC12损伤
姜秀芳,耿亚楠,阳盛洪,魏 平,赵 名*,朱玲玲*
(1.军事科学院军事医学研究院 军事认知与脑科学研究所, 北京 100850; 2.中国人民解放军陆军第957医院,西藏自治区 阿里地区 859000)
炎性反应是多种生理和病理过程的基础,是生物体对各种有害刺激(如有害刺激物、受损细胞和病原体等)的防御机制。通常,由于炎性反应具有从原始刺激和炎性反应中消除受损组织或坏死细胞的功能,因此认为炎性反应对于自我愈合和修复具有积极的意义。然而,过度或不受控制的炎性反应对生物体是有害的,并可能引发炎性疾病[1]。对于脑这一特殊器官来说,炎性反应被广泛认为是神经功能退化的主要原因[2]。动物模型和遗传学研究结果表明,神经退行性疾病发生发展过程中通常伴有神经组织的免疫信号失调、炎性分泌因子水平改变以及神经胶质细胞的异常活化[3]。因此,减轻或抑制炎性反应是防治多种脑疾病的重要策略。
绞股蓝皂苷(gypenoside, GP)是中药绞股蓝的主要药理活性成分。细胞和动物实验结果表明,绞股蓝皂苷具有多种生理活性,包括免疫调节、抗缺血、降血脂、抗氧化等[4-5]。以往研究报道发现绞股蓝皂苷可通过抗感染活性而表现出抗焦虑或抗抑郁样的效应[6-7]。但绞股蓝皂苷对神经元炎性损伤的影响及分子机制尚不清楚。本文以LPS诱导PC12细胞建立神经元炎性损伤模型,研究绞股蓝皂苷对神经元炎性损伤的影响及分子机制,研究结果将为其用于防治神经炎性反应疾病提供实验依据。
1 材料与方法
1.1 材料与试剂
绞股蓝皂苷(中国科学院兰州化学物理研究所杨军丽实验室制备,纯度≥98%)。将绞股蓝皂苷溶解于无菌水中,配成30 mg/mL的溶液备用。RPMI1640(Gibco);胎牛血清(Ausbian);LPS(Sigma-Aldrich公司);CCK-8试剂盒(日本同仁化学研究所);Trizol(Thermo-Fisher公司)。反转录试剂盒HiScript®Ⅲ RT SuperMix for q-PCR和实时定量PCR反应预混液ChamQTM SYBR®q-PCR Master Mix(南京诺唯赞生物科技股份有限公司)。蛋白裂解液Laemmli Sample Buffer(Bio-Rad公司),BCA蛋白定量试剂盒(北京普利莱基因技术有限公司)。p-p65、t-p65一抗以及抗鼠或兔二抗(Cell Signaling Technology公司);β-actin一抗(Sigma-Aldrich公司);PC12细胞(中国医学科学院基础医学研究所细胞资源中心)。
1.2 方法
1.2.1细胞的培养及分组处理:将PC12细胞培养于含10%胎牛血清的RPMI1640完全培养液中,在5% CO2培养箱中饱和湿度条件下37 ℃常规培养,每2~3天传代或换液1次。将PC12细胞分为对照组、LPS处理组、不同剂量(30、100 μg/mL)绞股蓝皂苷干预组和绞股蓝皂苷干预联合LPS处理组。
1.2.2 CCK8法测定细胞活力:将处于对数增殖期的PC12细胞用胰蛋白酶消化计数,以5 000个/孔接种于96孔板中,经各实验组处理完毕后,每孔各加入10 μL的CCK-8溶液,轻轻晃动摇匀,将培养板放入培养箱中继续孵育1 h,然后用酶标仪测定450 nm的吸光值(A)。以对照组细胞的细胞活力为100%,计算各实验组的细胞活力。
1.2.3 实时定量PCR检测炎性因子mRNA的表达水平:收集各组细胞样品,采用Trizol法提取总RNA,应用UV5nano紫外可见分光光度计进行定量,取1 μg总RNA采用HiScript®Ⅲ RT SuperMix for q-PCR试剂盒进行反转录反应,然后采用ChamQTM SYBR® q-PCR Master Mix预混液在C1000 Touch Thermal CyclerPCR仪上进行实时定量PCR反应。PCR程序参照试剂盒提供的两步法进行:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,共40个循环。各组实验独立重复3次。以β-actin作为内参基因,用2-ΔΔCt法计算各处理组目的基因的相对表达量,将对照组的相对表达量设定为1,各处理组是相对于1的变化倍数。采用Primer3(Version4.1.0)在线设计各目的基因的上下游引物,如表1所示。

表1 引物序列Table 1 Primer sequence
1.2.4 Western blot检测p-p65蛋白:收集各处理组细胞样品,加入Laemmli Sample缓冲液充分裂解后煮沸变性10 min;然后4 ℃、12 000 r/min离心10 min,上清即全细胞裂解液。采用BCA法进行蛋白定量。各处理组取20 μg蛋白进行SDS-PAGE电泳。PVDF膜转印后,将膜放在5%脱脂奶粉中室温封闭1 h;TBST洗涤3次后,加入适当稀释于5%脱脂奶粉中的一抗,并4 ℃孵育过夜。TBST洗涤3次,然后加入辣根过氧化物酶偶联的二抗(1∶2 000稀释)室温孵育2 h,洗涤后在暗室中进行显影定影。
1.3 统计学分析

2 结果
2.1 不同剂量的LPS对PC12细胞炎性反应的影响
经不同剂量的LPS刺激后,TNF-α和IL-1β mRNA水平均显著上调,IL-6的mRNA水平在300 ng/mL的LPS刺激下才发生明显上调。因此,在后续的实验中,300 ng/mL的 LPS被用于构建PC12细胞的神经炎性反应模型(图1)。
2.2 绞股蓝皂苷预处理减轻LPS刺激导致的PC12细胞活力下降
与对照组相比,LPS组的细胞活力下降到85.7%(P<0.01),绞股蓝皂苷单独处理对PC12细胞活力没有影响,却可以减轻LPS所导致的细胞活力下降(P<0.01)(图2)。
2.3 绞股蓝皂苷预处理减轻LPS诱导的PC12细胞炎性反应
LPS组的炎性细胞因子TNF-α、IL-1β和IL-6表达水平显著高于空白对照组(P<0.01),绞股蓝皂苷预处理后,TNF-α、IL-1β和IL-6表达水平均显著低于LPS模型组(P<0.01)(图3)。
2.4 绞股蓝皂苷预处理对LPS诱导的PC12细胞内NF-κB信号通路的影响
LPS可导致p-p65的蛋白水平上调,但t-p65蛋白水平保持不变,提示NF-κB信号通路受到了活化,不同剂量的绞股蓝皂苷预处理后,可以剂量依赖性的下调p-p65的蛋白水平(图4)。

*P<0.01 compared with control图1 不同剂量LPS刺激对PC12细胞中TNF-α、IL-1β、IL-6 mRNA水平的影响
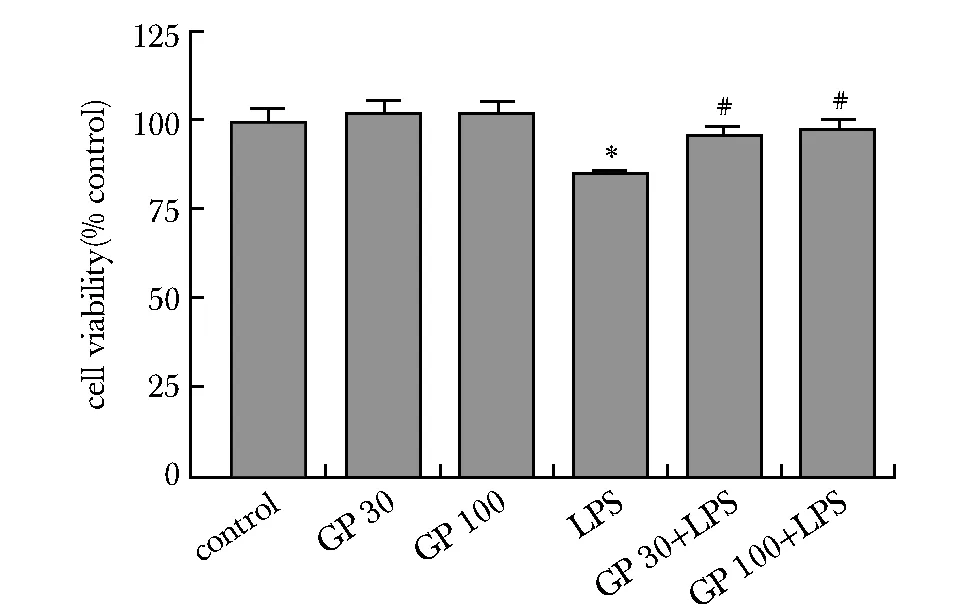
*P<0.01 compared with control; #P<0.01 compared with LPS treatment alone图2 CCK-8法检测PC12细胞活力的变化Fig 2 Change of PC12 cell viability detected by CCK-8 assay n=4)
3 讨论
LPS诱导的大鼠肾上腺髓质嗜铬细胞瘤PC12细胞炎性反应模型被国内外多家实验室用来研究神经元炎性损伤的研究。例如,基于该细胞模型评价了新型环氧合酶2抑制剂对神经炎性反应的抑制作用[8]。利用该模型评价了天然产物樟芝多糖对神经细胞炎性反应的调节作用[9]。在本实验体系中,LPS也同样可以对PC12细胞造成细胞活力下降、炎性因子上调等损伤性反应,进一步证明该细胞模型的稳定性和可重复性,为进一步研究绞股蓝皂苷预处理对神经元炎性损伤的影响奠定了良好基础。
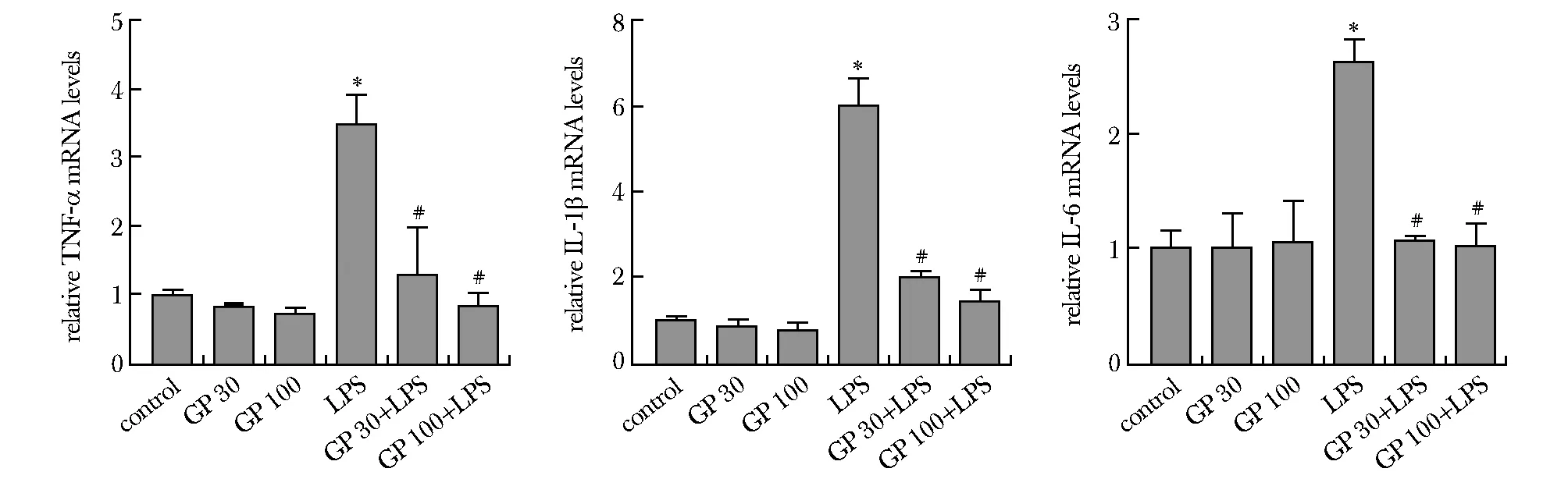
*P<0.01 compared with control; #P<0.01 compared with LPS treatment alone图3 GP预处理对PC12细胞中炎性因子TNF-α、IL-1β和IL-6 mRNA水平的影响
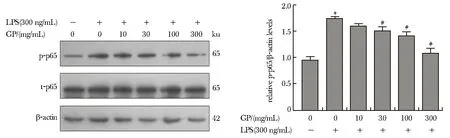
*P<0.05 compared with control; #P<0.05 compared with LPS treatment alone图4 绞股蓝皂苷预处理对LPS诱导的PC12细胞内NF-κB信号通路的影响Fig 4 Effect of GP on the activity of NF-κB signaling pathway in PC12 cells stimulated by LPS n=3)
LPS作为一种细菌内毒素可以激活许多与炎性反应发生相关的细胞,引起炎性因子的合成以及释放,最终导致生物体全身炎性反应的发生。LPS首先与细胞膜表面的Toll样受体-4(Toll-like receptor 4, TLR4)结合,然后激活胞质内IKK/NF-κB信号通路,进而调节多种细胞因子的表达[10]。在LPS诱导的大鼠炎性反应和记忆障碍模型中,绞股蓝皂苷预处理能够降低海马中促炎因子的水平,该作用与其降低诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和 TLR4水平有关[11]。在本研究中,发现绞股蓝皂苷能够抑制PC12细胞内LPS所诱导的NF-κB信号通路,同时降低TNF-α、IL-1β和IL-6等炎性因子的mRNA水平,从而产生抗炎活性。
神经炎性反应是多种神经系统疾病的主要原因,例如脑外伤、缺血性中风和阿尔茨海默病。炎性小体诱导先天性免疫应答、建立脑内慢性炎性反应环境、引起神经元功能障碍并最终导致神经变性[12]。因此,新型抗炎药物的研究成为当前有关神经退行性疾病的研究热点。本研究证实了绞股蓝皂苷预处理能够拮抗LPS导致的PC12细胞炎性损伤,表现在一是LPS所导致的细胞活力下降得到了恢复,二是LPS诱导的TNF-α、IL-1β和IL-6等炎性细胞因子表达上升得到了抑制。此外,绞股蓝皂苷对低氧性脑损伤具有保护作用[13]。以上研究结果表明绞股蓝皂苷在神经系统疾病的防治中具有良好的应用前景。
志谢:感谢中国科学院兰州化学物理研究所杨军丽教授提供的绞股蓝皂苷。

