青霉素结合蛋白3编码基因ftsI在多重耐药鲍曼不动杆菌中表达及碳青霉烯类诱导对其表达的影响
游铠旭,魏 星,徐 革(成都医学院第三附属医院/成都市郫都区人民医院检验科,成都 611730)
鲍曼不动杆菌(Acinetobacter baumannii,AB)是医院感染最常见的病原菌之一,根据2018年全国耐药检测网数据显示[1],鲍曼不动杆菌检出227 091株(位居革兰阴性菌第四位),其对碳青霉烯类药物耐药率高达56.1%,给临床治疗带来极大的挑战。目前研究发现[2],鲍曼不动杆菌产生耐药的主要机制有以下4个方面:①细菌合成灭活酶和修饰酶[3-4];②细胞外膜通透性下降;③外排泵的主动外排活性增加;④抗生素作用的靶位发生改变,如青霉素结合蛋白(penicillin binding protein,,PBPs)功能改变等[5]。最后一种机制相关研究较少。PBPs于1972年由WILKE等[6]首次报道,因其能与青霉素共价结合而得名。PBPs是细菌胞浆膜上的微小蛋白质,β 内酰胺类抗生素可专一的与细菌PBPs结合,使肽聚糖的合成受到抑制,破坏细菌细胞壁,导致其死亡。若细菌PBPs含量或结构发生变化,可导致其与抗生素的亲和力下降,细菌产生耐药[7-8]。鲍曼不动杆菌含有7种PBPs[9],其中ftsI编码PBP3,作为一种转肽酶[10],参与细菌肽聚糖合成,也是β-内酰胺类抗生素的结合位点。最新研究[11-13]发现ftsI在多种细菌耐药中起主要作用。但有关鲍曼不动杆菌中PBP3编码基因ftsI的相关研究较少,课题组前期[14]对鲍曼不动杆菌中PBP1a编码基因ponA进行了相关研究,发现多重耐药鲍曼不动杆菌(multi drug resistantAcinetobacter baumannii,MDR-AB)中PBP1a 蛋白构象不同于敏感株(SDF);碳青霉烯类抗生素诱导可导致MDR-AB中ponA 基因表达下调,在此基础上,本文进一步检测MDR-AB中ftsI携带情况,分析与SDF株的空间结构差异,探究碳青霉烯诱导对ftsI表达的影响,从基因水平上对ftsI在MDR-AB耐药中的作用进行初步了解,现报道如下。
1 材料与方法
1.1 菌株来源 采集2019年1月~6月成都市郫都区人民医院经临床分离所得MDR-AB,待将重复菌株剔除后,合计得到38株菌株。其中26株(68.42%)源自痰液,6株(15.79%)源于血液,4株(10.53%)源于分泌物,2株(5.26%)源于尿液。38株菌对庆大霉素(GEN)、美罗培南(MEM)、妥布霉素(TOB)、亚胺培南(IMP)等抗生素耐药率较高,达70%以上;对头孢哌酮/舒巴坦(SCF)的耐药率为57.89%。没有检出对多黏菌素B(POL)耐药的菌株。质控菌株为大肠埃希菌(E.coli)ATCC25922与铜绿假单胞菌(P.Aeruginosa)ATCC27853。
1.2 仪器与试剂 抗生素亚胺培南(imipenem)、美罗培南(meropenem)、多尼培南(donipenem)购于北京索莱宝;DNA提取试剂盒,总RNA提取试剂盒,qRT-PCR试剂购于大连 Takara 公司。所用仪器为实时荧光定量PCR仪(上海宏石产品),在菌株鉴定与药敏方面,所应用的仪器为细菌鉴定与药敏分析仪(国产美华,MA120型)。
1.3 方法
1.3.1 ftsI基因检测:将收集的鲍曼不动杆菌菌株取出,室温复苏,在巧克力平板上分区划线,37℃培养18~20h,之后挑取单菌落于含200μl 无菌超纯水的离心管中,按细菌DNA提取试剂盒说明书步骤提取鲍曼不动杆菌DNA。ftsI编码基因长度为1 977 bp,长度较长,采用分段扩增的方式进行PCR。借助GeneBank与NCBI查询鲍曼不动杆菌(AB)ftsI基因序列,借助软件primer 5.0完成引物的设计,其合成工作则由上海生工负责。引物序列见表1。PCR反应体系借鉴前期实验条件开展,PCR反应量为0.05ml,条件:预变性 5min,95℃;变性,30s,94℃;退火,30s ,55℃;延伸,30s,72℃;合计35个循环。准备5μl扩增产物,用来进行琼脂糖凝胶(1g/dl)电泳处理,计时10 ~20min。
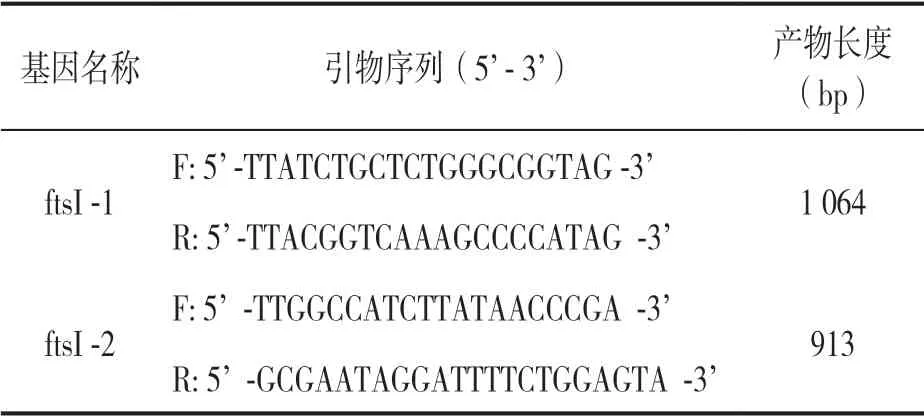
表1 检测ftsI基因引物序列
1.3.2 测序分析:将38株MDR-AB扩增后的PCR条带切胶回收,送上海生工进行测序分析。所测得ftsI基因序列,用DNAMAN软件拼接成后通过Chromas软件读取,使用BLAST Search进行比对。
1.3.3 耐药菌株与敏感株(SDF)ftsI编码蛋白结构比较:选择菌株MDR-AB-1作为代表菌株进行研究,将MDR-AB-1 与敏感株(SDF )ftsI基因序列翻译成的氨基酸序列通过Swiss-Model Workplace进行同源建模(模板为PDB.4kqr.1.A亚单位),Swiss-Pdb Viewer 4.0作相似性分析。作为比对的敏感株(SDF)来源:(SDF, NC-010400.1,European Bioinformatics Institute,) ,ftsI基因序列下载自基因组数据库(www.biocyc.org)。
1.3.4 碳氢霉烯类诱导过程观察:自1.3.1步骤已复苏菌株中挑单菌落洗脱到LB液体培养基(10ml)内,35℃振荡培养16~18h,取菌液5ml转入12孔细菌培养板中,分别添加1类碳青霉烯类抗生素(亚胺培南、美罗培南、多尼培南)当做诱导剂,调整抗生素最终浓度为1mg/L,作用1h后,将菌液吸入无菌离心管,15 000r/min离心10min,吸弃上清液并收集细菌待下一步试验。
1.3.5 qPCR定量检测ftsI表达:使用逆转录实时荧光定量聚合酶链式反应(qRT-PCR)对诱导前后鲍曼不动杆菌青霉素结合蛋白3 (PBP3)编码基因ftsI转录的mRNA进行定量检测。根据RNA提取试剂盒所示步骤,完成细菌RNA的提取收集。取模板5μl加入反应体系及引物,总体积为20μl,扩增。内参基因是16sRNA,引物序列如下[14]:F: 5’-CAGCTCGTGTCGTGAGATGT-3’;R:5’-CGTAAGGGCCATGATGACTT-3’,反应条件:逆转录环节,42℃,60 min;预变性环节,95℃,1min;变性环节,94℃,0.5 min;退火环节,56℃,20s;延伸环节,72℃,0.5min;荧光收集,80℃,8 s,合计安排35个循环。采用相对定量(2-△△Ct)法计算鲍曼不动杆菌ftsI在碳氢霉烯类诱导前后表达情况。将抗生素诱导后检测的Ct值作为试验组,对应的诱导前的Ct值作为对照组,内参基因的Ct值作为参考,根据实时定量PCR反应数据,计算ftsI基因的相对表达情况,并与对照组作出比较。数据用三个复孔Ct值的平均数,具体的计算方法如下:
ΔCt试验组=Ct试验组ftsI基因-Ct试验组16sRNA基因
ΔCt对照组=Ct对照组ftsI基因-Ct对照组16sRNA基因
-ΔΔCt=ΔCt对照组-ΔCt试验组
2-△△Ct值为ftsI基因的表达差异。
1.4 统计学分析 使用 SPSS 21.0 统计软件,采用方差分析对多组间数据比较,数据表示方式为均数±标准差(±s),结果为P<0.05说明对比组之间的差异有统计学意义。
2 结果
2.1 鲍曼不动杆菌ftsI基因表达及突变情况
2.1.1 ftsI基因扩增结果:部分菌株凝胶电泳结果见图1。由于ftsI基因长度约2 000bp,因此采用分2段扩增的方法,均扩增出ftsI基因。
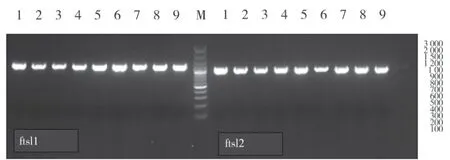
图1 部分菌株ftsI凝胶电泳图
2.1.2 测序分析:将38株MDR-AB测序结果均一致,与美国国立生物信息中心GenBank 中标准菌株ATCC 17978 ftsI基因(登录号为CP000521.1)序列号进行比较,99.54%同源,仅第1544位的C>T。
2.1.3 MDR-AB-1菌株与SDF株ftsI基因序列分析和氨基酸同源建模分析:将MDR-AB-1株 ftsI基因序列与SDF株序列相比较,99%同源,存在7处差异。分别是第186位A>G,第255位G>A,第395位G>C,第496位A>G,第685位C>T,第771位A>G和第820位A>T。
将基因序列翻译成的氨基酸序列进行同源建模(模板为PDB.4kqr.1.A亚单位)Swiss-Pdb Viewer 4.0作相似性分析,见图2。图中,MDR-AB-1菌株ftsI编码蛋白PBP3空间结构由红色表示,SDF菌株PBP3空间结构由白色表示,MDR-AB-1菌株PBP3空间结构与SDF菌株存在的差异主要是SDF菌株多出251号位赖氨酸,252号位苏氨酸,253号位甘氨酸和254号位缬氨酸组成的一个无规则卷曲部分。

图2 MDR-AB-1株与SDF株PBP3蛋白分子三维立体结构比较
2.2 碳氢霉烯诱导后耐药菌株fstI基因表达检测 见表2。38株鲍曼不动杆菌经三种碳青霉烯诱导后,MDR-AB基因表达相对于未处理组均出现不同程度的变化,亚胺培南组、美罗培南组ftsI表达下调,差异有统计学意义(P<0.05),多尼培南组诱导变化不明显。
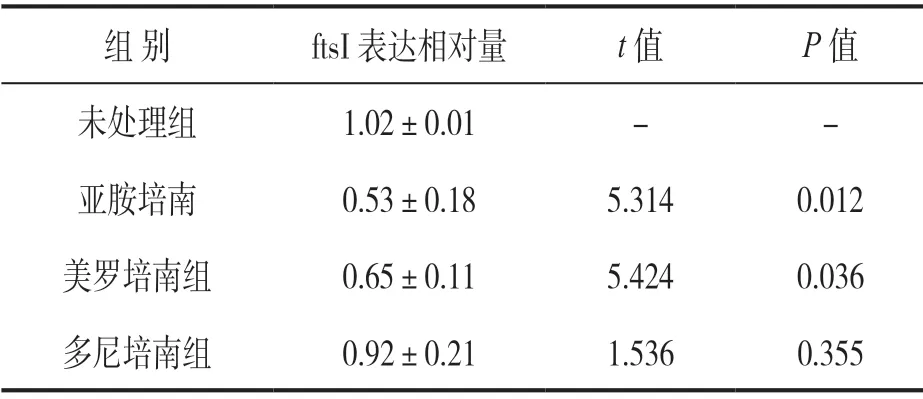
表2 碳青霉烯诱导后ftsI相对表达结果
3 讨论
鲍曼不动杆菌(Acinetobacter baumannii,AB)是临床中一类广泛发生的可导致院内感染的革兰阴性杆菌,这些年,对于碳青霉烯类抗生素鲍曼不动杆菌所表现出的耐药率一直居高不下[1,15],全国耐药率均值在50%以上,局部区域甚至高达80%,并且鲍曼不动杆菌不仅对多种青霉素类及头孢菌素类抗生素天然耐药,且在使用敏感药物治疗过程中极易产生获得性耐药,可选用的抗生素越来越少,给临床治疗带来极大的困难。在对鲍曼不动杆菌耐药机制的研究过程中[2,16]产碳青霉烯酶[4,17],丧失膜孔蛋白或此蛋白表达减少,外排泵活性提高等相关分析比较全面,然而较少涉及青霉素结合蛋白(PBPs)的分析。
青霉素结合蛋白(PBPs)是构成细菌细胞膜结构的重要蛋白,参与细菌肽聚糖合成,维持形态结构等功能,是细菌生长中不可缺少的物质[2,18]。按照在SDS-PAGE中的分子量、PBPs氨基酸序列、在细胞中的功能等三个方面,细菌PBPs可分成两组[19]:高分子量组(high-molecular-mass,HMM)与低分子量组(LMM) 的PBPs。β-内酰胺类抗生素主要与HMM组结合,从而抑制β-内酰胺酶活性杀死细菌[20]。已有的报道显示[9,21],鲍曼不动杆菌含 有7种PBPs(PBP1a,PBP1b,PBP2,PBP3,PBP5/6,PBP6,PBP7),PBPs编码基因突变或表达下调可导致与β-内酰胺类的亲和力减弱,细菌形成耐药[22]。
PBP3与细菌分裂有关,研究发现[18],细菌DNA 复制完成,随后ftsI基因编码PBP3被激活,几乎同一时间,催化发生羧基酶反应,肽聚糖合成反应。张洋洋等[23]对62株鲍曼不动杆菌进行全基因序列分析发现,碳青霉烯耐药株(CRAB)与碳青霉烯敏感株(CSAB)相比较,PBP1b,PBP3,PBP5/6,PBP6和PBP7氨基酸序列存在差异改变,并从蛋白组学的角度推测鲍曼不动杆菌PBPs与碳青霉烯类药物抗性相关。前期,本课题组[359051616]已发现鲍曼不动杆菌PBP1a编码基因ponA在耐药过程中发挥着关键作用。本课题进一步对ftsI进行研究,发现38株MDR-AB中,ftsI基因检测率100%,测序结果显示,相较于敏感株(SDF),有基因突变发生,将基因序列翻译成氨基酸序列,Swiss-Model Workplace同源建模后发现耐药株与SDF株PBP3空间结构存在显著差异,这可导致与β-内酰胺类药物亲和力下降,可能是鲍曼不动杆菌产生耐药的因素之一。
此外,研究发现[24-26]细菌在亚最低抑菌浓度(亚-MIC)作用下,细菌会变得更加适应环境,表现为耐药性增加、毒力增强、生物膜形成能力增加等。本实验采用亚-MIC浓度的3种碳青霉烯类抗生素对MDR-AB进行诱导,发现ftsI基因表达发生不同程度改变,其中亚胺培南组、美罗培南组ftsI基因表达较诱导前明显下调。有关亚胺培南能够于体外诱导AB的PBP基因ponA(PBP1a),ftsI(PBP3), dacC (PBP5/6) PBPs异常表达已被证实[27],本文进一步证实MEM诱导可导致鲍曼不动杆菌ftsI 的表达显著下调,但多尼培南的诱导效果不显著,可能是不同种类的碳氢霉烯类抗生素的分子结构不同,作用PBP的主要靶位不同导致[7]。
实验不足之处在于尚不能证明ftsI 在鲍曼不动杆菌耐药过程中是否起主要作用,以及PBP3与其余6种PBPs相互间的关系,需要后期进一步深入研究。对PBPs在鲍曼不动杆菌耐药机制中的研究,可进一步揭示其耐药机制的复杂性,为临床科学使用抗生素和有针对性地研发新的抗生素提供科学依据。

