黄连素通过调控Caspase-3、Bcl-2表达水平影响肝癌细胞HepG2的增殖和凋亡
赵玉泽,王 旖,魏志刚,梁 钢,肖 虹*
(1 首都医科大学附属北京世纪坛医院肿瘤内科,北京 100038;2 西安市第九医院病理科;3 山西医科大学第一医院普通外科;4 山西医科大学第一医院病理科;*通讯作者,E-mail:xiaohh9999@163.com)
原发性肝癌在恶性肿瘤死亡率中位列全球第三[1],且为我国最常见的恶性肿瘤之一[2],对人类的生命健康产生着极大威胁。目前肝癌的治疗手段主要为外科手术、经肝动脉化疗栓塞术(TACE)、放化疗及抗血管生成、免疫治疗等[3]。但大多数肝癌患者诊断时已为肿瘤晚期而丧失手术机会,且通常肝功能不全、一般情况较差,对放化疗敏感性及耐受性欠佳[4],因此,研究新的治疗方法迫在眉睫。
研究发现,多种中药可通过抑制肝癌细胞增殖、诱导肝癌细胞凋亡、抑制侵袭转移等作用达到控制和杀灭肝癌细胞的目的[5-7]。黄连素是我国应用很久的中药,可从黄连、黄柏、三颗针等植物中提取,因其具有显著的抑菌作用,常用来治疗胃炎、结肠炎、腹泻等疾病[8]。近年来发现黄连素可以改善肿瘤的自噬活性,发挥抑制肿瘤增殖、侵袭、诱导细胞凋亡的作用[9,10],已有大量体内外试验在多个癌种,如肺癌、宫颈癌、鼻咽癌、结直肠癌、乳腺癌、脑胶质瘤中观察到黄连素的抗肿瘤效应[10-15]。有文献报道,在肝癌中,黄连素可通过参与多个信号通路的调节来促进肿瘤凋亡、抑制肿瘤增殖、转移[16]、抗血管生成[17]而发挥抑癌作用,如黄连素可诱导HepG2细胞中活性氧损伤(ROS)生成,耗竭细胞内抗氧化剂而诱导肝细胞凋亡[18,19]。但是,黄连素是否还可通过影响其他凋亡相关基因表达,从而促进肿瘤细胞凋亡仍值得深入探讨。Caspase-3是凋亡途径中最重要的效应因子,它的激活是凋亡进入不可逆阶段的标志[20]。Bcl-2基因是一种凋亡抑制基因[21,22],其表达蛋白可抑制多种组织细胞的凋亡和延长细胞寿命,在多种肿瘤中表达上调,其过表达也可减少氧自由基的产生和脂质过氧化物的形成而抑制细胞凋亡。基于此,本研究将应用HepG2肝癌细胞株,重点研究黄连素是否可通过调节Caspase-3、Bcl-2蛋白表达从而影响肝癌细胞的增殖及凋亡,探讨其抗肿瘤的可能机制,并通过比较不同浓度黄连素作用下细胞凋亡的比例,探索黄连素在抗肿瘤治疗中可能的最佳药物浓度。
1 材料与方法
1.1 细胞株与主要试剂
人肝癌细胞株HepG2由山西医科大学生物化学与分子生物学实验室馈赠。10%胎牛血清(美国HyClone公司);RMPI 1640培养液(中国武汉博士德生物工程有限公司);0.25%胰酶(美国HyClone公司)。黄连素(固体结晶,20 mg/支,成都曼思特生物科技有限公司)。CCK-8试剂盒(中国武汉博士德生物工程有限公司)。Bcl-2抗体(美国Santa Cruz公司)、p-Bcl-2抗体(美国Cell Signaling公司)。辣根酶标记山羊抗兔IgG(中国北京中杉金桥生物工程公司)。
1.2 HepG2肝癌细胞株的培养
HepG2细胞置于含有10%胎牛血清的RPMI 1640培养液中,加入青霉素(100 U/ml)和链霉素(100 U/ml),37 ℃、5% CO2饱和湿度培养。次日待细胞贴壁后更换细胞培养液,以后每3 d更换一次培养液,待细胞长到培养瓶的80%左右时进行传代和冻存。
1.3 CCK-8法检测细胞增殖
取对数生长期HepG2细胞,铺于直径6 cm皿中(5×106/皿),接种于96孔板中,继续培养24 h,待细胞贴壁后分别加入配置为终浓度1,10,50,100 μmol/L的黄连素溶液,每个浓度设3个平行孔,并设置调零组,每组分别在培养12,24,36,48 h后,加入10 μl/孔CCK-8,培养箱2 h,在酶标仪450 nm处测定吸光度(A)值,计算各组细胞的增殖抑制率,绘制生长曲线。生长抑制率=[1-(加药组A值-调零组A值)/(0 μmol/L组A值-调零组A值)]×100%。
1.4 流式细胞术检测细胞凋亡
使用propidium iodide(PI)和Annexin Ⅴ染色通过流式细胞术检测细胞凋亡。将对数生长期的HepG2细胞接种于6孔板,培养12 h。依据黄连素不同浓度分为5组:0,1,10,50,100 μmol/L组。于37 ℃,5%CO2培养箱中孵育48 h后收集各组细胞,按照Annexin Ⅴ-PI细胞凋亡检测试剂盒说明操作,用1× binding buffer调整细胞密度为1×105/ml,再加入5 μl Annexin Ⅴ和5 μl PI,混匀,4 ℃避光染色20 min,加入400 μl 1× binding buffer,采用PI和Annexin Ⅴ染色通过流式细胞术检测细胞凋亡。
1.5 Western blot法检测Bcl-2和caspase-3蛋白表达
检测不同浓度(0,1,10,50,100 μmol/L)黄连素处理后细胞中Bcl-2和Caspase-3蛋白表达,将各组收集的细胞用预冷的PBS清洗后,按照蛋白裂解液RIPA操作说明提取蛋白,BCA法进行蛋白定量,将各组蛋白浓度调成一致,沸水煮5 min,待用。分别取各组总蛋白样品80 μg,以样品中的GAPDH为内参,经SDS-PAGE凝胶电泳,转膜,然后用含5%脱脂奶粉的PBS封闭2 h,加入适量含2%脱脂奶粉的PBS稀释Bcl-2抗体(1 ∶1 000)、Caspase-3抗体(1 ∶1 000),内参GAPDH相关一抗(1 ∶1 000),4 ℃孵育过夜,二抗IgG(稀释比例均为1 ∶5 000)室温孵育1 h,TBST清洗,ECL暗室显色。扫描显影条带图像并存入图像分析系统,应用Image J图像分析系统计算各样本条带灰度值,蛋白相对表达量以Bcl-2和Caspase-3灰度值与GAPDH灰度值的比值计算。
1.6 统计学分析
2 结果
2.1 黄连素对HepG2细胞增殖的影响
与0 μmol/L相比,1,10,50,100 μmol/L黄连素干预的HepG2细胞吸光度值降低,由吸光度值计算出的生长抑制率升高,具体统计学结果见表1。可见在12,24,36,48 h时,肝癌细胞生长抑制率均随药物浓度升高而逐渐增加(P<0.05),且通过相关性分析显示,黄连素对HepG2细胞生长抑制率的影响呈浓度及时间依赖性。
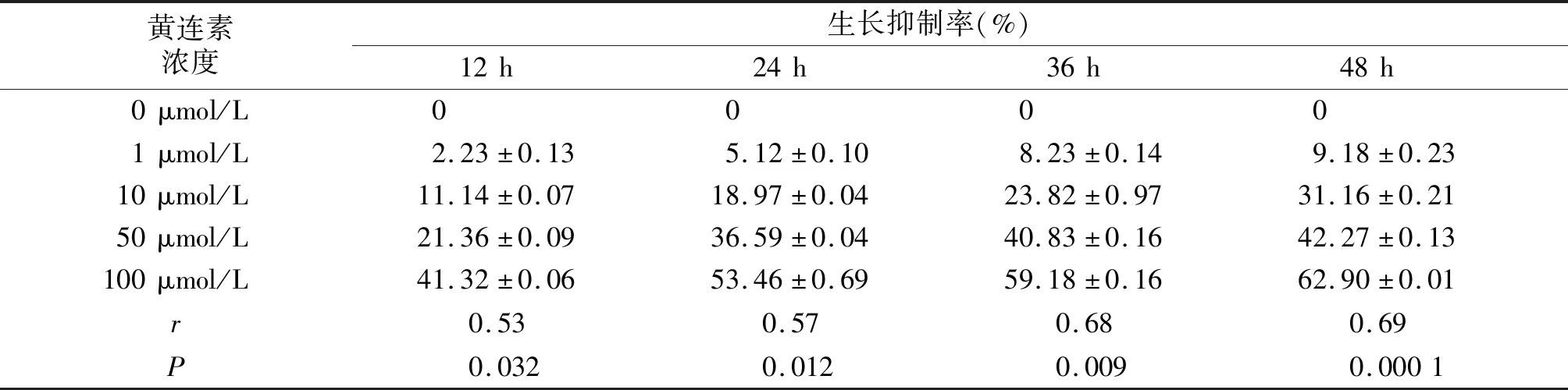
表1 黄连素对HepG2细胞增殖的影响Table 1 Effects of berberine on HepG2 cell proliferation
2.2 黄连素对HepG2细胞凋亡的影响
我们应用流式检测,不同浓度黄连素(0,1,10,50,100 μmol/L)作用48 h后,结果发现,随着黄连素的浓度升高,细胞凋亡的数量占比逐渐升高,不同黄连素浓度间差异有统计学意义(F=15.008,P=0.000,见图1)。

图1 黄连素作用48 h对HepG2细胞凋亡的影响Figure 1 Effect of berberine on apoptosis of HepG2 cells after treatment for 48 h
2.3 黄连素对HepG2细胞Caspase-3及Bcl-2蛋白表达的影响
Western blot结果显示,经黄连素作用后,HepG2细胞Bcl-2蛋白的表达逐渐降低,Caspase-3蛋白的表达逐渐增高。应用Mann-WhitneyU检验方法分析,结果显示,10,50,100 μmol/L组与0 μmol/L组相比,Bcl-2及caspase-3表达水平差异具有统计学意义(P<0.05,见图2)。

与0 μmol/L组相比,* P <0.05图2 黄连素对HepG2细胞Caspase-3及Bcl-2蛋白表达的影响Figure 2 Effect of berberine on the expression of Caspase-3 and Bcl-2 protein in HepG2 cells
3 讨论
中药与常规化疗药物相比,有多方面、多层面和低毒性的优势,从整体上系统地调控机体抑制肿瘤。黄连素因其显著的抗炎作用,一直以来被应用于消化系统疾病,最近越来越多研究发现,黄连素还能够提高宿主免疫功能,通过诱导肿瘤细胞凋亡、抑制肿瘤细胞增殖而发挥抑瘤作用[23]。在人结直肠癌细胞株HT-29中发现,黄连素可通过抑制JAK2/STAT3信号传导通路抑制HT-29细胞增殖并促进其凋亡[10]。本研究结果显示,黄连素可抑制肝癌HepG2细胞的增殖,从细胞水平进一步证实黄连素具有抑制肿瘤生长的作用。我们的研究发现与0 μmol/L相比,不同浓度黄连素分别作用于人肝癌细胞株HepG2不同时间后,细胞抑制率随药物浓度及时间的增加而升高(P<0.05)。黄连素以0,1,10,50,100 μmol/L的浓度分别作用48 h后,HepG2细胞凋亡率逐渐升高(F=15.008,P=0.000),且随着黄连素作用浓度的升高,HepG2细胞Bcl-2蛋白的表达逐渐降低,Caspase-3蛋白的表达逐渐增高,与0 μmol/L相比,10,50,100 μmol/L黄连素作用后Bcl-2和Caspase-3蛋白表达差异具有统计学意义(P<0.05)。
Caspase与真核细胞的凋亡密切相关,凋亡执行因子Caspase-3可介导细胞凋亡的死亡受体途径及线粒体途径并激活其他Caspase成员,从而诱导细胞凋亡[24],也是细胞毒T淋巴细胞(cytotoxic T lymphocyte, CTL)杀伤机制的重要组成部分。Bcl-2为一种癌基因,可干扰一系列细胞毒作用引起的细胞凋亡,包括阻断Caspase-3的促凋亡途径。目前已发现,黄连素在乳腺癌[25]、胃癌[26]中可下调Bax、Bcl-2表达而起到促凋亡作用。为了探讨黄连素的抗肿瘤作用机制,本实验通过Western blot检测不同黄连素作用浓度下Caspsae-3和Bcl-2蛋白的表达,结果显示,与0 μmol/L相比,10,50,100 μmol/L黄连素作用下的HepG2细胞Caspsae-3表达上调,Bcl-2蛋白表达下调,而且不同浓度下对Caspsae-3、Bcl-2的影响也不一,我们发现应用黄连素浓度从10 μmol/L起开始影响上述2种蛋白的表达,差异有统计学意义,从分子水平证明黄连素可通过促进Caspase的激活、下调Bcl-2表达从而抑制肿瘤细胞增殖生长、促进肿瘤细胞凋亡,为黄连素的抗肿瘤作用机制提供了依据。
此外,Bcl-2可增强细胞对大多数DNA损伤因子的抵抗,而抑制大多数化疗药物所引起的靶细胞凋亡,最终导致肿瘤耐药。而黄连素对Bcl-2的阻断作用,可能会一定程度逆转肝癌化疗过程中的耐药现象,以及增加肿瘤对放疗、靶向治疗和免疫治疗的敏感性。目前已有报道在细胞水平发现,黄连素联合化疗或靶向治疗的疗效优于单药,如黄连素联合索拉菲尼或奥沙利铂[27]以及黄连素联合甲磺酸阿帕替尼[28],均发现联合黄连素较单药对肝癌细胞的凋亡有增效作用。但目前针对黄连素的抗肿瘤研究还局限在细胞及实验动物水平,在肿瘤患者中,黄连素的作用及其联合化疗、靶向药物甚至免疫治疗的疗效还有待大型临床试验的证实。
综上所述,黄连素对肝癌细胞HepG2有抑制作用,通过上调Caspsae-3及下调Bcl-2蛋白表达诱导其凋亡,其抗肿瘤效应可为肝细胞癌提供新的治疗思路。其次,我们的研究证明了不同浓度下的黄连素对肝癌细胞增长抑制作用不同,10 μmol/L的黄连素浓度就可以明显抑制肝癌细胞的增长,影响肝癌细胞中凋亡蛋白的表达情况从而引起肿瘤凋亡。此外本研究还证明了随着黄连素浓度的增加,肿瘤细胞的抑制率也相应的增高,这提示我们在临床中应用黄连素抗肿瘤治疗剂量需要进一步摸索,在不增加副作用的情况下需要找到抗肿瘤治疗的最佳浓度,为后续黄连素在临床中应用的最佳浓度提供了证据。

