一次性使用无菌注射器及注射器用活塞体外细胞毒性研究
郝钢 李宜铮 武星 斯琴 张莉芳 颜皓 韩峰*
1 内蒙古自治区药品检验研究院 (内蒙古 呼和浩特 010020)
2 内蒙古自治区药品检查中心 (内蒙古 呼和浩特 010020)
内容提要:目的:探讨目前市场上一次性使用注射器及注射器用活塞的细胞毒性是否符合GB15810-2001《一次性使用无菌注射器》、YY/T0243-2016《一次性使用注射器用活塞》的要求。方法:使用含10%胎牛血清的DMEM培养基(DMEM)作为浸提介质,供试品分为两组,一组取注射器采用公称容量法浸提;另一组取注射器活塞,按重量法浸提,浸提液分别与L929细胞接触培养,采用四唑盐比色法(MTT法)进行吸光度检测,计算细胞的相对增殖率。结果:部分注射器用活塞细胞毒性较大。结论:需要加强对一次性使用无菌注射器的细胞毒性评价。
一次性使用无菌注射器目前是各医疗机构临床上广泛使用的医疗器械,它与患者身体和血液直接接触,现归属于我国三类医疗器械产品。由于一次性使用无菌注射器与人民群众身体健康和生命安危息息相关,是国家重点监管的医疗器械产品之一[1]。医疗器械与人体间接接触或植入体内后会与人体发生非常复杂的反应过程[2]。因此,一次性使用无菌注射器与其重要组成部分橡胶活塞的生物学相容性评价也受到越来越多的关注。生物相容性体外细胞毒性评测是一种在离体状态下,模拟生物体生长环境,用于检测医疗器械、药包材或其浸提液接触人体组织后可能造成的细胞生长抑制、细胞代谢障碍、细胞变异、细胞溶解、细胞死亡等影响细胞状态功能和生物学反应的试验,是现有生物学评价体系中关键的检测指标之一。体外细胞毒性试验具有操作简便、检验快捷、重现性好、灵敏度高、减少动物使用等优点被作为评价各类医用材料和药品包装材料毒性的重要指标[3]。本院在完成国家抽验要求法标检验项目的同时,对22个厂家的24批注射器和活塞进行了体外细胞毒性试验研究。
1.资料与方法
1.1 一般资料
仪器设备:美国赛默飞Thermo Mulitiskan Go酶标仪,美国赛默飞Thermo Heracell 150i细胞三气培养箱,日本尼康TS100倒置显微镜,日本TOMY SX-700灭菌器,德国Sigma2-6型离心机,美国赛默飞Thermo Herafreeze Basic超低温冰箱,Sangma层流罩。
试剂及材料:DMEM培养基,生产厂家:赛默飞世尔(苏州)仪器有限公司,批号:8120035;胎牛血清(FBS),生产厂家:赛默飞世尔(苏州)仪器有限公司,批号:1999579;0.25%胰蛋白酶(细胞消化液),生产厂家:赛默飞世尔科技有限公司,批号:2120734;青链霉素,生产厂家:赛默飞世尔科技有限公司,批号:2145455;磷酸盐缓冲液,生产厂家:福州飞净生物科技有限公司,批号:190610;噻唑蓝(MTT),生产厂家:西格玛奥德里奇(上海)贸易有限公司,批号:MKBR6576V;二甲基亚砜(DMSO),生产厂家:国药集团化学试剂有限公司,批号:20160428;聚乙烯生产厂家:美国药典委,批号:K0M357。
细胞株:L-929小鼠成纤维细胞,购于上海子实生物科技有限公司。
供试品:试验选取22个厂家24批次的一次性使用注射器,均来自于国家监督抽验。
1.2 方法
依据GB15810-2001《一次性使用无菌注射器》[4]、YY/T0243-2016《一次性使用注射器用活塞》[5]等的要求进行检测[6,7]。
1.2.1 试验液制备
一次性使用无菌注射器在无菌条件下,取同一批号注射器3支,抽取浸提介质至公称容量,置于37°C培养箱中孵育24h。注射器活塞在无菌条件下,按0.2g/mL加入含10%胎牛血清的DMEM培养基,置37°C细胞培养箱孵育24h。在无菌条件下,按0.2g/mL加入DMEM完全培养基(含10%胎牛血清),置37°C培养箱孵育24h。取高密度聚乙烯对照品,按表面积3cm2/mL的比例加入含10%胎牛血清的DMEM培养液置37°C细胞培养箱孵育24h,作为阴性对照液;另用DMEM完全培养基将苯酚配制成5g/L的溶液作为阳性对照液。
1.2.2 细胞悬液的制备
将已传代培养48h,处于对数生长期且生长旺盛的L-929细胞用胰酶消化液消化2min,用吸管把细胞从瓶壁上吹打下来,使贴壁生长的细胞悬浮于培养瓶中,细胞混匀后,调整细胞密度为1×104个/mL。
1.2.3 步骤方法
将上述1×104个/mL细胞悬液接种于96孔细胞培养板每孔100μL,晃动培养板,使细胞均匀地分布于培养板底部将细胞培养板置5% CO2浓度培养箱中,37°C培养24h后,倒去原培养液。再分别加入已制备的样品浸提液、阴性对照液、阳性对照液和空白对照液,加入剂量为100μL每孔,每组做6孔平行样,再置细胞培养箱中,37°C继续培养72h后拿出细胞培养板置显微镜下观察并记录细胞形态后,每孔加5mg/mL的MTT溶液50μL,继续培养4h后弃去上清液,加入150μL二甲基亚砜作用5min后,慢速震荡15min,待紫色结晶完全溶解后,用酶标仪双波长(570nm和630nm)测定各孔吸光度值(OD值),按公式(1)计算相对增殖率(RGR)。
细胞相对增殖率(RGR)

注:式中A-供试品组、阴性对照组、阳性对照组吸光度;A0-空白对照组吸光度。
根据细胞相对增殖率按表1分级标准判定,阴性对照组的反应不得≤1级,阳性对照组至少达到3级反应,如阴性对照组和阳性对照组反应不成立时应重新试验。在阴性对照和阳性对照达到标准要求的情况下,分析判定细胞毒性反应试验结果,一般认定可接受的供试品细胞毒性反应为≤2级。
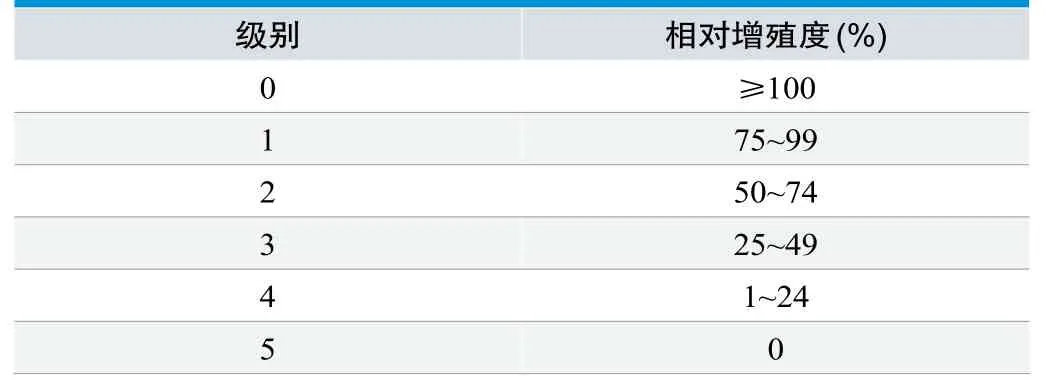
表1.细胞毒性反应分级
2.结果
2.1 细胞形态学观察
通过倒置显微镜观察并记录细胞形态(如图1所示),并按表2进行细胞毒性反应分级。阴性对照组和空白对照组的细胞呈不规则形状或梭形,细胞形态正常,生长状态良好,无溶解的细胞,对细胞的毒性影响为无(0级);一次性使用无菌注射器供试品组细胞也呈梭形或三角形,细胞形态正常,贴壁生长状态良好;少部分注射器用活塞供试品组细胞呈圆形或溶解,细胞层完全破坏,几乎全部死亡;阳性对照组细胞呈圆形或溶解,细胞层完全破坏,几乎全部死亡,对细胞的毒性影响为重度(4级)。
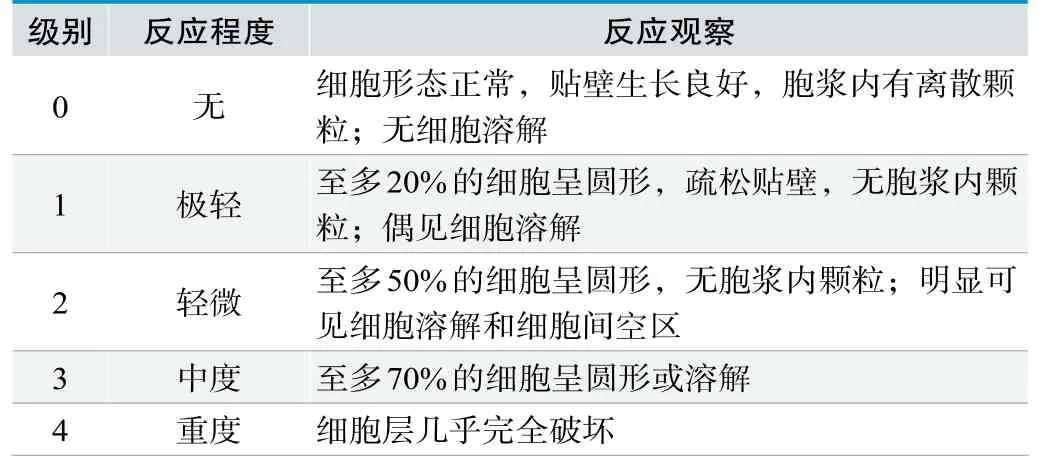
表2.细胞形态毒性反应分级
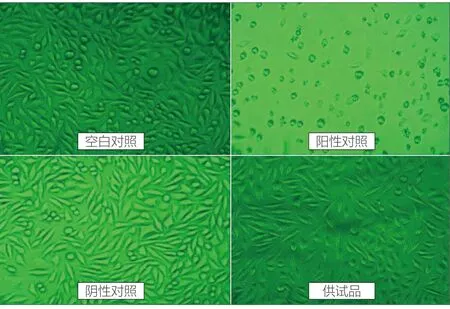
图1.细胞形态图像
2.2 MTT定量检测法
24批一次性使用注射器和注射器用活塞细胞毒性试验结果如表3所示。由表3可见,在此浸提条件下,24批一次性使用注射器的体外细胞毒性试验结果均符合要求;24批一次性使用注射器用活塞的体外细胞毒性试验中有87.5%的产品符合要求,而12.5%的产品细胞毒性较大,不符合我国标准要求。由图2可见,各厂家之间注射器用活塞细胞毒性存在差异,部分厂家注射器用活塞细胞毒性较大。
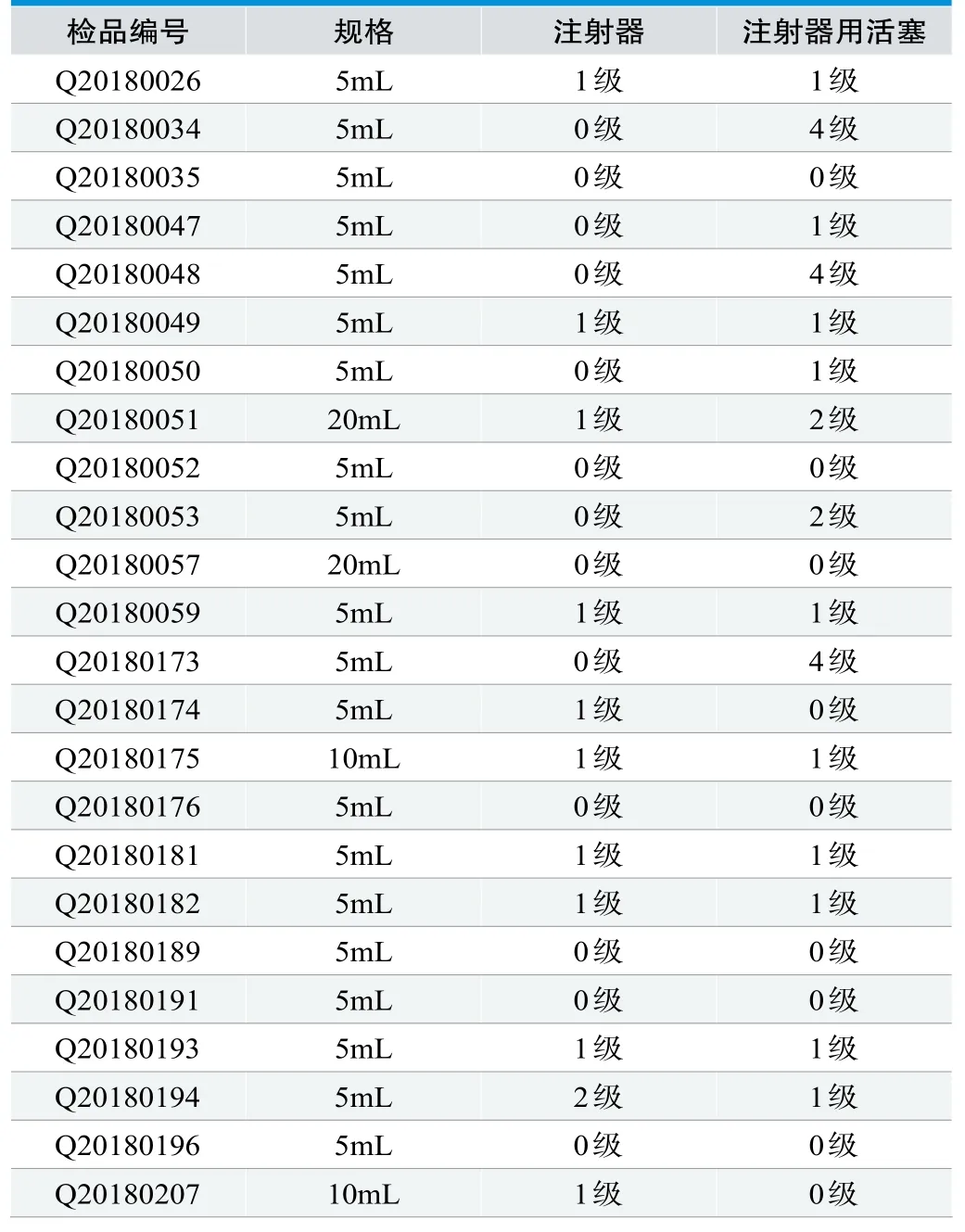
表3.细胞毒性测试结果
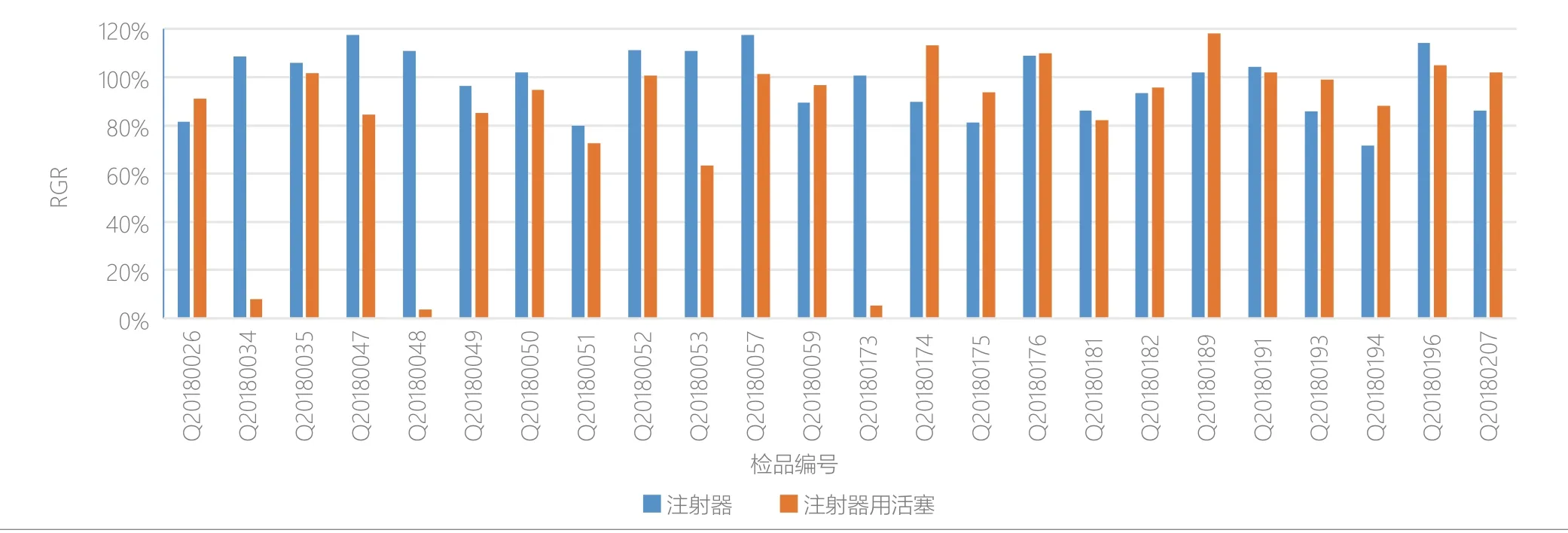
图2.细胞毒性测试数据分析
3.讨论
四唑盐比色法(MTT法)的原理是小鼠成纤维细胞线粒体酶中的琥珀酸脱氢酶可催化黄绿色的噻唑蓝还原成蓝紫色的物质甲臜,用有机溶剂(如二甲基亚砜)将其溶解成溶液,再通过酶标仪测定其吸收值从而可以定量测定L929细胞的存活比例,是目前绝大多数医疗器械及材料体外细胞毒性常用的检测方法。其结果更客观,具有更好的重现性和准确性,适用于对细胞毒性物质进行评价,现已基本替代了另一种检测方法——显微镜观察法[8,9]。而且,MTT细胞毒性试验所使用的L-929细胞株,如果代数差异在11代以内基本不会引起检测结果的差异[10]。此外,体外细胞毒性试验更符合实验动物3R原则,更加简便有效灵敏,并在减少动物使用和损伤的前提下,还可以提供可靠的生物安全隐患参考数据。
医用材料中的一些原料单体、聚合剂、催化剂和乳化剂等易溶出物质是造成细胞毒性作用的主要原因。市场上使用的医用注射器活塞仍存在一定程度的细胞毒性反应,产生的原因主要是:①注射器活塞通常采用天然橡胶或合成橡胶,由于天然橡胶成本高,很多厂家在用合成橡胶,但合成橡胶产品质量存在很大差异,还有厂家使用再生材料,由此可能产生细胞毒性;②注射器在生产过程中会使用硅油增强滑动性,为降低成本,少数厂家可能存在使用工业级硅油代替医用硅油,因此导致细胞毒性。目前,我国已有自主研发有较高生物安全性的药物注射润滑用免溶剂硅油产品进入了上市前评价阶段[11];③在清洗活塞后,存在洗液残留导致细胞毒性[12]。
根据我国技术审评对医疗器械生物相容性的一般要求,目前,对于二类医疗器械而言,要求细胞毒性应≤2级,而对于三类的医疗器械,一般要求细胞毒性应≤1级。在GB/T14233.2-2005《医用输液、输血、注射器具检验方法第2部分:生物学试验方法》[6]的结果判定中,细胞增殖率在80%~99%,即被认定为细胞毒性1级,细胞增殖率在50%~79%,即被认定为细胞毒性2级;GB/T16886.5-2017《医疗器械生物学评价第5部分:体外细胞毒性试验》[7]中细胞增殖率达到70%,即被认定为无潜在细胞毒性。
我国医疗器械市场规模居世界前三位,一次性使用注射器的需求量和使用量十分巨大。据报道,我国医疗机构每年消耗使用一次性注射器约为150亿支,因其涉及到人体给药,有直接接触性、开放性及创伤性,并且伴随着如此巨大使用量的是随之而来的安全隐患,所以十分需要重视和加强对于一次性使用注射器的质量安全控制。现阶段,我国仍处于临床医疗事故的多发期,医疗事故的发生可能存在有医疗器械的潜在危害性未被及时准确的发现,出于对广大患者的生命安全保障的考虑,亟待研究出更多有效的检测和实验方法来考察和控制一次性无菌注射器的生物安全[13]。同时,建议我国监管检测部门继续加强对一次性使用无菌注射器及活塞的细胞毒性评价,有效地完善我国对无源医疗器械及材料的生物相容性研究,增加针对性更强的生物相容性检查项目,以较全面的评价产品质量,督促厂家改进生产工艺,保障人民的用械安全。

