基于定量电子计算机断层扫描探讨不同年龄、生理时期女性腰椎骨密度与腹部脂肪的相关性研究
李杰生,欧阳可勋(通信作者),林泽波
(佛山市三水区人民医院医学影像科 广东 佛山 528100)
肥胖及骨质疏松为临床上十分常见的两种慢性疾病,目前临床上通常将体质指数(body mass index,BMI)及骨密度(bone mineral density,BMD)作为诊断骨质疏松及肥胖的常用依据,但单纯地依靠BMI 难以准确地对机体局部脂肪堆积情况进行反映,且在不同体脂比例的人群中其骨量形成往往和体脂存在密切关联[1-2]。为此,加强对BMD 测量的重视十分必要。本文就采用定量CT(quantitative computed tomography,QCT)为235 名在佛山市三水区人民医院进行健康体检的体检女性进行BMD 及腹部脂肪测量,并对不同年龄、生理时期女性腰椎BMD 与腹部脂肪的相关性展开了研究,具体如下。
1 资料与方法
1.1 一般资料
选取2020 年1 月—2021 年12 月期间在佛山市三水区人民医院体检中心进行健康体检的235 名女性作为研究对象。体检者的年龄为25~85岁,平均(46.4±2.0) 岁;将其按照年龄划分为青年组(68 例)、中年组(100 例)、老年组(67 例)三组,青年组年龄为25 ~35 岁,中年组36 ~59 岁,老年组60 ~79 岁;并以不同生理期将患者划分为绝经前组(120 例)、围绝经期组(35 例)、绝经后组(80 例),绝经前组仍有规律月经周期;围绝经期组年龄为45 岁左右,且停经时间不超过12 个月,绝经后组为绝经时间超过1 年。
1.2 方法
所有研究对象均行定量CT 检测,对研究对象的腰椎骨密度(BMD)及腹部脂肪相关参数进行测量。仪器选用GE 公司Discovery CT750 HD 第3 代CT机,指导受检者双手抱头,吸气末屏气,设置扫描范围为L1~L3椎体水平,同时设置扫描参数:管电压120 k V,管电流30 m A s,螺距为0.775,旋转时间设置为0.625 s/r,同时将层间距与扫描层厚均设置为5m m,矩阵设置为512×512;扫描时选用自动毫安秒技术及混合迭代重建技术,在行重建扫描时设置重建层厚与层间距均为1 m m。将重建CT 图像上传至美国Midways 公司提供的Midways QCTPro6.1 分析系统,并以“骨密度”模块测量受检者L1~L3椎体BMD,并计算腰椎平均骨密度,以“tissue composition”模块对受检者L3水平腹部脂肪面积进行检测,计算受检者L3中心层FA、内脏脂肪面积(VFA)及L3水平腹部皮下脂肪面积(SFA);上述操作均由2 名具有丰富临床经验的副主任医师进行测量,取两者的平均值为最终结果。
1.3 统计学方法
采用SPSS 20.0 统计学软件处理数据,计量资料表示为(±s),以t检验;计数资料以频数、百分比(%)表示,行χ2检验,并以Pearson检验相关性,P<0.05为差异有统计学意义。
2 结果
2.1 不同年龄组平均BMD 与腹部脂肪参数比较
青年组女性平均BMD 显著高于其他两组,中年组女性平均BMD 显著高于老年组(P<0.05);青年组FA、VFA 均显著低于中年组与老年组,中年组FA、VFA 显著低于老年组(P<0.05);三组间经秩和检验对比BMD、FA、VFA 均存在显著差异(P<0.05);三组间SFA 比较无较大差异(P>0.05),见表1。各组中分别取1 例患者的骨密度测定图片进行展示,见图1 ~图3。
表1 不同年龄组平均BMD 与腹部脂肪参数比较(±s)
组别 例数 vBMD/(mg·cc-1) FA/cm2青年组 68 162.93±12.88 228.32±17.32中年组 100 115.89±10.23 285.93±18.99老年组 67 64.83±5.12 318.93±20.42 F 235.88 17.289 P<0.001 <0.001组别 例数 VFA/cm2 SFA/cm2青年组 68 95.22±5.32 139.92±9.35中年组 100 140.25±8.20 141.03±9.78老年组 67 169.93±10.38 141.16±9.83 F 35.553 1.376 P<0.001 0.255
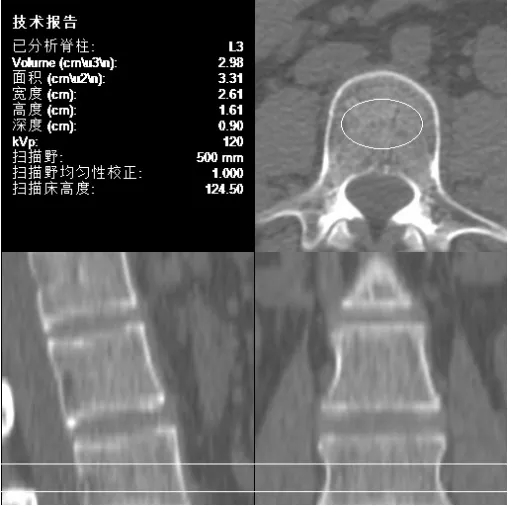
图1 青年组某患者QCT 骨密度测定结果

图2 中年组某患者QCT 骨密度测定结果
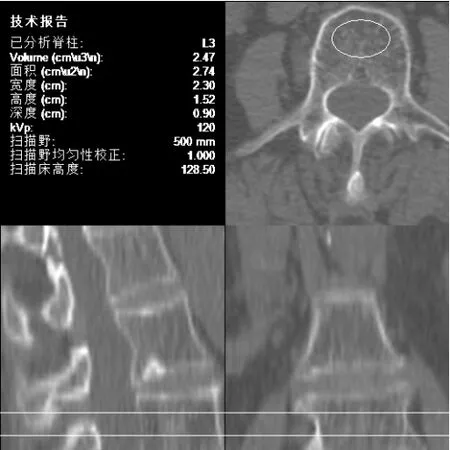
图3 老年组某患者QCT 骨密度测定结果
2.2 不同生理期女性平均BMD 与腹部脂肪参数比较
绝经前组平均BMD 显著高于围绝经期组、绝经后组,围绝经期组显著高于绝经后组(P<0.05);绝经前组FA、VFA 均低于围绝经期组、绝经后组,围绝经期组FA、VFA 则低于绝经后组,差异有统计学意义(P<0.05);组间SFA 比较无显著差异(P>0.05),见表2。
表2 不同生理期女性平均BMD 与腹部脂肪参数比较(±s)
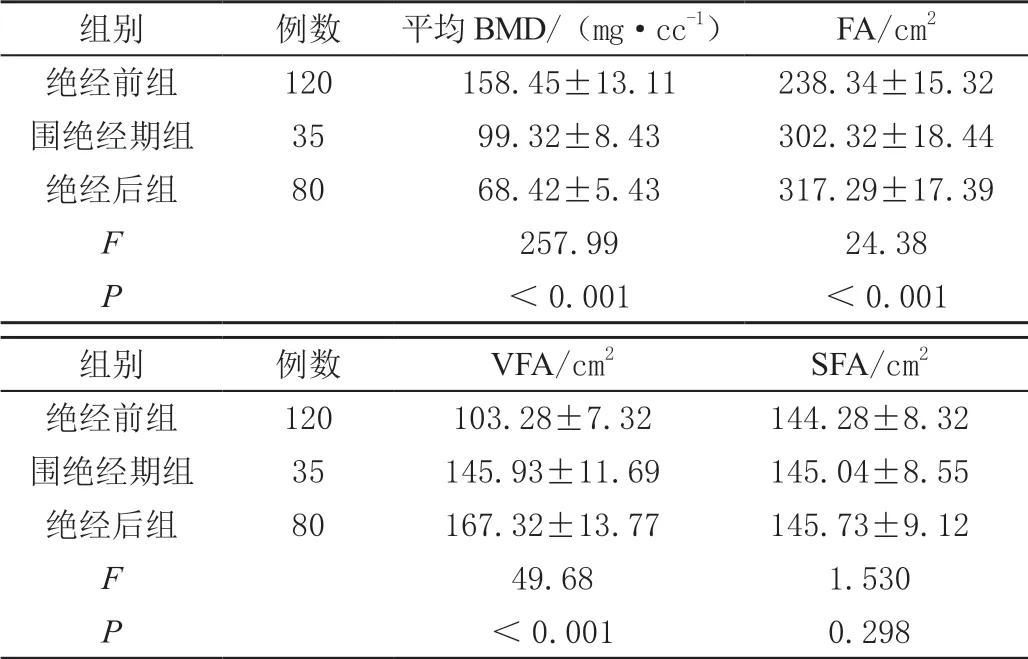
表2 不同生理期女性平均BMD 与腹部脂肪参数比较(±s)
组别 例数 平均BMD/(mg·cc-1) FA/cm2绝经前组 120 158.45±13.11 238.34±15.32围绝经期组 35 99.32±8.43 302.32±18.44绝经后组 80 68.42±5.43 317.29±17.39 F 257.99 24.38 P<0.001 <0.001组别 例数 VFA/cm2 SFA/cm2绝经前组 120 103.28±7.32 144.28±8.32围绝经期组 35 145.93±11.69 145.04±8.55绝经后组 80 167.32±13.77 145.73±9.12 F 49.68 1.530 P<0.001 0.298
2.3 不同年龄组女性平均BMD 与腹部脂肪测量参数的相关性分析
青年组患者平均BMD 与腹部脂肪参数各指标呈负相关,老年组平均BMD 与腹部脂肪参数各指标呈正相关(P<0.05),见表3。
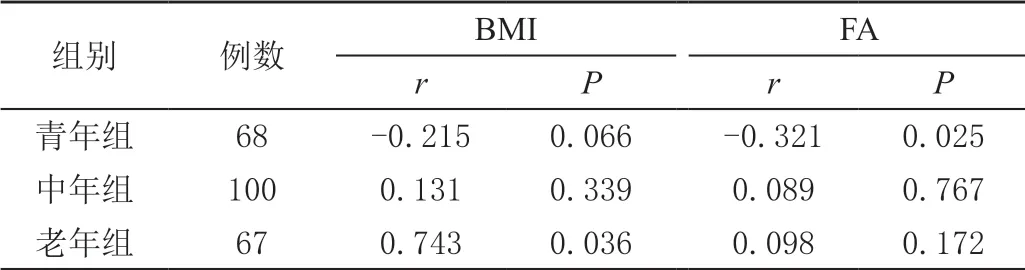
表3 不同年龄组女性平均BMD 与腹部脂肪测量参数的相关性分析
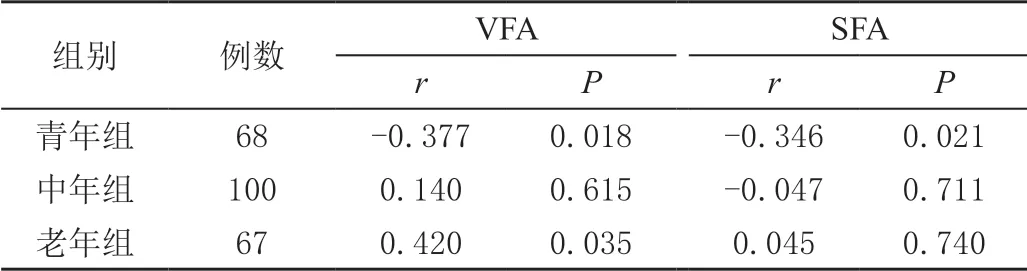
表3(续)
2.4 不同生理期女性平均BMD 与腹部脂肪测量参数的相关性分析
绝经前女性平均BMD 与内脏脂肪面积(VFA)呈负相关,围绝经期女性平均BMD 与FA、VFA 呈负相关;绝经后女性平均BMD 与VFA 呈正相关(P<0.05),见表4。

表4 不同生理期女性平均BMD 与腹部脂肪测量参数的相关性分析
3 讨论
脂肪组织是一种有内分泌效应的组织,在各类代谢疾病中发挥着十分重要的作用,同时还可对骨骼机械负荷情况及骨代谢情况产生影响,进而可影响机体骨密度[3]。当前,临床上通常将BMI、BMD 作为诊断骨质疏松及肥胖的常用依据,但单纯依靠BMI 的诊断准确性多不够理想,其难以准确地对人体腹部脂肪堆积情况进行反映。而我国中心性肥胖人群较多,即以腹部脂肪积累过度而引起的肥胖现象。受脂肪组织各类生理学作用的影响,使得骨质疏松和肥胖之间存在着复杂的关系[4]。有研究指出[5],不同体脂比例者,其骨量形成和体脂的关联也不相同。为此,加强对BMD 测量的重视,并了解不同年龄、不同生理时期女性腰椎骨密度和腹部脂肪间的相关性,从而积极采取有效措施进行防治以提升女性的生活质量十分必要[6]。
QCT 为临床上测量BMD 的常用方式,也是当前临床上测量腹部脂肪的有效手段。相对于双能X 线吸收法而言,CT 具有更高的分辨力,以QCT 进行BMD 测量时可避免机体腹主动脉钙化、体型、脊柱侧弯等因素的影响,从而可准确地对机体BMD 变化情况进行反映[7-8]。本研究结果显示不同年龄组及围绝经期前后女性比较平均BMD 及FA、VFA 均存在显著差异(P<0.05);青年组患者平均BMD 与腹部脂肪参数各指标呈负相关,老年组平均BMD 与腹部脂肪参数各指标呈正相关(P<0.05);绝经前组FA、VFA 均低于围绝经期组、绝经后组,围绝经期组FA、VFA 则显著低于绝经后组(P<0.05);绝经前女性平均BMD 与VFA 呈负相关,围绝经期女性平均BMD 与FA、VFA 呈负相关;绝经后女性vBMD 与VFA 呈正相关(P<0.05);表明女性腰椎BMD 和腹部脂肪组织有较为复杂的关系,且不同年龄、生理期的关系存在较大差异[9]。这主要是由于女性骨密度通常可在25 ~35 岁达到峰值,随着年龄的增长骨骼中的钙水平会逐步丢失,进而可造成骨密度下降。而女性围绝经期时因雌激素水平明显降低,受此影响女性BMD 也会随之呈现出明显下降,之后骨密度下降速度则会呈现出放缓状[10]。同时临床研究已经证实骨密度下降和骨质疏松之间有十分紧密的关联,绝经期后女性出现骨质疏松的风险增大,故而绝经期后女性骨密度水平也多会呈现出明显下降趋势[11-12]。因此,临床上应定期进行BMD 和腹部脂肪含量检测,以做到早发现、早预防,以提升女性的生活质量[13]。
综上所述,女性腰椎BMD 和腹部脂肪组织间的关系较为复杂,围绝经期女性机体BMD 调节情况通常会受到雌激素与脂肪组织的共同参与,今后仍需要就两者的关系展开更深入的研究。

