经鼻脑给药途径治疗胶质母细胞瘤研究进展
李吻吻,赖睿,刘淇,赵海龙*
1遵义医科大学基础医学院病理生理学教研室,贵州遵义 563000;2遵义医科大学第一临床学院,贵州遵义563000;3遵义医科大学口腔医学院,贵州遵义 563000
胶质母细胞瘤(glioblastoma,GBM)是成人最常见、最致命的原发性恶性脑肿瘤,其发病率随年龄增长而增高,75~84岁时达到峰值,但在85岁后下降,且男性发病率高于女性[1]。目前GBM的临床治疗手段主要为外科手术、放射疗法(简称放疗)和化学药物疗法(简称化疗),其中最大程度的手术切除是最有效的方法之一[2]。然而术后GBM患者的预后普遍较差,中位生存期仅15个月,且复发率高于90%[3]。目前,临床上GBM最常用的化疗药物是替莫唑胺(temozolomide,TMZ),其在体内自发水解为烷基化代谢物从而抑制肿瘤。临床中使用放疗联合TMZ治疗可使患者中位生存期延长2.5个月[4],但TMZ易产生耐药性,且入脑后靶向性较差,不良反应较多[5]。大部分抗癌药物由于血脑屏障(blood brain barrier,BBB)的低通透性而不易入脑[6],临床上需要提高药物剂量才能在脑中获得有效治疗浓度,从而限制了其临床应用。虽然目前可使用聚焦超声(BBB的机械破坏)、血管活性肽(BBB的化学破坏)等方式予以克服,但在一定程度上会对BBB造成破坏,且药物疗效不佳[6]。因此迫切需要一种新的给药方法,既能跨过BBB的阻碍,又能保证药物疗效。最近一种新的非侵入性给药方法,即鼻脑给药途径,可作为递送药物活性分子的替代途径。经鼻入脑的给药方式可使药物绕过BBB直接入脑,且能够保证药物到达肿瘤组织对具有有效浓度,是一种有效的新型药物输送策略。本文就鼻脑给药途径联合不同抗癌药物或方式在GBM治疗中的应用研究进展进行综述。
1 BBB
BBB是脑组织与血液之间的屏障,由内皮细胞、星形胶质细胞、周细胞、基底膜和细胞外基质组成,可阻止机体血液中的大分子、毒素和药物进入脑组织,从而维持脑组织稳态[7]。BBB通常只允许分子量小于400 ku的小亲脂性分子通过[8]。因此,使用药物治疗中枢神经系统(central nervous system,CNS)疾病时必须克服BBB的障碍。目前主要通过脑室内或鞘内注射来实现脑内直接给药[9],但脑室内或鞘内注射是侵入性方式,容易引发感染等并发症。因此,如何跨过BBB实现脑内给药是大部分CNS疾病(包括脑肿瘤)临床治疗最常见的障碍或困难[10]。
2 鼻脑给药途径
鼻腔由前庭区域、呼吸区域和嗅觉区域等三个区域组成[11]。前庭区域是鼻腔入口,主要由鳞状上皮细胞组成;呼吸区域是鼻腔最大的区域,含有丰富的血管与神经[12],其中的三叉神经与脑内CNS相连[13];嗅觉区域由嗅上皮细胞组成,该处存在连接脑组织与外部环境的有孔毛细血管,是BBB最薄弱的部位,被认为是经鼻途径药物的主要吸收部位[14]。
由于鼻腔黏膜对小分子药物和生物类药物具有很好的吸收和渗透性,同时多肽等大分子物质及干细胞也能通过嗅觉区域进入脑内,因此鼻腔非常适合药物输送入脑[15]。药物经鼻入脑主要通过嗅觉神经和三叉神经通路[16]。当药物从鼻腔到达嗅觉区域时,会通过嗅觉神经和三叉神经进入脑内的嗅球,然后进入脑脊液,进一步到达大脑的不同区域,从而达到绕过BBB的目的[17]。
虽然滴鼻剂、喷雾剂等形式已广泛使用,并已被证实对鼻内给药更有效[18];但由于药物会经历黏液纤毛清除、酶促降解过程,其生物利用度降低且停留时间短,可能会限制鼻内吸收[19]。同时,可喷入鼻腔的药物量有限,长期接触含有细胞毒性的制剂会导致纤毛毒性、鼻黏膜损伤和刺激,甚至引起过敏[20-21]。为克服这些障碍以提高鼻腔给药的有效性,利用吸收促进剂、黏膜黏附剂、酶抑制剂和纳米载体等方法延长鼻腔停留时间,降低黏膜纤毛清除率,可改善药物的吸收情况[19,22-23]。新型药物制剂主要包括纳米颗粒、水凝胶、微球或基于脂质的纳米制剂,药物被封装到适当的载体系统中以控制释放和增强药物向CNS的靶向递送,从而提高鼻黏膜对药物的吸收利用[19,22-24]。
总之,鼻脑给药途径是利用连接大脑与外部环境之间的独特解剖结构,从而绕过BBB的给药方式。与其他CNS给药方式相比,鼻脑给药途径作为一种简单的、非侵入性给药替代途径,具有生物利用度高、创伤性小、不良反应少等优势,且可防止胃肠道反应和首过效应[19]。因此,鼻脑给药途径在GBM等脑部肿瘤的药物治疗中具有一定的应用前景[25]。长期鼻腔给药会对鼻腔黏膜和纤毛产生毒副作用,而纳米药物递送系统可控制释放并增强药物向CNS的靶向递送,增强鼻黏膜对药物的吸收,同时降低药物对鼻腔的毒副作用。
3 经鼻脑给药途径的GBM治疗药物
3.1 天然化合物姜黄素(curcumin,CC) CC是一类源自姜黄根状茎的天然活性化合物,具有广泛的抗癌、抗肿瘤、抗氧化和抗炎作用[26]。近年来研究发现,CC可调节多种细胞信号通路及分子靶点如p53、磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,P13K/Akt)、Janus激酶/信号转导和转录激活因子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)以及核转录因子κB (nuclear transcription factor-κB,NF-κB)等,从而抑制GBM肿瘤细胞的迁移、侵袭、增殖等[27-29]。此外,CC还可特异性抑制GBM肿瘤干细胞的增殖并选择性诱导肿瘤细胞凋亡,从而保护正常脑组织[28,30]。Mukherjee等[31]发现,CC经GBM特异性抗体耦联修饰后,在GBM模型动物中经鼻腔给药,能够靶向GBM细胞产生显著的抑制效果,表明CC可通过鼻脑给药途径有效治疗GBM。
3.2 5-氟尿嘧啶(5-fluorouracil,5-FU) 5-FU是天然尿嘧啶的类似物,在细胞内代谢活化生成靶向DNA和RNA等的核苷和核苷酸代谢物,可发挥细胞毒性作用,目前广泛用于治疗各种肿瘤[32]。
近期研究发现,嗅鞘细胞(olfactory ensheathing cell,OEC)具有迁移到损伤部位的能力和抗炎特性,经鼻脑给药途径入脑后可以靶向脑肿瘤[33]。Carvalho等[33]研究发现,体外培养的OEC可过表达酵母胞嘧啶脱氨酶(cytosine deaminase,CD)和尿嘧啶磷酸核糖转移酶(uracil phosphoribosyltransferase,UPRT),然后利用其自身对脑肿瘤的靶向性,在脑肿瘤部位特异地将前药5-氟胞嘧啶(5-fluorocytosine,5-FC)转化为细胞毒剂5-FU,进而抑制肿瘤细胞的核苷酸合成并诱导其死亡。该研究结果表明,利用OEC载体可实现5-FU经鼻脑给药途径靶向杀伤GBM细胞的目的。
3.3 TM Z TM Z具有一定的脂溶性,可跨越BBB,是目前临床治疗GBM的常规性化疗药物。TMZ可在DNA的嘌呤和嘧啶中添加一个甲基,从而导致碱基错配、细胞损伤及细胞凋亡[34]。但在临床上,TMZ的使用以口服为主,在药物生效过程中需要克服酶降解、首过效应和BBB等障碍,容易产生耐药性。近年来有研究发现,在使用TMZ对GBM模型动物进行治疗的过程中,相较静脉注射和灌胃,鼻脑给药途径能够显著抑制GBM的生长、减小肿瘤体积并延长动物中位生存期。Li等[35]研究发现,TMZ经鼻脑给药能够有效治疗GBM,且有效药物剂量较小,可作为新的GBM治疗策略。
3.4 紫苏醇(perillyl alcohol,POH) POH是一种从香菜、薰衣草、薄荷、芹菜籽等植物精油中分离出来的天然单环萜烯[36]。由于POH半衰期较短,临床上常通过口服胶囊的方式治疗GBM,但需要每天连续多次给药,易导致消化系统不良反应,如恶心、疲倦和呕吐等[37]。
目前研究发现,POH经鼻脑给药可有效延长患者生存期,且不良反应少[38]。Schönthal等[38]研究发现,经鼻脑途径给予不同剂量的POH均具有良好的耐受性,未报告严重不良事件。同时,6个月无进展生存率(progression free survival-6,PFS-6)为33%,12个月总生存率(overall survival-12,OS-12)为55%,中位总生存期为15个月。该研究结果表明,POH经鼻脑给药治疗GBM具有一定的安全性,且可有效降低复发率。
此外,Rieger等[39]发现,在POH鼻脑给药的基础上,给予生酮饮食可有效治疗复发性GBM。酮体会抑制GBM细胞的活力,但不会影响正常细胞的活力[40],因此,利用低碳水化合物、高脂肪的生酮饮食联合鼻脑给药POH可增加血酮体水平以治疗GBM,且能够降低药物毒性、保证疗效[41]。相较于单纯鼻脑给药POH,结合生酮饮食可明显降低GBM的复发率,这可能与患者的血脂和低密度脂蛋白胆固醇水平降低有关[42]。因此,POH经鼻脑给药能够有效治疗GBM,且与生酮饮食结合可明显提高疗效,具有巨大的潜在临床应用前景[43]。
总之,CC、5-FU、TMZ、POH等抗癌药物可通过鼻脑给药途径直接进入大脑,从而治疗GBM。
4 治疗GBM的鼻脑给药系统
治疗GBM的新型药物递送系统正在开发中,最近纳米颗粒(nanoparticles,NP)受到了极大的关注,NP、纳米乳剂和基于脂质的纳米制剂等主要用于鼻脑递送研究[44]。
聚合物NP在药物传递方面显示出了巨大的潜力。最近有学者提出了用于鼻内给药治疗GBM的负载褪黑素聚己内酯纳米颗粒(MLT-NP)[23]。褪黑素(melatonin,MLT)是一种由松果体合成和分泌的吲哚类激素[45],具有抗炎和抗氧化活性,可调节生物节律并抑制GBM细胞的增殖[46]。但MLT半衰期短、口服生物利用度低、溶解性差、首过效应明显,从而较难达到治疗浓度,限制了其临床应用[23]。de Oliveira Junior等[23]研究发现,MLT-NP制剂对GBM细胞具有很强的细胞毒性作用,与鼻内或口服途径给药的游离MLT相比,由于NP可从鼻腔直接到达大脑,因此MLT-NP鼻内给药增加了大脑中MLT的浓度,一定程度上提高了GBM的治疗效果[23]。
研究发现,与游离姜黄素(CM)相比,姜黄素负载纳米颗粒(CM-NP)对脑肿瘤切除后GBM干细胞(GSCs)的增殖、迁移和侵袭具有明显抑制作用,同时可诱导GSCs细胞周期阻滞和凋亡的发生[29]。该研究结果表明,CM-NP可有效地靶向GSCs,发挥较强的抗肿瘤作用。
目前TMZ虽然是GBM临床治疗的一线药物,但存在靶向性差、不良反应多和易产生耐药性等问题,限制了其在临床的应用。Wang等[47]研究发现,采用EphA3抗体和NP对TMZ进行修饰(抗EphA3-TMZ@GNPs)后,辅以鼻脑给药方式能够有效治疗GBM。与游离TMZ相比,抗EphA3-TMZ@GNPs可绕过BBB并靶向GBM细胞,产生较强的细胞毒性作用诱导凋亡发生,最终提高在GBM模型动物中的抗GBM效果,延长其生存期。
紫杉醇(paclitaxel,PTX)也是临床治疗GBM的常用药物,但由于其溶解度低并具有脱靶细胞毒性,临床应用时可能会引起多种不良反应[48]。Ullah等[22]研究发现,PTX结合NP并经过精氨酸-甘氨酰-天冬氨酸三肽(RGD)修饰(RGD-NP-PTX)后,能够通过鼻脑给药途径靶向进入GBM区域,并抑制肿瘤细胞的生长。此外,RGD-NP-PTX治疗仅对快速分裂的GBM有效,而对无法分裂的正常脑细胞没有明显伤害作用。因此,RGD-NP-PTX在治疗GBM方面具有良好的临床价值和应用前景。
5 干细胞治疗GBM
由于干细胞对肿瘤组织具有特异倾向性且能够穿过BBB,目前临床上已尝试使用干细胞治疗GBM[49-51]。此外,干细胞对损伤区域具有倾向性。有研究发现,神经干细胞(neural stem cells,NSCs)可迁移到神经系统的损伤部位,从而改善患者的认知功能,促进认知恢复[52];人脐带间充质干细胞(mesenchymal stem cells,MSCs)具有恢复神经细胞数量和减轻脑炎症的神经保护作用[53]。Portnow等[54]研究发现,NSCs本身具有较好的GBM治疗作用和安全性;Coccè等[55]研究发现,MSCs在体外可通过促进肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis inducing ligand,TRAIL)的过表达而诱导GBM细胞凋亡。目前临床上常用的干细胞主要为具有自我更新能力的多能干细胞,如NSCs和MSCs等[56]。
胶质瘤模型小鼠在放疗后经鼻脑递送MSCs可延长小鼠的寿命。Soria等[57]研究证实,鼻脑递送hMSCs可促进辐射诱导的脑损伤修复,改善神经功能。此外,MSCs治疗可防止机体炎症、氧化应激的发生,促进辐射后脑损伤修复并改善小鼠的神经功能,继而保证小鼠正常的生物学功能和主要器官的组织结构完整[58]。此外,鼻脑递送MSCs能够向颅内GBM区域迁移,并通过表达TRAIL促进GBM细胞凋亡,最终明显延长GBM模型动物的存活时间;同时配合放疗,可使CXC趋化因子配体12(CXC chemokine ligand 12,CXCL12)表达上调,增强MSCs向颅内肿瘤部位迁移的能力[59]。Reitz等[60]研究发现,通过鼻脑给药途径输送NSCs入脑可有效治疗GBM,且不良反应少、创伤性小;滴鼻6h后,NSCs通过嗅觉途径迁移入脑,并在GBM肿瘤部位发生特异性聚集,24 h细胞数量到达顶峰,表明NSCs对GBM肿瘤有一定的倾向性。
在干细胞通过鼻脑给药途径治疗GBM的过程中,应用纤维蛋白胶或甲巯咪唑(methimazole,MT)可以显著延长干细胞在鼻腔中的停留时间,从而提高干细胞的靶向治疗效果。例如,在NSCs鼻脑给药过程中应用MT可显著提高GBM模型小鼠的存活率[61]。
总之,干细胞对肿瘤的生长具有抑制作用,可诱导肿瘤消退。干细胞经鼻脑给药途径治疗GBM是一种安全、简单且有效的非侵入性方式,可最大程度地减轻放疗引起的不良反应,且干细胞对肿瘤组织的倾向性可提高治疗的靶向性,因此干细胞经鼻脑给药途径治疗GBM具有一定的临床应用价值。
6 总结与展望
由于GBM具有浸润生长的特性,手术不能完全切除肿瘤组织,同时由于BBB会限制大部分药物入脑,化疗药物的治疗效果不佳,最终导致GBM患者预后较差,生存率较低。通常情况下,口服给药被认为是一种最方便的治疗方式。然而,治疗GBM的药物(如TMZ)要以其生物活性形式到达大脑必须通过BBB,在此过程中药效降低。
目前,在GBM的治疗中,鼻脑途径是可绕过BBB的一种非侵入性给药方法,较其他方法具有潜在的优势。本文主要探讨了通过鼻脑途径给予抗癌药物CC、5-FU、TMZ和POH等对GBM的治疗作用。鼻脑给药后药物具有更好的生物分布和更高的治疗效果(图1)。鼻脑给药POH在临床试验中表现出较好的耐受性和较高的患者依从性。临床应用的干细胞(如NSCs和MSCs等)对GBM具有倾向性,使其通过鼻脑给药途径能够保证较强的靶向性且不良反应较少。在鼻脑给药递送方面,已经设计和研究了包裹在纳米结构载体(纳米乳液、微乳、聚合物和脂质纳米粒)中的药物,以提高鼻腔到大脑的药物输送效率。其中新型制剂提供了表面修饰的纳米载体,能够靶向GBM细胞输送特定药物,同时减轻对鼻黏膜的毒副作用。尽管目前针对GBM的鼻脑给药方式研究较少,但该给药方式已在临床上配合部分新型药物或成熟药物用于GBM的初期治疗,未来可为GBM患者带来新的治疗选择。
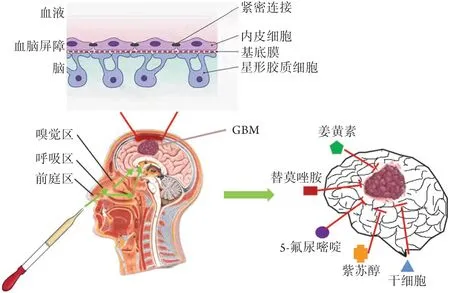
图1 鼻脑给药途径治疗胶质母细胞瘤(GBM)Fig. 1 The nose-to-brain drug delivery approaches for treatment of glioblastoma (GBM)

