固相吸附材料DMDODGA/P120对Sr2+的吸附性能
范 磊,王文涛,张 烨,刘栎锟
中国原子能科学研究院 放射化学研究所,北京 102413
高放废液(HLLW)中,放射性比活度大、发热量大、半衰期长的高释热β放射性元素90Sr是较难处理的核素之一。如果能将90Sr从HLLW中分离出来,不仅能减少玻璃固化体积、缩短废液冷却的时间,还能减少热量的释放,有利于地质处置时的操作简化和节约成本。
Sr的水溶液化学性质较稳定,不会发生氧化还原反应。在传统的液液萃取体系中,Sr2+可以与一些萃取剂形成稳定的中性配合物,从而进入有机相达到分离的目的。目前研究的沉淀法、离子交换法、膜分离法均有较多缺陷,不适用于实际提取过程。目前比较适合投入应用的方法有色层分离法及溶剂萃取法。
萃取色层分离法(extraction chromatography, EXC)是以吸附在惰性载体上的萃取剂作为固定相,以无机的水溶液作为流动相,用于分离无机物质的一种新型柱色层法[1]。常见的载体有硅胶[2]、大孔树脂[3-6]和大孔硅基SiO2-P[7-16]等。


SA:萃取段;SB:反萃段;X:有机萃取剂;F:料液;S:洗涤剂;P:有机相;W:水相萃残液图1 酰胺荚醚萃取Sr的流程Fig.1 Process of extracting Sr with amido podand
基体是聚苯乙烯和二乙烯苯基共聚物或聚甲基丙烯酸酯[21]的载体P120,其作为高分子介质的化学稳定性好,酸性到碱性的洗脱液均适用于此材料。且P120主要以色散力的方式与萃取剂结合,和萃取剂官能团间的作用力不强,所以萃取剂的官能团可以暴露在P120的表面上,使其保持一定的萃取活性。
酰胺荚醚类化合物二甲基二辛基双酰胺荚醚(DMDODGA,结构示于图2),其结构与TODGA相似,含有的醚氧键—(CH2OCH2)能与金属离子很好的配位。与TODGA相比,DMDODGA作为不对称酰胺荚醚,酰胺键上的取代基有两个甲基,萃取的位阻效应小,所以在与Sr2+形成萃合物的过程中,可以扩充萃取容量[22],并使达到平衡的时间缩短。

图2 DMDODGA的结构式Fig.2 Structure of DMDODGA
本工作拟采用DMDODGA作为萃取剂,负载到载体P120上来制备萃淋树脂DMDODGA/P120,并探究其对于Sr2+的吸附性能。
1 实验部分
1.1 主要仪器及试剂
DMDODGA,委托合成,分析纯(纯度95%以上),北京百灵威科技有限公司;P120,北京元宝山色谱科技有限公司,平均粒径为55 μm ,比表面积为520 m2/g ,细孔容积为1.17 mL/g,与萃取剂结合的色散力作用能大小在10~20 kJ/mol 左右;硝酸锶,分析纯,天津市永大化学试剂开发中心;二氯甲烷、硝酸等其它化学试剂均为市售分析纯,国药集团化学试剂有限公司。
JA5003N电子天平,精度0.001 g,德国赛多利斯集团;RE-6000A型旋转蒸发仪,上海亚荣,主机转速10~150 r/min,主机升降0~180 mm;电感耦合等离子体原子发射光谱(ICP-AES),测量误差为5%,美国PerkinElmer公司;布鲁克Tensor 27傅里叶变换红外光谱仪,德国布鲁克公司;elementar vario EL CUBE有机元素分析仪,德国艾利蒙塔公司;JSM-6700F冷场发射扫描电子显微镜,日本电子(JEOL)公司;LPD2500型多管漩涡混合仪, 莱普特科学仪器有限公司。
1.2 DMDODGA/P120的制备
称取一定量的P120(或者其他载体)于250 mL圆底烧瓶中,用100 mL二氯甲烷将其溶胀4~6 h,加入一定比例的DMDODGA(DMDODGA与P120的质量比为1∶2),搅拌120 min,将混合物在室温下置于旋转蒸发仪上,打开真空泵,旋蒸20 min除去二氯甲烷,直至混合物成松散的粉末。将蒸干的大烧瓶用密封膜封口(留下通气孔),置于真空干燥箱中,60 ℃以上真空烘干4 h以上,得白色松散的萃淋树脂DMDODGA/P120。
1.3 样品表征
用JSM-6700F冷场发射扫描电子显微镜观察材料的整体形貌特征。采用布鲁克Tensor 27傅里叶变换红外光谱仪表征材料的表面基团价键,扫描范围为500~4 000 cm-1,分辨率为4 cm-1。采用德国 elementar vario EL CUBE有机元素分析仪对材料进行元素分析(C、N、H、O元素),可以计算出酰胺荚醚在载体上的负载率。
1.4 静态吸附实验
吸附剂平衡时间确定及动力学曲线研究:配制酸浓度为3.0 mol/L的100 mg/L Sr2+溶液一定量(3~5 mL)置于离心管中,按固液比为10 g/L加入DMDODGA/P120,室温(23~25 ℃)下振荡。每隔一段时间后,用滤膜过滤取清液,用电感耦合等离子体原子发射光谱(ICP-AES)测定溶液中Sr2+的浓度。绘制动力学曲线,可以分析其动力学吸附反应级数。
吸附剂平衡吸附容量计算公式如式(1)所示。
(1)
式中:ρ0,吸附前料液中金属离子的初始质量浓度,mg/L;ρe,吸附达到平衡时料液中剩余的金属离子质量浓度,mg/L;m,吸附达到平衡时料液中吸附剂的质量,mg;V,所加料液的体积,L。
为探究吸附反应的吸附机制,吸附动力学数据分别用准一级和准二级动力学方程进行分析。
准一级动力学方程可以用式(2)表示。
(2)
式中:qt,t时刻的吸附量,mg/g;qe,吸附平衡时的吸附容量,mg/g;k1,准一级动力学方程速率常数,min-1。边界条件可以定义为:
当t=0,qt=0;当t=t,qt=qe代入式(2)积分,可表达为式(3):
qt=qe(1-e-k1t)
(3)
两边同时取对数,整理可得式(4):
(4)
准二级动力学方程可以用式(5)来进行表示:
(5)
式中k2为准二级动力学方程速率常数,g/(mg·min)。边界条件可以定义为:当t=0,qt=0;当t=t、qt=qe代入式(5)积分,可表达为式(6):
(6)
将实验数据代入准一级和准二级动力学方程模型拟合即可得到对应参数。
将该实验的条件作为标准实验条件,后续其他因素的影响将在此标准实验条件下,通过控制变量法进行探究。
吸附剂吸附等温线分析:其余条件同标准实验条件,将DMDODGA/P120加入不同初始浓度的Sr2+溶液,吸附平衡后取样测定溶液中Sr2+的浓度。绘制吸附剂对Sr2+的吸附等温线,即可分析吸附Sr2+过程的吸附模型。
使用Langmuir(式(7))、Freundlich(式(8))吸附等温线对吸附数据进行拟合。Langmuir模型是假设吸附为单层吸附、粒子均消耗同样的能量被吸附到吸附剂表面;Freundlich模型是基于非均匀的吸附剂表面而建立的经验吸附平衡模式。
(7)
(8)
式中:ρe,吸附平衡时液相吸附质的质量浓度,mg/L;qe,吸附平衡时的吸附容量,mg/g;qm,饱和吸附容量,mg/g;KL,Langmuir参数;KF,Freundlich参数;n,Freundlich经验参数。
将实验数据代入吸附模型进行拟合,即可得到吸附模型的参数。
HNO3浓度影响实验:其余条件同标准实验条件,将DMDODGA/P120加入不同HNO3浓度(0.1、0.5、1.0、1.5、2.0、3.0、4.0、5.0 mol/L)的Sr2+溶液中,吸附平衡后取样测定Sr2+的浓度进行分析。
固液比影响实验:其余条件同标准实验条件,按固液比分别为1、2.5、5、10、20、50、100 g/L加入DMDODGA/P120,吸附平衡后取样测定溶液中Sr2+的浓度进行分析。

利用解吸分配系数K′d来表达解吸程度,K′d的表达式如式(9)所示:
(9)
式中:ρ0,吸附前料液中Sr2+的初始质量浓度,mg/L;ρe,吸附达平衡时料液中剩余的Sr2+质量浓度,mg/L;ρd,解吸后稀酸中Sr2+的平衡质量浓度,mg/L;m,吸附达到平衡时料液中吸附剂的质量,mg;V,所加料液的体积,L。
温度影响实验:其余条件同标准实验条件,DMDODGA/P120在不同温度下(20、25、30、35、40、45、50 ℃)吸附Sr2+,达吸附平衡后取样测定溶液中Sr2+的浓度进行分析。
计算吸附分配系数Kd(式(10)):
(10)
式中:ρ0,吸附前料液中Sr2+的初始质量浓度,mg/L;ρe,吸附达平衡时料液中剩余的Sr2+质量浓度,mg/L;m,吸附达到平衡时料液中吸附剂的质量,mg;V,所加料液的体积,L。
为简化处理过程,忽略其他因素由于温度引起的变化,在吸附热力学中,吸附过程的平衡常数K=qe/ρe=Kd[25]。根据吉布斯自由能的定义式,可得Kd与ΔH和ΔS的关系式(式(11))。
ΔG=ΔH-TΔS=-2.303RTlgKd
(11)
辐照稳定性:以60Co作为辐照源,对吸附材料DMDODGA/P120进行辐照稳定性的测试,辐射剂量分别为5×103、104、105、106、107Gy。将辐照过后的DMDODGA/P120在标准实验条件下吸附Sr2+,吸附平衡后取样测定溶液中Sr2+的浓度进行分析。
1.5 动态吸附实验
采用HNO3浓度为3.0 mol/L的100 mg/L Sr2+溶液,使用的柱子尺寸为φ6 mm×300 mm,装载DMDODGA/P120的体积为1.38 cm3,设置的流速为0.5 mL/min,每隔一段时间取样,用ICP-AES测定Sr2+的浓度,计算出吸附剂对Sr2+的吸附容量q(式(12))和总去除率η(式(13)):
(12)
(13)
式中:v,流速,mL/min;m,所加吸附剂质量,g;t,流程时间,min;ρ′0,进水中Sr2+的初始质量浓度,mg/L;ρ′,出水中Sr2+的质量浓度,mg/L;A,穿透曲线的积分面积,以t为横坐标,ρ′/ρ′0为纵坐标。
通过计算还可以得到交换区高度Hz(式(14)):
(14)
式中:tT,从开始交换至交换完全移出交换区的时间,min;HT,交换柱内树脂床的总高度,cm;tB,交换柱的穿透时间,min;f,交换区内已经交换的树脂分数。其中可认为f近似等于总去除率η,tT约等于交换达到饱和的时间。
2 结果与讨论
2.1 吸附剂的表征
P120和DMDODGA/P120的SEM电镜扫描结果示于图3。将放大500倍的未负载的P120与负载DMDODGA后的P120的SEM图像进行对比可以看出,负载DMDODGA后P120的颗粒大小与负载前没有明显改变,外形仍呈均匀规则的球形,直径在50~90 μm,大部分P120保持结构完好。该结果说明DMDODGA的负载并没有破坏原有载体P120的结构。由此判断,大部分DMDODGA通过旋转蒸发法成功负载到P120的空隙中。DMDODGA/P120微球表面粗糙,存在大量缝隙,该结构有利于吸附过程进行。

图3 P120(a)和DMDODGA/P120(b)的SEM图像(×500)Fig.3 SEM picture of P120(a) and DMDODGA/P120(b)(×500)
对DMDODGA/P120、DMDODGA与未负载DMDODGA的P120进行元素分析,得到结果列于表1(分别计算两组样品的负载量后取均值)。由于P120中不含N元素,所以可以通过元素守恒计算出每100 g P120负载的DMDODGA质量。通过两组样品的测定结果,算得每100 g P120分别负载54.3 g和51.8 g DMDODGA,故可得平均每100 g P120负载了53.1 g DMDODGA,与制备过程中DMDODGA和P120所用的质量比相符。
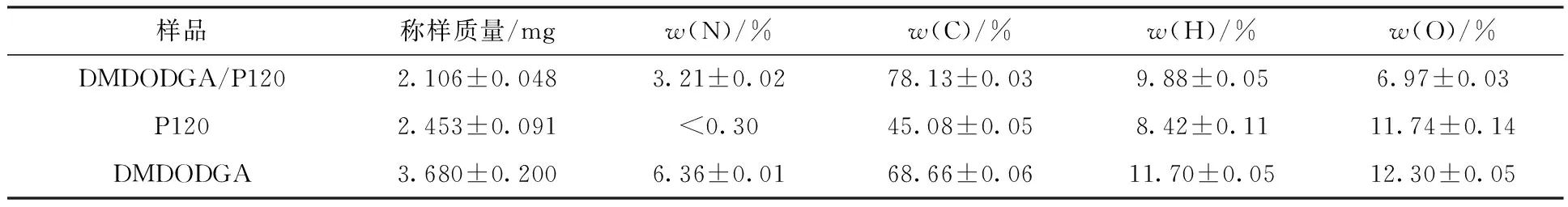
表1 DMDODGA/P120、DMDODGA与P120的元素分析结果Table 1 Elements analysis results of DMDODGA/P120, DMDODGA and P120
DMDODGA、DMDODGA/P120和P120的红外光谱图示于图4。对各个特征峰的位置作对比以后可以得到,DMDODGA/P120与P120的吸收峰峰形及峰位大致相同,所以可初步说明DMDODGA/P120在制备过程中没有改变P120原有的化学结构。在波数<1 000 cm-1的区间,DMDODGA/P120与P120拥有相同的特征峰。但在波数>1 000 cm-1的区间,经过比对可得到明显的结果,即DMDODGA/P120中也存在着与DMDODGA相同的特征峰,如波数为1 657.68 cm-1处对应于酰胺基团中C=O双键的伸缩振动以及波数为1 150 cm-1左右处对应于脂肪醚键R—O—R的伸缩振动,而这两个特征峰是P120所不具备的。因此,基本可以得到DMDODGA已经成功地复合并固定在P120中、并且复合过程为物理过程的结论。

1——DMDODGA,2——DMDODGA/P120,3——P120图4 DMDODGA、DMDODGA/P120和P120的红外光谱Fig.4 FTIR spectrums of DMDODGA, DMDODGA/P120 and P120
2.2 静态吸附实验结果
2.2.1吸附动力学实验 标准实验条件下,DMDODGA/P120吸附Sr2+达到平衡后料液的剩余浓度列于表2。由表2可知,10 min后Sr2+剩余质量浓度测量值的平均值约为73.2 mg/L。由于所用ICP-AES的测量误差为5%,通过计算可知所测数据的误差未超过仪器的测量误差。图5为Sr2+的吸附动力学曲线。从图5曲线可知,10 min吸附基本达到平衡。经过空白实验,P120对于Sr2+无特异性吸附。根据实验结果,DMDODGA/P120在100 mg/L Sr2+溶液中对Sr2+的平衡吸附容量为2.82 mg/g。将平衡吸附容量对准一级和准二级动力学模型进行拟合,分别以lg(qe-qt)对t和t/qt对t作图,结果示于图6。由图6可以看出,准一级动力学方程几乎无法拟合,相关系数r2为负值,代表线性模型比取平均值拟合效果还差。而准二级动力学方程的拟合线性关系较好,r2=0.998 96。故吸附剂对Sr2+的吸附过程更符合准二级动力学方程。准二级动力学方程是基于吸附剂与吸附质之间的化学吸附假设,二者之间可发生共用或交换电子的现象。因此可以推断出Sr2+的吸附过程有化学吸附的特征,离子与材料之间结合力较强。由截距计算可得k2=0.475 2。由于该吸附过程对Sr2+更符合准二级动力学方程,而吸附剂是固态,故其很可能与Sr2+形成2∶1配位的配合物,故吸附过程可以表示为如下反应式:
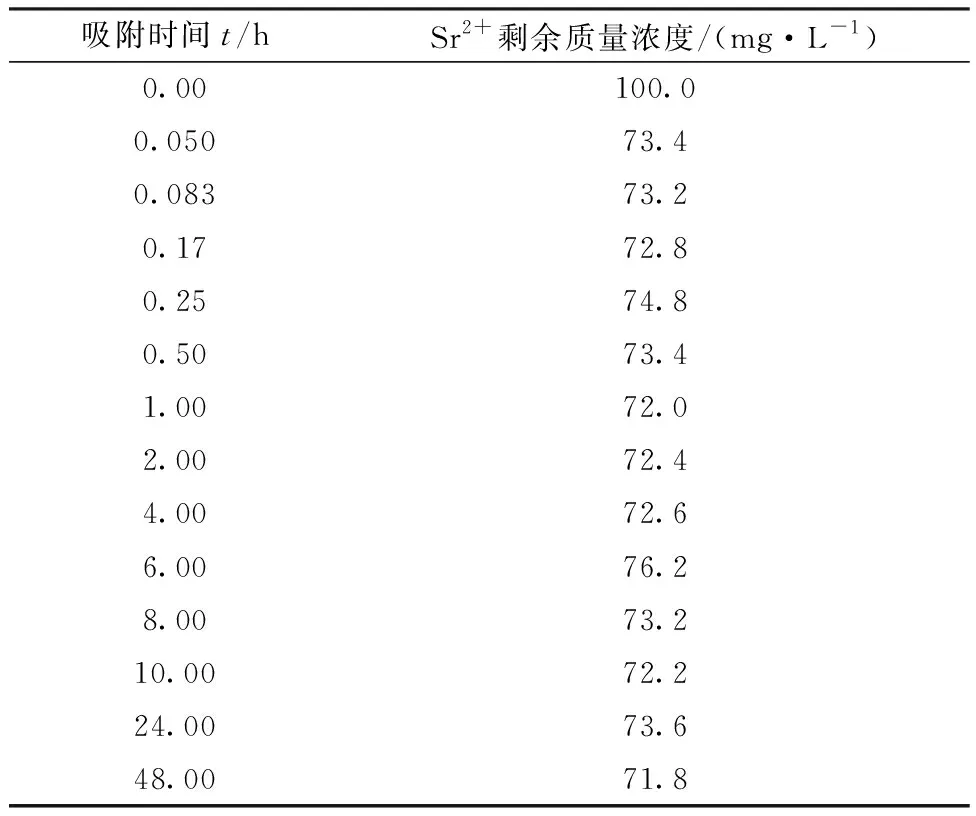
表2 Sr2+浓度随时间变化结果Table 2 Results of Sr2+ concentration changes with time
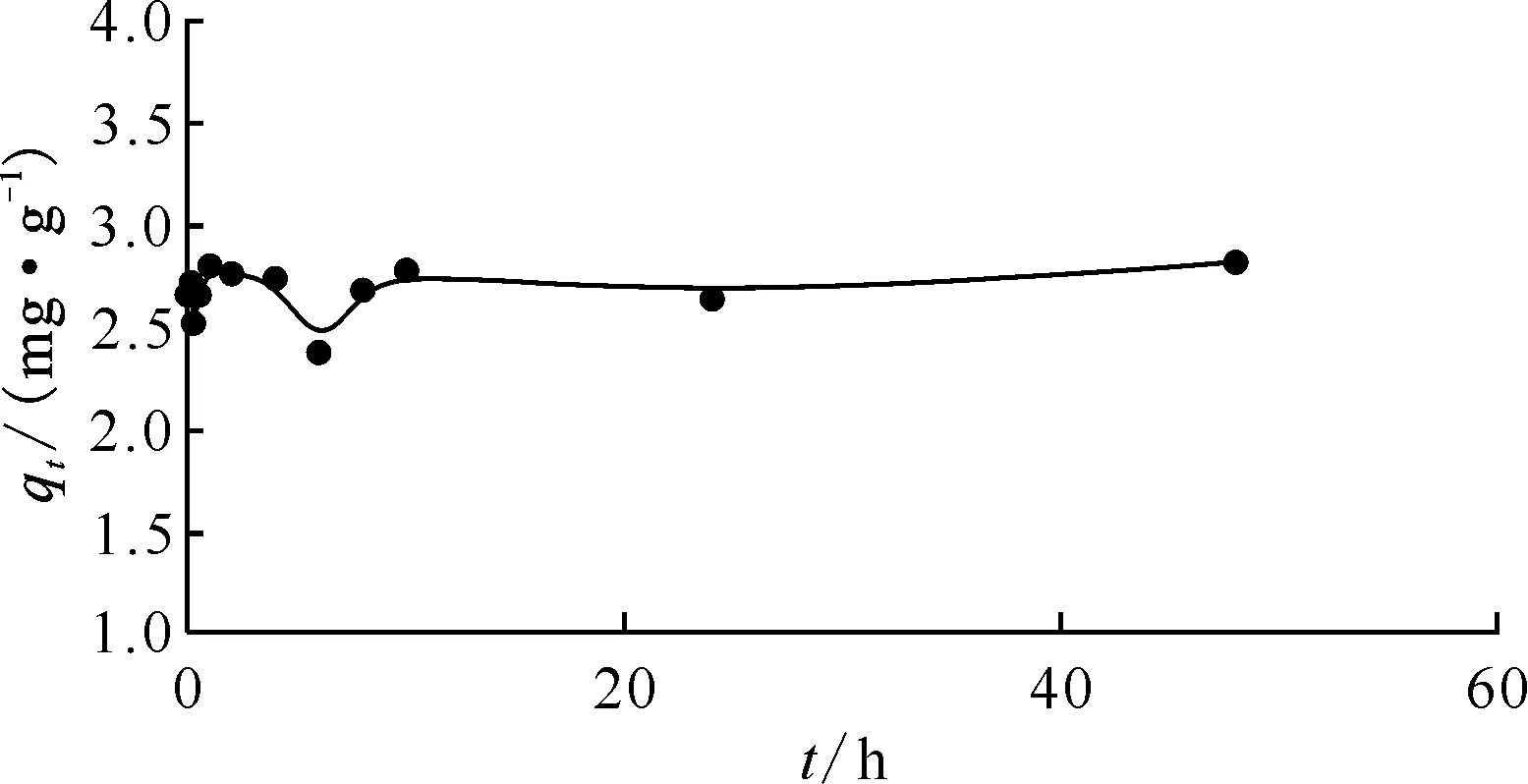
m/V=10 g/L,c(HNO3)=3.0 mol/L,ρ0=100 mg/L,23.1 ℃图5 Sr2+的吸附动力学曲线Fig.5 Adsorption kinetic curve of Sr2+
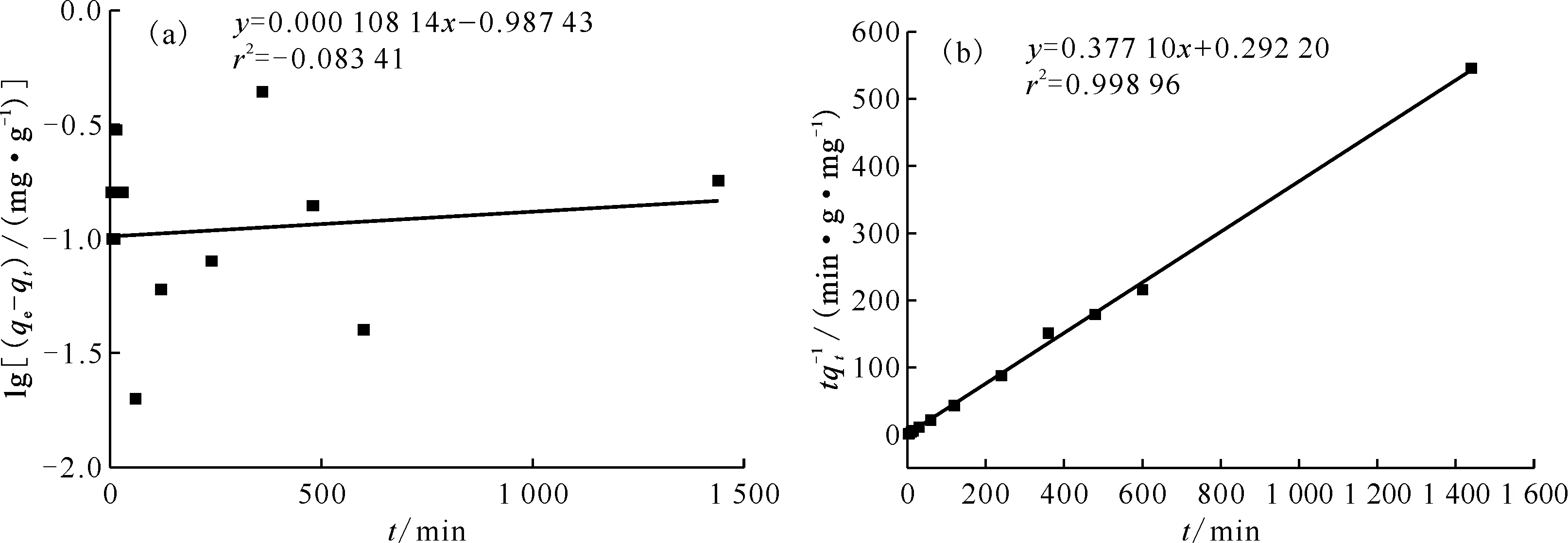
图6 准一级动力学(a)与准二级动力学(b)拟合模型Fig.6 Fitting models of quasi-first-order kinetics(a) and quasi-second-order kinetics(b)
Sr(NO3)2·2DMDODGA/P120
若用DMDODGA直接进行溶剂萃取,DMDODGA与Sr2+将形成3∶1配位的配合物[23]。产生差异的原因可能是DMDODGA与P120结合后空间位阻变大所导致的。由推断出的该反应式可以计算出,若DMDODGA/P120与Sr2+的配位反应完全,则理论的饱和吸附容量为39.507 50 mg/g;但是DMDODGA/P120与Sr2+的配位过程是可逆反应,不可能反应完全,无法直接用反应式进行计算。故饱和吸附容量应用另外的方法,即吸附模型作预测。
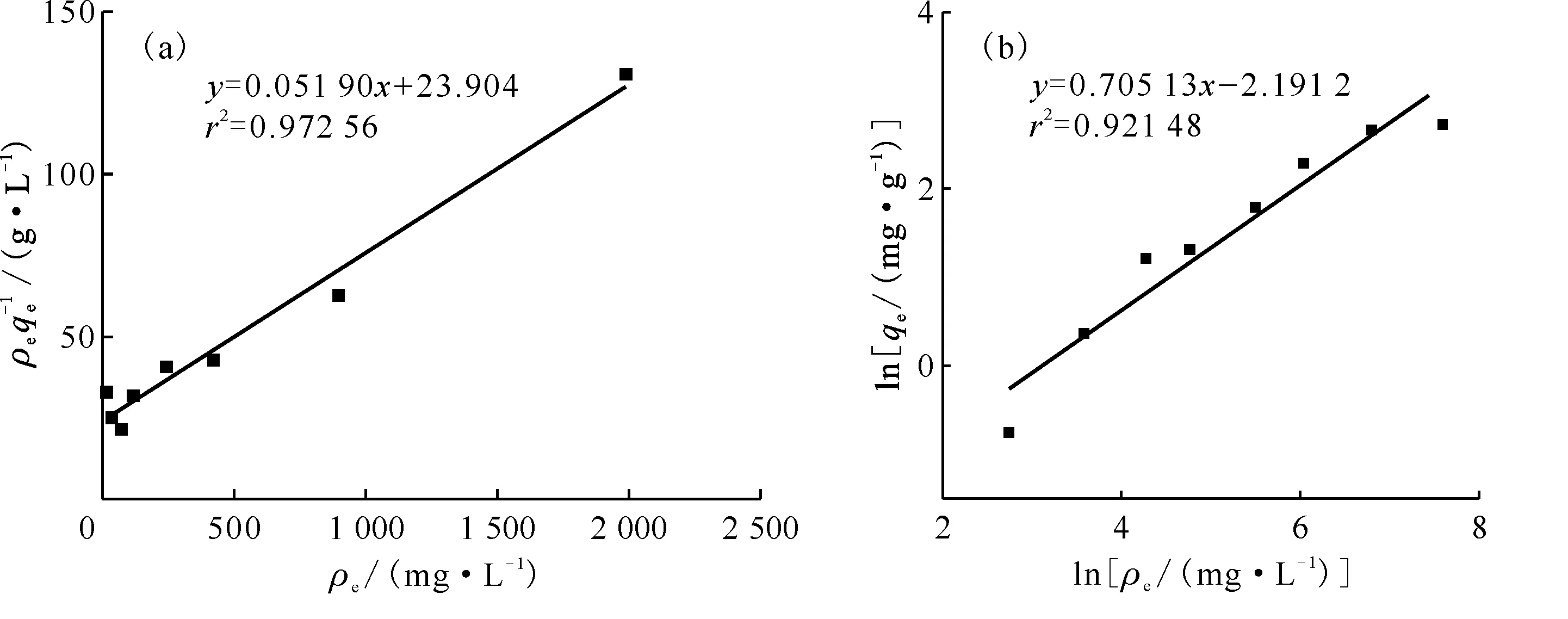
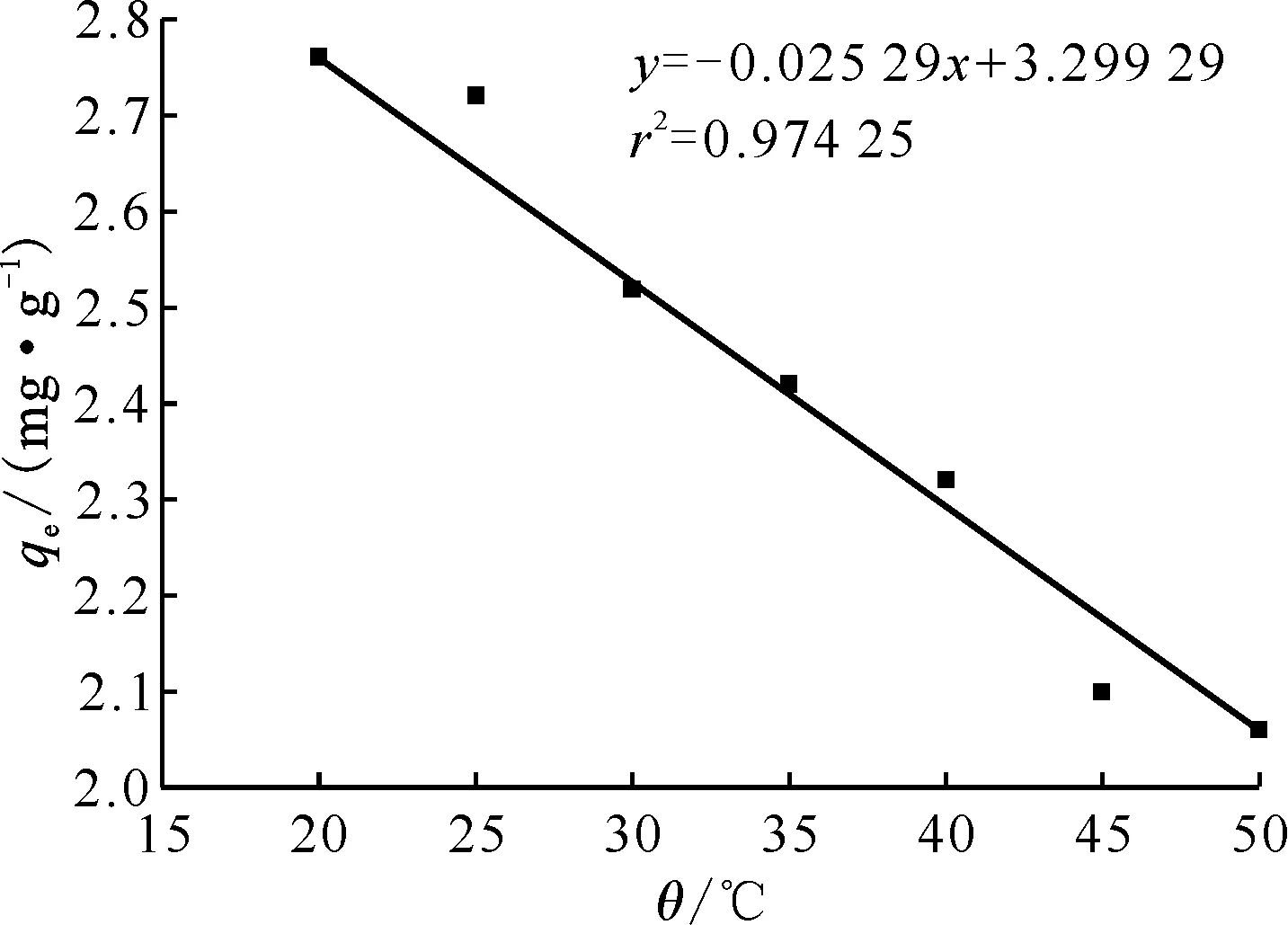
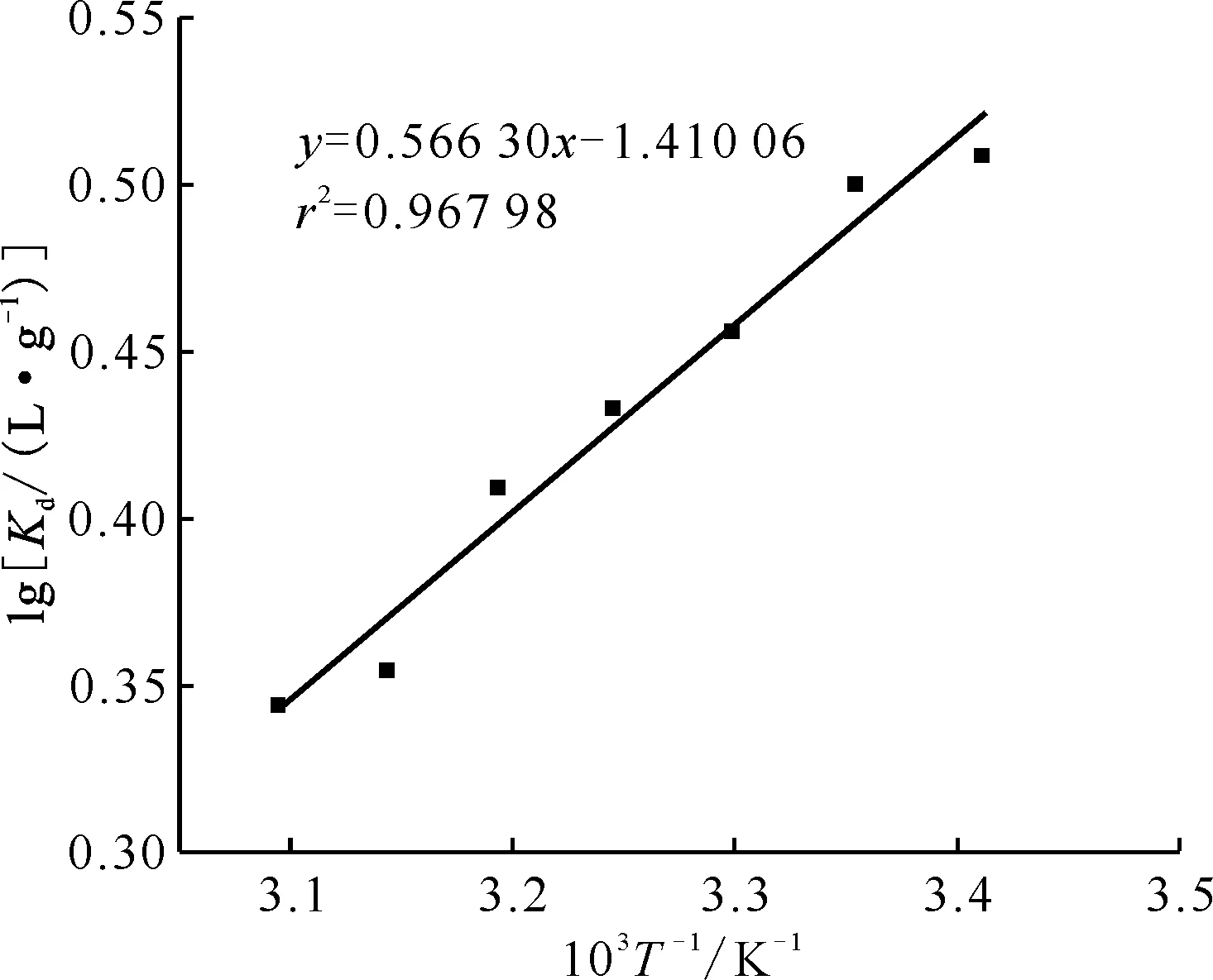
2.2.2吸附等温线结果 不同初始Sr2+浓度下DMDODGA/P120吸附Sr2+达到平衡后料液中的平衡浓度ρe及吸附材料的平衡吸附容量qe计算结果列于表3。分别将ρe/qe对ρe作图、lnqe对lnρe作图进行拟合,得到的结果示于图7。拟合模型计算出的各参数列于表4。从表4拟合结果可以看出,两种模型拟合效果均较好,相关系数均较高。由于Langmuir模型是Freundlich模型的一种简化计算,所以可以认为DMDODGA/P120对Sr2+的吸附过程是符合Langmuir模型的。所以可知吸附剂对Sr2+的吸附过程是发生在吸附剂均匀表面的单层吸附,即将Sr2+单层均匀吸附到微球表面后,再与微球表面的萃取剂进行化学反应的一个化学吸附过程。通过该模型计算的该过程的饱和吸附容量约为19.267 82 mg/g,低于理论饱和吸附容量(39.507 50 mg/g),这除了配位反应无法完全外,还有Sr2+难以全部吸附到吸附位点上的原因。在Freundlich模型中,KF表示吸附剂对Sr2+的吸附能力,n值反应了吸附剂的不均匀性或吸附反应强度。DMDODGA/P120对Sr2+的吸附过程1 表4 Langmuir与Freundlich吸附模型参数Table 4 Langmuir and Freundlich adsorption model parameters 图7 吸附曲线对Langmuir模型(a)与 Freundlich模型(b)的拟合Fig.7 Fitting of adsorptions curves to Langmuir model(a) and Freundlich model(b) 表3 吸附等温线实验结果Table 3 Results of adsorption isotherms experiment 2.2.3HNO3浓度对Sr2+吸附性能的影响 图8是DMDODGA/P120吸附Sr2+的平衡吸附容量qe随HNO3浓度的变化关系。由图8可以看出,当HNO3浓度从0.1 mol/L到5.0 mol/L增加时,吸附材料对Sr2+的平衡吸附容量先增后减。实验结果表明,DMDODGA/P120在酸度为0.5~2.0 mol/L时的平衡吸附容量达到最大,且在HLLW处理要求的3 mol/L酸度下的平衡吸附容量未有明显降低,在酸度大于4.0 mol/L时平衡吸附容量才明显下降,故该材料能符合处理HLLW的酸度应用范围。HNO3浓度从0.1~2.0 mol/L增加时,DMDODGA/P120的吸附容量增加,说明DMDODGA与Sr2+之间的配位作用占主导地位,即DMDODGA/P120对Sr2+的吸附占主导地位。此时HNO3浓度增加,盐析效应增强使得水相离子强度增加,促进了Sr2+的萃取。当酸度>3.0 mol/L时吸附容量显著下降,可能的原因是因为HNO3中的H+参与了萃取反应,与酰胺荚醚发生配位,和Sr2+产生竞争关系,使得酰胺荚醚吸附Sr2+的能力下降。 ρ0=100 mg/L,m/V=10 g/L,t=2.00 h,25.1 ℃图8 酸度对DMDODGA/P120吸附Sr2+的影响Fig.8 Influence of acidity on adsorption of Sr2+ by DMDODGA/P120 2.2.4固液比对吸附Sr2+性能的影响 图9为DMDODGA/P120吸附Sr2+的平衡吸附容量qe随吸附剂和料液固液比的变化关系。由图9可以看出,当固液比高于20 g/L时,平衡吸附容量的增幅减小,即增加吸附剂用量对吸附容量的提高不再明显。故可以考虑将DMDODGA/P120吸附Sr2+的固液比控制在20 g/L左右。 ρ0=100 mg/L,c(HNO3)=3.0 mol/L,t=2.00 h,23.1 ℃图9 固液比对DMDODGA/P120吸附Sr2+的影响Fig.9 Effect of solid-to-liquid ratio on adsorption of Sr2+ by DMDODGA/P120 2.2.5静态吸附解吸实验结果 事先已测得初始ρ0=105.6 mg/L,DMDODGA/P120吸附时的平衡ρe=78.2 mg/L,解吸以后测得的溶液中的Sr2+浓度列入表5。将计算出来的K′d对t作K′d-t曲线,结果示于图10。由实验结果可以得到,Sr2+在6 h时基本脱附,达到解吸平衡。平衡时,DMDODGA/P120的解吸分配系数为68.617 cm3/g。将脱附平衡时稀酸中的Sr2+浓度与吸附剂吸附平衡时吸附的Sr2+浓度进行对比可以发现,大部分Sr2+被洗脱至稀HNO3中。该结果说明0.1 mol/L的稀HNO3对Sr2+的解吸能力良好,解吸速率较快。 表5 吸附平衡的DMDODGA/P120解吸后溶液中Sr2+浓度Table 5 Concentration of Sr2+ in solution afterdesorption of adsorption equilibrium DMDODGA/P120 图10 DMDODGA/P120解吸结果Fig.10 Result of DMDODGA/P120 desorption 2.2.6温度对吸附Sr2+性能的影响 图11为DMDODGA/P120吸附Sr2+的平衡吸附容量qe随温度的变化关系。由图11可以看出,随着温度的增加,qe在不断减小,通过该实验结果可初步判断DMDODGA/P120在HNO3中萃取Sr2+的过程为放热反应,且可以自发进行。以下通过计算进行验证。绘制lgKd-1 000/T曲线,结果示于图12。图12拟合直线r2=0.967 98,说明线性拟合效果良好,根据斜率和截距即可求出ΔH=-10.843 6 kJ/mol,ΔS=-27.000 2 J/(mol·K)。故在25 ℃室温条件(298.15 K)下,吸附过程的吉布斯自由能变ΔG=ΔH-TΔS=-2.793 5 kJ/mol。故该吸附过程是一个放热反应,能自发进行。 ρ0=100 mg/L,c(HNO3)=3.0 mol/L,m/V=10 g/L,t=2.00 h图11 温度对DMDODGA/P120吸附Sr2+的影响Fig.11 Effect of temperature on adsorption of Sr2+ by DMDODGA/P120 图12 lg Kd-1 000/T曲线Fig.12 lg Kd-1 000/T curve 2.2.7辐照稳定性实验结果 DMDODGA/P120吸附Sr2+的平衡吸附容量qe随辐射剂量变化关系示于图13。由图13可以看出,DMDODGA/P120的抗辐照性能较好,该吸附材料在辐射剂量小于106Gy时未出现较大程度的辐解,说明其可以用于高放射性的操作过程,即90Sr的吸附萃取过程中。 图13 不同辐射剂量下DMDODGA/P120的平衡吸附容量变化趋势Fig.13 Change of equilibrium adsorption capacity of DMDODGA/P120 at different radiation dose 为了进一步验证DMDODGA/P120对Sr2+的吸附特性,将其装入离子交换柱中进行了动态吸附性能研究,实验结果示于图14。 m=0.552 g图14 DMDODGA/P120对Sr2+的穿透曲线Fig.14 Breakthrough curve of Sr2+ from DMDODGA/P120 所用DMDODGA/P120的质量为0.552 g。从图14可以看出,穿透曲线的形状呈S型,表明萃取剂DMDODGA没有从载体P120中脱漏出来。ρ′/ρ′0=0.05,即5%的穿透点处理溶液量约为7.75 mL,大约5.6个柱体积左右被击穿。对Sr2+吸附饱和时的溶液处理量约为40 mL。通过积分公式计算可得,穿透点吸附容量约为1.371 mg/g,饱和吸附容量约为3.898 mg/g。交换柱对Sr2+的总去除率约为52.53%。 离子交换柱的高度HT=4.880 cm,tT=80 min,tB=16 min,f≈η=52.53%,所以计算可得交换区的高度Hz=6.294 cm。 和负载冠醚类化合物的固相吸附材料(例如负载杯[4]芳烃-双(二甲基苯并冠-6)(B4DC6)的固相吸附材料B4DC6/P120[21])进行对比后可以得到,DMDODGA/P120的吸附能力不如B4DC6/P120,但吸附平衡时间远低于B4DC6/P120,之后可尝试改良其酰胺键上的取代基来提高萃取剂的萃取能力。相比于B4DC6/P120,DMDODGA/P120对Sr2+的选择性较差。而在实际后处理过程中,由于在分离Sr2+的流程前,利用溶剂萃取法进行前处理后的HLLW中除了Sr2+,还存在其他二价金属离子,所以后续还需实验验证DMDODGA/P120对其他二价金属离子的分离性能是否能够满足分离要求。 (1) DMDODGA/P120对Sr2+的吸附平衡时间约为10 min,其吸附过程符合准二级动力学方程,吸附过程可以表示为: Sr(NO3)2·2DMDODGA/P120 (2) DMDODGA/P120对Sr2+的吸附性能随着酸度的升高先增大后减小,吸附的最佳酸度为0.5~2.0 mol/L HNO3;DMDODGA/P120吸附Sr2+的最佳固液比为20 g/L左右;0.1 mol/L稀HNO3对该材料的脱附性能良好,脱附速率较快;DMDODGA/P120吸附Sr2+的过程是一个放热反应,能自发进行;DMDODGA/P120的抗辐照能力强,可应用于放射性核素90Sr的吸附萃取过程中。 (3) DMDODGA/P120对Sr2+的动态穿透点吸附容量约为1.371 mg/g,动态饱和吸附容量约为3.898 mg/g;DMDODGA/P120交换柱对Sr2+的总去除率约为52.53%,交换区高度为6.294 cm。 (4) DMDODGA/P120的吸附平衡时间远低于负载冠醚类化合物的固相吸附材料B4DC6/P120,但吸附能力和选择性不如B4DC6/P120,之后可尝试改良其酰胺键上的取代基来提高其萃取能力,后续还需验证其对其他二价金属离子的分离性能是否能够满足分离要求。






2.3 动态吸附实验结果

3 结 论

