在H2SO4和HNO3体系中的电化学行为
邓怡琳,张 虎
中国原子能科学研究院 放射化学研究所,北京 102413




1 实验部分
1.1 仪器与试剂
CHI-760E电化学工作站,上海辰华仪器有限公司;比色皿型薄层光谱电化学池,1.0 mm光程长度,日本ALS有限公司;GB204型分析天平,精度为0.000 1 g,梅特勒-托利多国际贸易(上海)有限公司;VC3000型直流稳压电源,胜利仪器。
w=98%浓H2SO4、w=68%浓HNO3,分析纯,中国医药集团有限公司;高铼酸铵,纯度≥99%,麦克林公司。不同浓度的H2SO4、HNO3均由浓硫酸、浓硝酸和高纯水配制所得。


1.2 电化学测试
实验中采用三电极体系,铂盘电极(φ=3 mm)在H2SO4溶液中活化后作为工作电极,饱和甘汞电极(SCE)作为参比电极(下文中电压若无特殊说明均以SCE作为参照),铂盘电极(φ=3 mm)作为对电极,用高铼酸铵的H2SO4溶液、HNO3溶液作为电解液,在CHI-760E电化学工作站上进行了循环伏安、控制电位电解库仑的电化学测试。
1.3 恒流电解

2 结果与讨论
2.1 H2SO4体系
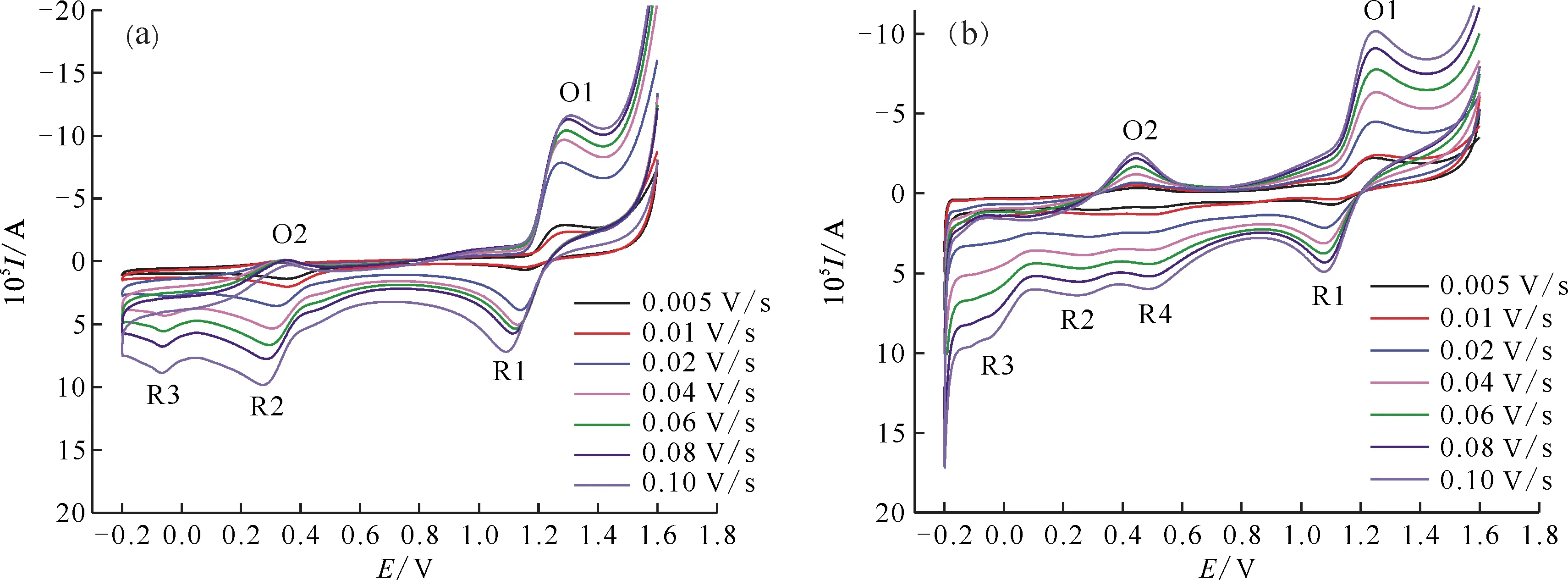
图1 和4.00 mol/L(b) H2SO4在不同扫描速率下的CV曲线Fig.1 Cyclic voltammograms of 2.00 mmol/L in 1.00 mol/L(a) and 4.00 mol/L(b) H2SO4 on Pt at different scan rates
根据图2中电流与时间的关系,积分得到电量Q=0.134 61 C,有:
式中:Q为还原消耗的总电量,C;V为溶液体积,L;n为电子转移数;NA为阿伏伽德罗常数。
可以求得n≈3.2。


Pt-ReO2·H2Oad+H2O



图2 在+0.8 V(vs. SCE)处的控制电位电解库仑法Fig.2 Bulk electrolysis with coulometry of 2.00 mmol/L in 4.00 mol/L H2SO4at +0.8 V(vs. SCE)

扫描速率0.10 V/s图3 H2SO4的CV曲线Fig.3 Cyclic voltammograms of 2.00 mmol/L

扫描速率0.10 V/s图4 1.00 mol/L(a)和4.00 mol/L(b) H2SO4中还原Re的循环伏安曲线Fig.4 Cyclic voltammograms of reduced rhenium in 1.00 mol/L(a) and 4.00 mol/L(b) H2SO4
根据文献[1]中提供的电位值,判断还原峰R2是ReO2还原到可溶性的Re(Ⅲ)的峰,反应为:

ReO2也可能通过Had-Pt还原到Re(Ⅲ):


氧化峰O2对应的反应是Re(Ⅲ)氧化到ReO2,反应为:

2.2 HNO3体系
还原峰R2所对应的反应为:

还原峰R4所对应的反应为:

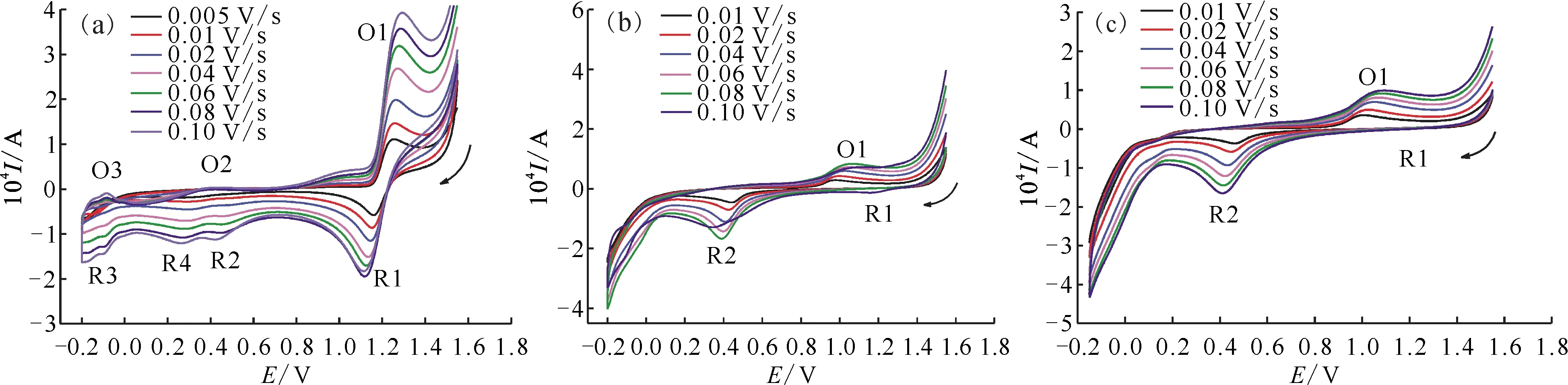
图5 在1.00(a)、2.00(b)、4.00(c) mol/L HNO3中的CV曲线Fig.5 Cyclic voltammograms of 1.00 mmol/L in 1.00(a), 2.00(b), 4.00(c) mol/L HNO3


图6 HNO3与含 的HNO3溶液的CV曲线Fig.6 Cyclic voltammograms of HNO3 and


HNO3浓度高时易被电解还原产生HNO2:


HNO2的生成:
HNO2可以将Re(Ⅲ) 迅速地氧化到Re(Ⅳ)。此时氧化峰O1所对应的反应应为Re(Ⅳ)到更高价态Re的氧化。
3 结 论


