人参皂苷Rh2和Rg3对胃癌细胞增殖和侵袭的影响Δ
刘元媛,王 欢,周 平,刘海林
(1.重庆两江新区第一人民医院药剂科,重庆 401147; 2.重庆医科大学中医药学院,重庆 400010)
胃癌的发生率在恶性肿瘤中居第4位[1]。胃癌的发生和发展是遗传、坏境和表观遗传等多种因素作用的过程,与抑癌基因的失活、原癌基因的激活以及多种分子水平和基因水平的变化密切相关[2-3]。对于胃癌的治疗通常以手术和辅助放化疗为主,但对于晚期侵袭和转移的患者治疗效果不佳。人参皂苷Rh2和Rg3是人参抗肿瘤的主要活性成分[4]。相关研究结果表明,人参皂苷Rh2和Rg3可以诱导细胞分化,阻滞细胞周期,抑制转移,诱导凋亡,调节免疫功能等[5]。程序性死亡蛋白配体1(PD-L1)为肿瘤免疫逃逸机制的核心调控分子,在适应性免疫抵抗中发挥着重要作用[6]。慢性感染引发T细胞持续性活化可促使PD-L1大量表达,影响T细胞的增殖能力和杀伤活性,导致T淋巴细胞耗竭[7]。因此,本研究选取人参皂苷Rh2和Rg3为研究对象,初步探讨其对胃癌细胞系MGC-803增殖和侵袭的影响,并探讨可能的发生机制。
1 材料
1.1 实验细胞
胃癌细胞系MGC-803(中国科学院上海细胞典藏库)。
1.2 仪器
CO2培养箱(美国Thermo Scientific公司);高速冷冻离心机(德国 Eppendorff 公司);蛋白质印迹电泳仪、电泳槽(美国Bio-Rad公司);-80 ℃低温冰箱(美国Thertno Scientific公司);Transwell小室(美国Corning公司)。
1.3 药品与试剂
人参皂苷Rh2和人参皂苷Rg3(吉林大学有机化学教研室,质量分数>98%,批号:201808-1);PD-L1载体质粒(美国Merck Millipore公司,批号:NAF1321);RMPIA 1640培养基、胎牛血清(美国Gibco公司,批号:J17008、181221);蛋白裂解液RIPA(上海碧云天生物技术有限公司,批号:9224);胎牛血清(吉玛基因公司,批号:A115121);Trizol试剂(上海生工生物工程有限公司,批号:180519);显色液、BCA试剂(美国TaKaRa公司,批号:190215、190127);RNA提取试剂盒(广州拓科达生物科技有限公司);反转录试剂盒(广州威佳科技有限公司,货号:556129);Lipofectamine 2000转染试剂盒(美国Invirogen公司);Annexin V-FTIC/PI试剂盒(上海碧云天生物技术有限公司)。
2 方法
2.1 细胞的培养及分组处理
于450 mL的RMPIA 1640培养基中加入浓度为10%的胎牛血清50 mL、100 U/mL青霉素和100 μg/mL链霉素5 mL,把胃癌细胞MGC-803加入培养基中,在5% CO2培养箱中培养,温度保持在37 ℃。处于对数生长期的细胞,经胰酶消化处理,以3 000 r/min离心(离心半径10 cm)5 min,然后去上清液,培养基重悬细胞后置于培养箱中常规培养,24 h以后更换液体。
将胃癌细胞MGC-803分为对照组、Rh2+Rg3组和Rh2+Rg3+PD-L1组。未经过人参皂苷Rh2和Rg3处理的MGC-803细胞设为对照组。确定药物对细胞的半抑制浓度(IC50),Rh2+Rg3组给予40 μg/mL混合有Rh2和Rg3的培养基,培养细胞24 h。将转染PD-L1载体质粒以3×103的密度经过质量浓度为40 μg/mL的人参皂苷Rh2和Rg3处理的MGC-803细胞设为Rh2+Rg3+PD-L1组,具体转染操作参照Lipofectamine 2000转染试剂盒的操作说明书。
2.2 细胞计数试剂盒8(CCK-8)法检测胃癌细胞MGC-803的增殖情况
采用CCK-8法检测胃癌细胞MGC-803的增殖情况,观察Rh2+Rg3和PD-L1对胃癌细胞增殖的调节作用。加入40 μg/mL的人参皂苷Rh2和Rg3或者PD-L1载体质粒以3×103的密度转染细胞,接种在96孔板上,并在37 ℃和5%CO2中孵育。每隔24 h,向每个孔中加入CCK-8溶液,至第5日结束,并使用酶标仪测定450 nm波长下的细胞数。最终,生成5 d的细胞生长曲线。
2.3 定量反转录聚合酶链反应(qRT-PCR)检测胃癌细胞MGC-803中PD-L1 mRNA表达
各组的胃癌细胞MGC-803转染 48 h后,进行收集,采用Trizol法从细胞中提取总RNA,利用反转录试剂盒从上述RNA反转录cDNA,最后利用由武汉巴菲尔公司合成PD-L1引物和GAPDH引物在应用生物系统7500实时PCR系统上进行PCR实验,反应条件为95 ℃预变性4 min,90 ℃变性20 s,45 ℃退火20 s,60 ℃延伸20 s,共设置45个循环。PD-L1引物序列:5′-ACCGGTTTACTGTCGCAT-3′(正向)和3′-CCTCTGCTCTGT GGGC-5′(反向);GAPDH引物序列:5′-GATGAACTCCCA CAGTGC-3′(正向)和5′-TCTGAGAGGC AGGGATG-3′(反向),按照试剂盒的使用说明书进行严格操作,采用ABI 7500实时PCR进行测量,采用2-ΔΔCt法计算PD-L1的相对表达量,以GAPDH为内参。
2.4 蛋白质印迹法检测胃癌细胞MGC-803中PD-L1蛋白表达
各组的胃癌细胞MGC-803转染 48 h后,进行收集,通过加入RIPA裂解缓冲液进行裂解,用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,然后转移到聚偏二氟乙烯(PVDF)膜上。转膜完全后拿出PVDF膜,5%脱脂奶粉中封闭1 h,PD-L1(1∶500稀释)一抗孵育,4 ℃冰箱中放置一夜,HRP二抗(1∶5 000稀释)避光孵育1 h,TBST洗3次,滴加ECL发光液,凝胶成像仪拍照显影。
2.5 Annexin-V检测胃癌细胞MGC-803的凋亡情况
将各组的胃癌细胞MGC-803接种于6孔板中72 h后,进行细胞收集,洗涂、固定和透化,按照Annexin V-FTIC/PI试剂盒说明书的操作步骤进行细胞染色,应用流式细胞仪检测,用FlowJo软件处理数据。
2.6 克隆形成实验
将各组的胃癌细胞MGC-803接种于琼脂覆盖的培养基的96孔板上,细胞在37 ℃的CO2培养箱中培养72 h,12 d后,使用Leica CTR MIC显微镜捕获每个孔中胃癌细胞的克隆图像,并使用Image J 1.49软件量化克隆数量。
2.7 Transwell检测胃癌细胞MGC-803的迁移情况
将Transwell小室取出,弃液体,PBS漂洗5 min,再用4%多聚甲醛固定15 min,在胎牛血清的RPMI-1640培养基中培养24 h,将100 μL细胞(1×105/mL)接种至24孔板中,然后放入含有20% FBS的RPMI-1640 600 μL,在37 ℃、5%CO2培养箱中孵育,用棉签轻轻擦去上室未迁移的细胞或未侵袭的细胞,迁移的细胞或入侵细胞用70%甲醛溶液固定30 min,并使用0.1%的结晶紫染色20 min,使用显微镜捕获每个孔中迁移的细胞的图像。
2.8 Transwell检测胃癌细胞MGC-803的侵袭情况
Matrigel胶稀释,取50 μL加入Transwell上室内,37 ℃培养箱中过夜,将Matrigel胶吸出,PBS冲洗,将各组的胃癌细胞MGC-803以1×104/mL接种于上室,孵育24 h,加入无血清培养液,下室加入含20%FBS培养液,孵育48 h,去除Transwell小室内的培养液,PBS冲洗,4%多聚甲醛固定,1%结晶紫染色侵袭的细胞,室温下放置20 min后,PBS冲洗,选取5个视野,倒置显微镜下观察,比较侵袭的细胞数目。
2.9 统计学方法

3 结果
3.1 各组胃癌细胞MGC-803增殖能力情况
第1日,三组胃癌细胞MGC-803的增殖能力无明显变化,差异无统计学意义(P>0.05);第2—3日,Rh2+Rg3组的细胞增殖能力明显低于对照组,差异有统计学意义(P<0.05);第4—5日,Rh2+Rg3组的细胞增殖能力明显低于对照组,Rh2+Rg3+PD-L1的细胞增殖能力明显高于Rh2+Rg3组,差异均有统计学意义(P<0.05),见图1。
3.2 各组胃癌细胞MGC-803中PD-L1的表达情况
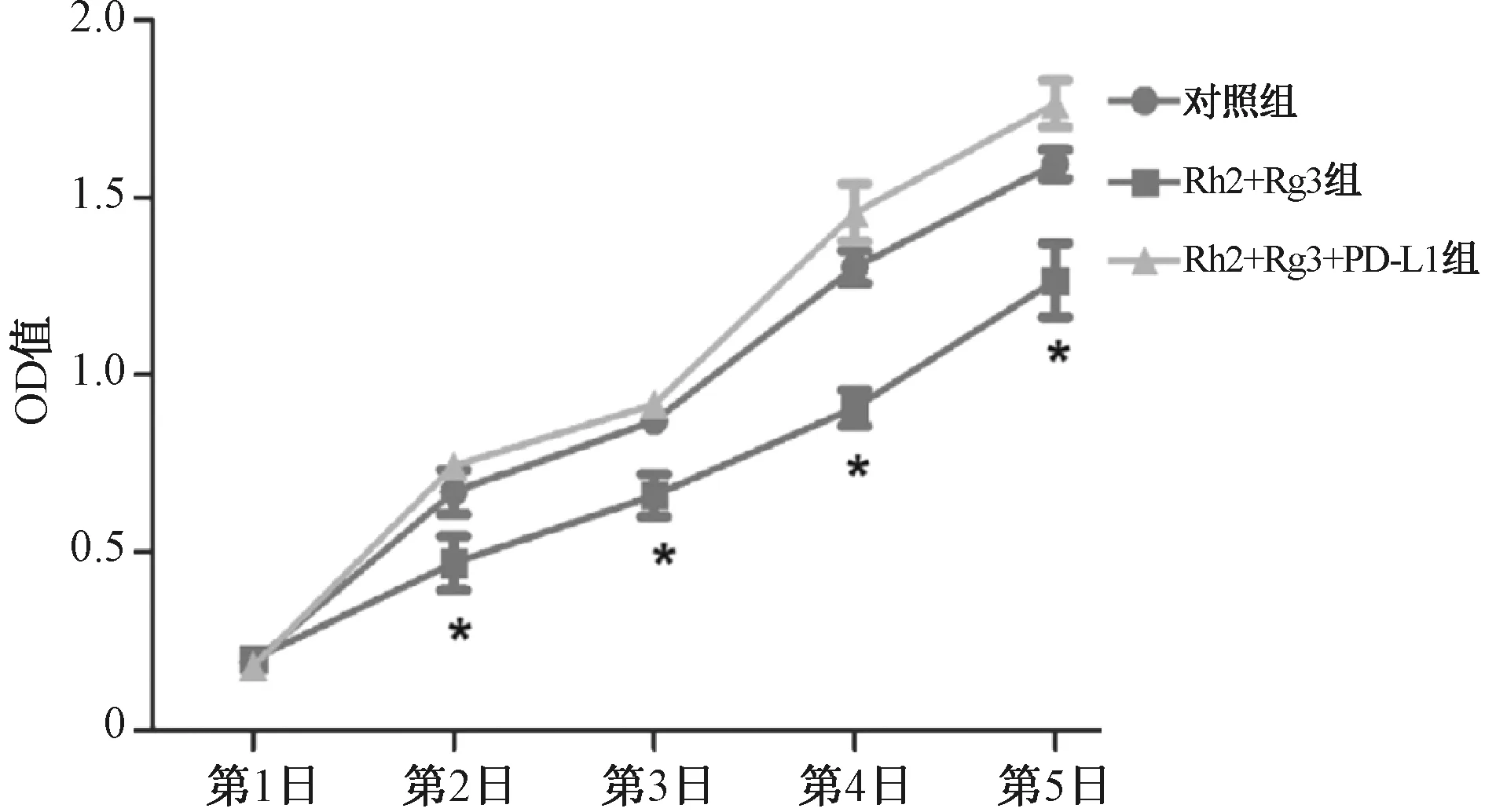
Rh2+Rg3组胃癌细胞MGC-803中PD-L1 mRNA和蛋白的表达明显低于对照组,Rh2+Rg3+PD-L1组的PD-L1 mRNA和蛋白的表达明显高于Rh2+Rg3组,差异均有统计学意义(P<0.05),见表1、图2。
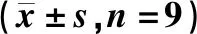
表1 人参皂苷Rh2+Rg3对胃癌细胞MGC-803中PD-L1表达的影响Tab 1 Effect of ginsenoside Rh2+Rg3 on the expression of PD-L1 in gastric cancer cell
与对照组相比,*P<0.05vs. the control group, *P<0.05图1 人参皂苷Rh2+Rg3通过抑制PD-L1对胃癌细胞MGC-803增殖能力的影响(n=9)Fig 1 Effect of ginsenoside Rh2+Rg3 on the proliferation capacity of gastric cancer cell MGC-803 by inhibiting PD-L1 (n=9)
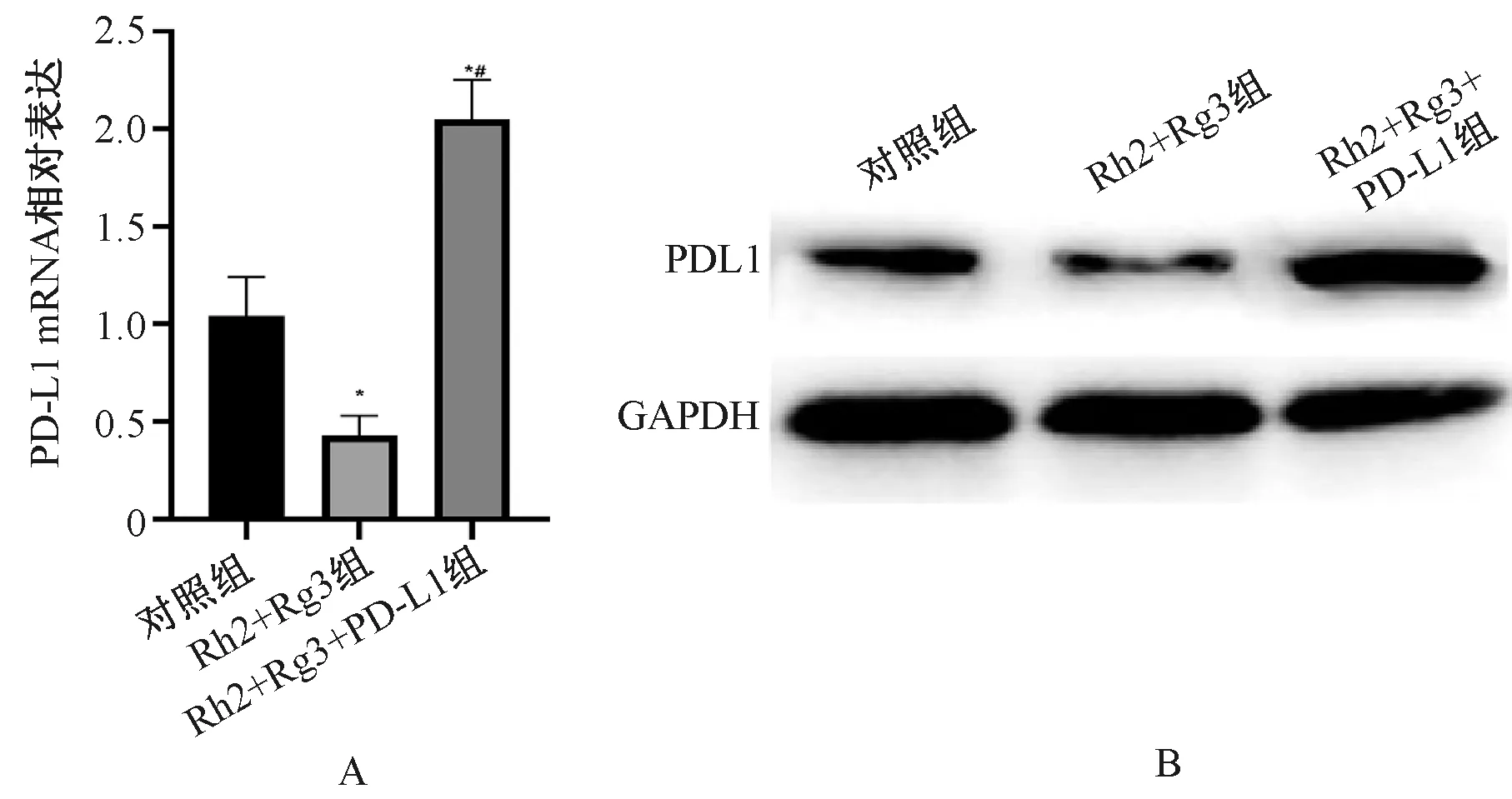
A.PD-L1 mRNA;B.PD-L1蛋白;与对照组相比,*P<0.05;与Rh2+Rg3组相比,#P<0.05A.PD-L1 mRNA;B.PD-L1 protein;vs. the control group, *P<0.05; vs. the Rh2+Rg3 group, #P<0.05图2 人参皂苷Rh2+Rg3对胃癌细胞MGC-803中PD-L1表达的影响Fig 2 Effect of ginsenoside Rh2+Rg3 on the expression of PD-L1 in gastric cancer cell MGC-803
3.3 各组胃癌细胞MGC-803的凋亡情况
Rh2+Rg3组胃癌细胞MGC-803的凋亡率明显高于对照组,Rh2+Rg3+PD-L1组的细胞凋亡率明显低于Rh2+Rg3组,差异均有统计学意义(P<0.05),见表2、图3。
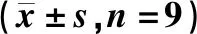
表2 人参皂苷Rh2+Rg3通过抑制PD-L1对胃癌细胞MGC-803凋亡的影响Tab 2 Effects of ginsenoside Rh2+Rg3 on the apoptosis of gastric cancer cell MGC-803 by inhibiting PD-L1
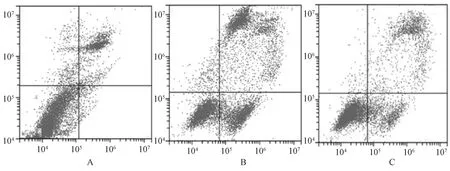
A.对照组;B.Rh2+Rg3组;C.Rh2+Rg3+PD-L1组A. control group; B. Rh2+Rg3 group; C. Rh2+Rg3+PD-L1 group图3 人参皂苷Rh2+Rg3通过抑制PD-L1对胃癌细胞MGC-803凋亡的影响Fig 3 Effect of ginsenoside Rh2+Rg3 on the apoptosis of gastric cancer cell MGC-803 by inhibiting PD-L1
3.4 各组胃癌细胞MGC-803克隆形成情况
Rh2+Rg3组胃癌细胞MGC-803克隆数量明显低于对照组,Rh2+Rg3+PD-L1组的细胞克隆数量明显高于Rh2+Rg3组,差异均有统计学意义(P<0.05),见表3、图4。
表3 人参皂苷Rh2+Rg3通过抑制PD-L1对胃癌细胞MGC-803克隆形成的影响Tab 3 Effect of ginsenoside Rh2+Rg3 on clone formation of gastric cancer cell MGC-803 by inhibiting PD-L1

A.对照组;B.Rh2+Rg3组;C.Rh2+Rg3+PD-L1组A. control group; B. Rh2+Rg3 group; C. Rh2+Rg3+PD-L1 group图4 人参皂苷Rh2+Rg3通过抑制PD-L1对胃癌细胞MGC-803克隆形成的影响Fig 4 Effects of ginsenoside Rh2+Rg3 on clone formation of gastric cancer cell MGC-803 by inhibiting PD-L1
3.5 各组胃癌细胞MGC-803的迁移和侵袭情况
Rh2+Rg3组胃癌细胞MGC-803的迁移细胞数和侵袭细胞数明显低于对照组,Rh2+Rg3+ PD-L1组的迁移细胞数和侵袭细胞数明显高于Rh2+Rg3组,差异均有统计学意义(P<0.05),见表4、图5。
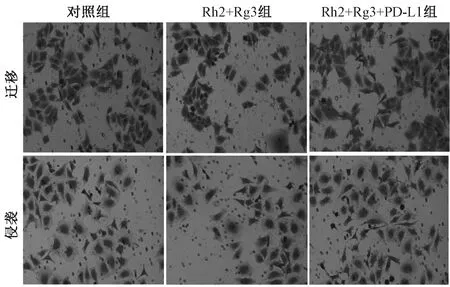
图5 人参皂苷Rh2+Rg3通过抑制PD-L1对胃癌细胞MGC-803迁移和侵袭的影响Fig 5 Effects of ginsenoside Rh2+Rg3 on the migration and invasion of gastric cancer cell MGC-803 by inhibiting PD-L1
表4 人参皂苷Rh2+Rg3通过抑制PD-L1对胃癌细胞MGC-803迁移和侵袭的影响Tab 4 Effects of ginsenoside Rh2+Rg3 on the migration and invasion of gastric cancer cell MGC-803 by inhibiting
4 讨论
人参皂苷Rh2和Rg3是人参抗肿瘤的活性成分。相关研究结果表明,人参皂苷Rh2和Rg3可以抑制肿瘤细胞的增殖,诱导细胞分化和肿瘤细胞的凋亡,抑制肿瘤细胞的侵袭和转移,逆转肿瘤细胞耐药,抑制肿瘤血管的形成[8]。人参皂苷Rh2和Rg3已被阐明在肿瘤的发生中发挥着主要作用[9]。本研究结果发现,人参皂苷Rh2和Rg3抑制了胃癌细胞的增殖、迁移和侵袭,促进了胃癌细胞凋亡,而大量PD-L1的加入则减弱了上述作用,表明人参皂苷Rh2和Rg3在胃癌中起抑癌作用,而PD-L1为肿瘤启动因子。人参皂苷Rh2、Rg3和PD-L1相互作用的研究,为了解人参皂苷Rh2、Rg3和PD-L1在胃癌中的作用机制提供了新的视角。
人参皂苷Rg3属于二醇皂苷,是人参中稀有的皂苷,具有抗炎、抗肿瘤、增强免疫能力和抑制血管生成等作用[10]。其与人参皂苷Rh2共同作用,可增强药效。根据本研究结果,人参皂苷Rh2和Rg3可能是胃癌患者治疗药物的潜在候选。PD-L1在维持正常机体保护性免疫和免疫耐受的平衡中起着至关重要的作用,PD-L1的表达上调是通过细胞内多种信号传导途径进行调节的,在肿瘤微环境免疫效应发挥着调控作用。在肿瘤微环境中,PD-L1表达上调,从而激活程序性死亡蛋白-1(PD-1)/PD-L1通路,介导肿瘤的免疫逃逸。PD-1/PD-L1是免疫抑制效应的调控因子,在胃癌方面已得到应用[11]。本研究以人参皂苷Rh2和Rg3为研究对象,发现其能够抑制胃癌MGC-803细胞中PD-L1 mRNA和蛋白的表达。本研究通过PD-L1载体质粒转染人参皂苷Rh2和Rg3处理的胃癌MGC-803细胞,发现PD-L1能够促进胃癌MGC-803细胞的增殖、迁移和侵袭,促进克隆形成,抑制MGC-803细胞凋亡。本研究结果说明PD-L1是肿瘤的启动因子,进一步证实了PD-L1对肿瘤具有促进作用。有研究结果表明,PD-L1抗体可以抑制免疫细胞和肿瘤细胞之间的相互作用,从而维护免疫细胞对肿瘤细胞的细胞毒性[12-13]。本研究中,人参皂苷Rh2和Rg3能够明显降低胃癌MGC-803细胞中PD-L1 mRNA和蛋白的表达,即人参皂苷Rh2和Rg3能够显著抑制肿瘤的启动因子,阻止肿瘤的发生和发展。相关研究结果表明,人参皂苷Rh2和Rg3能对喉鳞癌、胃癌和肝癌等多种肿瘤细胞发挥抗肿瘤作用[14-15]。虽然目前化疗仍是主要手段,但化疗对正常细胞也会造成一定的影响。而人参皂苷Rh2和Rg3属于天然药物,不仅具有较强的抗肿瘤活性,还能够起到抗肿瘤信号通路的作用[16-17]。有研究结果认为,PD-L1与胃癌的发生有关,可能是胃癌患者临床诊断、免疫治疗和预后的有效靶点[18]。特别值得一提的是,PD-L1单克隆抗体的临床试验已经顺利进行,并表现出良好的抗肿瘤活性[19-20]。本研究还证实了PD-L1的肿瘤促进作用。
综上所述,人参皂苷Rh2和Rg3通过调节PD-L1的表达,抑制胃癌细胞的增殖、迁移和侵袭。提示PD-L1可能是胃癌患者诊断、治疗和预后的潜在靶点。

