理中汤改善抗生素相关性腹泻及对肠道菌群的干预作用研究Δ
章从恩,陈 熹,张学强,2,于小红,李 萌,崔宇涛,3,马雨晴,马致洁#
(1.首都医科大学附属北京友谊医院中药剂科,北京 100050; 2.宁波市第一医院药学部,浙江 宁波 315010; 3.山西大学中医药现代研究中心,太原 030006)
抗生素相关腹泻(antibiotic-associated diarrhea,AAD)是抗菌药物治疗中常见的药品不良事件,发生率为5%~39%,是一个全球性的公共健康问题。流行病学研究结果表明,AAD的高发病率与近年来抗菌药物的广泛使用密切相关,几乎所有的抗菌药物,特别是对厌氧菌有抗菌活性的药物,如氨基青霉素类、头孢菌素类和克林霉素,都与AAD的发病有关[1-3]。AAD的临床表现从轻度、自限性腹泻到严重腹泻并伴有艰难梭菌感染(约占25%)或假膜性结肠炎,甚至死亡[4]。AAD目前尚无特效治疗方法,其治疗主要包括停用或更换诱发AAD的抗菌药物[5]。此外,基于随机对照试验的Meta分析结果显示,益生菌可使AAD的发病率降低38%[6];但部分研究表明其证据不足,特别是对艰难梭菌相关腹泻的影响[7]。因此,开发治疗AAD的新药和治疗方案非常重要。
目前,中医对AAD尚无统一认识,主流观点根据其临床表现,将AAD归入“泄泻”范畴[8]。使用抗菌药物易损伤脾胃之阳,脾胃亏虚,脾阳虚则不能运化水湿,清气不升,浊气不降,清浊相混而成泄泻。理中汤出自《伤寒论》,原方为“理中丸”,后世医家多以汤剂用之,其中成药也有“理中丸”供临床选用。理中汤由人参、白术、炙甘草及干姜4味药物组成,为常用温中方剂,具有温中祛寒、补气健脾的功效,用于治疗脾胃虚寒,自利不渴,呕吐腹痛腹泻等[9]。理中汤及其加减方被广泛用于腹泻的治疗[10-11]。另外,课题组前期研究结果显示,干姜可以显著改善AAD肠道菌群并改善AAD[12]。分析认为理中汤对AAD可能有一定疗效。同时,已有临床研究结果显示,理中汤对抗生素相关性假膜性结肠炎有治疗作用[13]。本研究进一步基于大鼠动物实验,探讨理中汤对AAD的治疗效果及其干预AAD过程中对肠道菌群的作用,为临床使用理中汤治疗AAD提供参考。
1 材料
1.1 实验动物
SPF级SD大鼠50只,约5周龄,平均体重(165±15) g,雌雄各半,购自维通利华公司,许可证号为SCXK(京)-2017-0033。动物饲养于维通利华公司,温度保持在(20±2) ℃,湿度为60%~70%,每日黑暗/光照12 h循环。所有动物实验按照首都医科大学附属北京友谊医院动物伦理委员会相关规定进行(伦理批号:21-2004)。
1.2 仪器
ABI GeneAmp® 9700型聚合酶链反应(PCR)仪(美国Applied Biosystems公司);PL-203型电子分析天平(美国Mettler-Toledo公司);DYY-6C型电泳仪(北京市六一仪器厂);101-1A型电热鼓风干燥箱(天津市泰斯特仪器有限公司);Nikon Eclipse CI正置光学显微镜(日本Nikon公司);Illumina MiSeq平台(美国Illumina公司)。
1.3 药品与试剂
人参(批号为1906005,产地吉林,购自北京同春堂药业有限公司),白术(批号为H0091,产地安徽,购自北京均大制药有限公司),干姜(批号为200930003,产地四川,购自北京仟草中药饮片有限公司),炙甘草(批号为200516,产地内蒙古,购自北京燕北饮片厂);经厂家检验,上述药材均符合《中华人民共和国药典:一部》(2020年版)中的质量标准。双歧杆菌三联活菌胶囊(Bif,华润医药集团有限公司,批号为22120210319);盐酸克林霉素(山东方明药业,批号为181011)。
2 方法
2.1 实验药物的制备
理中汤水煎液的制备参考相关文献[14]及《伤寒论》159条理中汤的记载,按照1∶ 1∶ 1∶ 1的比例取人参、白术(生)、干姜及甘草(炙)4种药材,加6倍量水浸泡20 min,提取30 min,过滤;残渣加4倍量水煎煮第2次,第2次煎煮20 min。合并两次煎煮液,采用旋转蒸发仪60 ℃下浓缩至1.0 g/mL(相当于原药材),4 ℃存储备用。双歧杆菌三联活菌胶囊的制备参考相关文献[15],灌胃前取双歧杆菌三联活菌胶囊中内容物,迅速溶于0.9%氯化钠溶液中,立刻灌胃。
2.2 AAD大鼠模型的制作、动物实验分组及给药
将50只大鼠随机分为5组,每组10只,分别为空白对照组(Con组)、AAD模型组(Mod组)、阳性对照组(Bif组)、理中汤低剂量治疗组(LZDL组)及理中汤高剂量治疗组(LZDH组)。造模期间,Con组大鼠每日灌胃0.9%氯化钠溶液2 mL,Mod组及其他给药治疗组大鼠均灌胃抗菌药物混合溶液(克林霉素50 mg/mL、氨苄西林55.5 mg/mL及链霉素27.75 mg/mL)2 mL,连续灌胃7 d完成AAD模型的制作[15-16]。
模型制作完成后,实验第8—14日,按照分组连续给药7 d。Con组和Mod组大鼠每日给予0.9%氯化钠溶液2 mL,Bif组大鼠每日给予Bif 70 mg/kg,LZDL组、LZDH组大鼠分别给予理中汤水煎液3.75、7.5 g/kg(按生药量计算)[17]。实验第14日治疗期结束,每组处死5只大鼠,取全结肠及结肠粪便,结肠制作为“Swiss roll”[18],固定后做成石蜡切片,进行苏木精-伊红染色(HE染色),粪便用于菌群分析。实验第21日恢复期结束,处死剩余大鼠,取结肠组织进行HE染色分析。
2.3 大鼠一般状况分析
实验过程中,每日观察大鼠精神状况、毛色、粪便状况及尾部肛口干净程度等。实验第4、7、10、14、17及21日,重点观察小鼠粪便及体重的变化,测量大鼠的饮水量及摄食量。
2.4 腹泻程度分析
2.4.1 120 min粪便重量:实验第4、7、10、14、17及21日上午9:00,将大鼠放入独立代谢笼,上午11:00收集粪便,称重。
2.4.2 粪便含水量:将各时间收集到的粪便放在鼓风干燥箱中完全烘干(完全烘干指在95 ℃下烘0.5 h,粪便质量的变化<1%),再进行称重,计算粪便含水量。
2.4.3 腹泻程度评分:褐色、成型干燥的硬粪便为1分;黄色或褐色、成形湿润的软粪便为2分;黄色或褐色、稀烂不成形的水状粪便为3分。
2.5 结肠组织病理学检测
取大鼠结肠,制作成“Swiss-roll”后,放入4%的多聚甲醛进行固定,石蜡包埋、切片,并进行HE染色,观察结肠炎症、水肿等病理特征。
2.6 粪便的采集
解剖大鼠结肠,无菌采集结肠粪便(内容物),迅速放入液氮中淬灭30 min,随后于-80 ℃保存,每组5份样本。
2.7 微生物DNA提取和16S rRNA基因测序及数据分析
按照说明书的规定,采用OMEGA-soil DNA Kit提取肠道菌群DNA,采用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)及806R (5′-GGACTACVGGGTW TCTAAT-3′)引物对细菌16S rRNA V3-V4可变区进行PCR扩增。使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA凝胶回收试剂盒进一步纯化,利用QuantiFluorTM-ST蓝色荧光定量系统进行检测定量。纯化的扩增产物根据标准操作规程在Illumina MiSeq平台上混合并配对测序。基于测序数据进行扩增子序列变异体(ASV)聚类和物种分类分析。基于数据均一化后的ASV物种丰度谱,再对ASV进行丰度分析、多样性分析等,并对各水平上物种群落结构进行统计分析。然后进行物种组成的聚类分析和比较分析,研究各组样品之间的物种组成差异。数据采用Majorbio云平台(http://www.majorbio.com)进行分析。
2.8 统计学方法
3 结果
3.1 大鼠腹泻程度的变化
模型制作期间,实验第3日及第7日,除Con组外,Mod组及各给药组大鼠均出现明显腹泻症状。相对于Con组,其他各组大鼠120 min粪便重量、粪便含水量及粪便评分均显著升高,差异均有统计学意义(P<0.05)。给药期间,Bif组大鼠腹泻程度有一定改善,120 min粪便重量及粪便评分较Mod组有一定的降低,但差异均无统计学意义(P>0.05)。理中汤治疗组中,LZDL组及LZDH组大鼠腹泻症状均显著改善,120 min粪便重量、粪便含水量及粪便评分均显著降低;治疗期结束(实验第14日),LZDL组及LZDH组大鼠的120 min粪便重量、粪便含水量及粪便评分均较Mod组显著降低,其中LZDL组的降低效果略优于LZDH组;治疗恢复期,Bif组与Mod组大鼠腹泻状况的差异仍无统计学意义(P>0.05),LZDL组及LZDH组大鼠120 min粪便重量、粪便含水量及粪便评分均进一步降低,见图1。
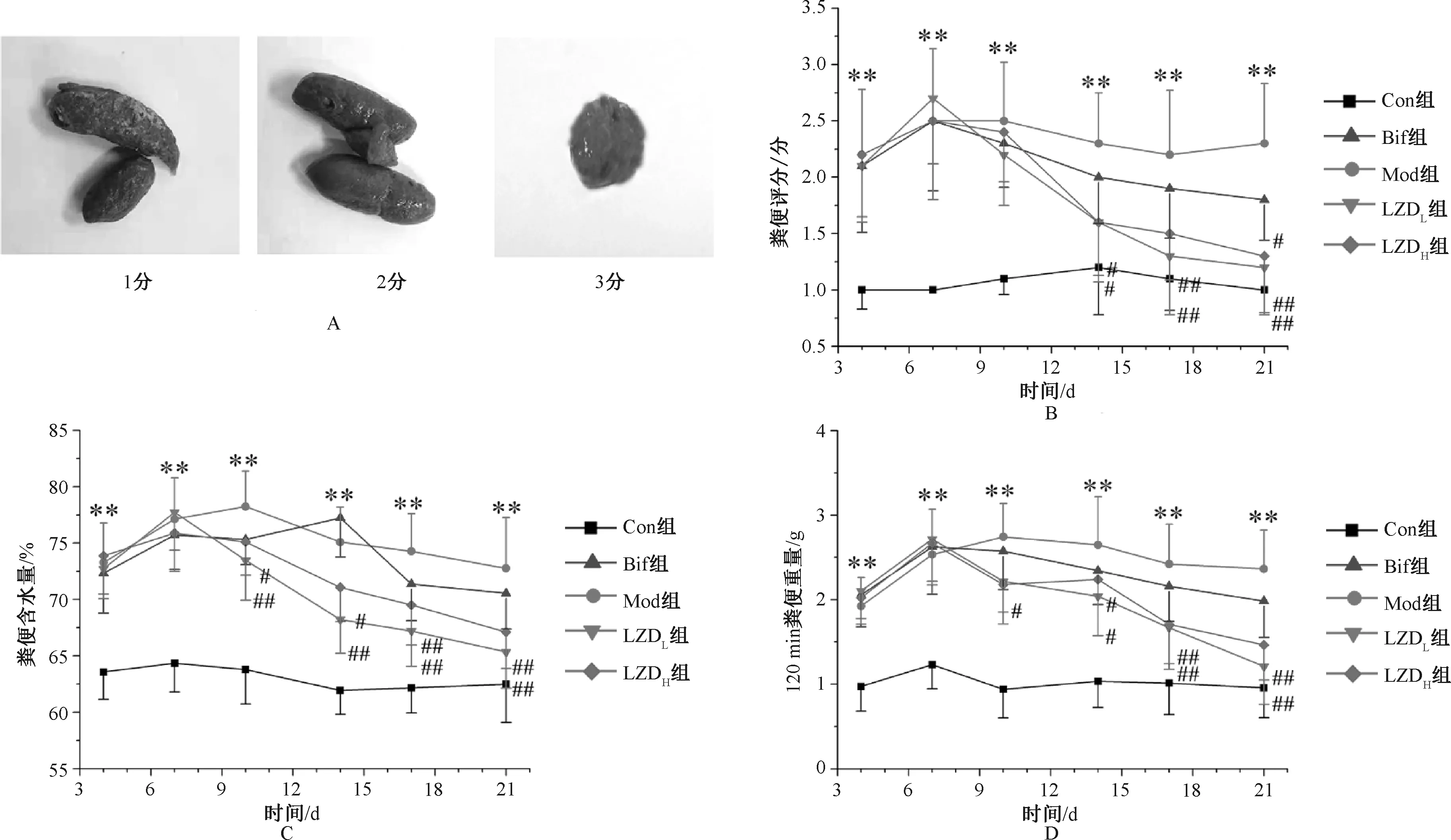
A.大鼠粪便评分;B.大鼠粪便评分变化曲线图;C.大鼠粪便含水量变化曲线图;D.大鼠120 min粪便重量变化曲线图;与空白对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01A.fecal score of rats; B.curve of fecal score in rats; C.curve of fecal water content in rats; D.curve of 120 min fecal weight in rats; vs. the blank control group, *P<0.05, **P<0.01; vs. the model group, #P<0.05, ##P<0.01图1 理中汤对AAD大鼠腹泻症状的作用。Fig 1 Effects of Lizhong decoction on diarrhea symptoms in AAD rats
3.2 大鼠结肠组织病理学分析
大鼠结肠HE染色结果见图2,其中包括治疗期结束(第14日)及恢复期结束(第21日)的结肠组织病理学分析。由图2可知,治疗期及恢复期结束后,Con组大鼠结肠固有层可见少量炎症细胞,其余未见显著病理改变;而Mod组大鼠固有层可见明显的炎症细胞浸润,并有一定程度的水肿及上皮细胞脱落;Bif组大鼠在治疗期及恢复期结束后,与Mod组相比,炎症细胞浸润等病理改变有一定程度的改善;LZDL组及LZDH组大鼠在治疗期及恢复期结束后,均可见上述病理改变显著改善,尤其LZDL组病理结构与Con组更为接近,其肠腺正常,黏膜层结构完整。
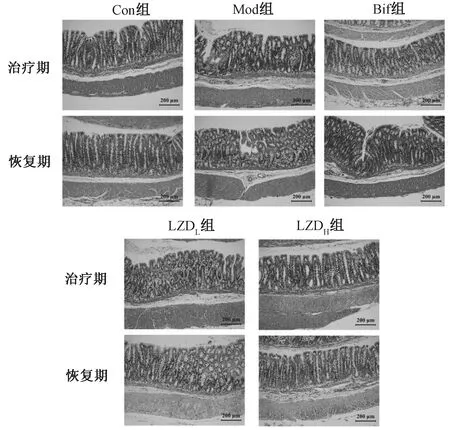
图2 大鼠结肠组织代表性视野图(HE,×200,n=5)Fig 2 Typical histopathological section photographs of colon tissue in rats (HE, ×200, n=5)
3.3 理中汤对肠道菌群多样性的影响
由上述药效学实验结果可知,理中汤对AAD大鼠有一定的治疗作用。肠道菌群在AAD发病机制中有至关重要的作用。因此,本研究进一步进行肠道菌群分析,探讨理中汤治疗AAD可能的作用机制。前述结果显示,理中汤低剂量(LZDL组)药效略优于高剂量(LZDH组),因此,后续采用Con组、Mod组、Bif组和LZDL组四组进行肠道菌群分析。
α多样性主要用于研究均匀生境下的群落多样性,其可通过一系列α多样性指数进行物种丰度及多样性等的分析。本研究采用Sobs、ACE、Shannon及Coverage指数4项指标,其中Sobs及ACE指数常用以刻画群落丰度,Shannon指数常用以反映群落多样性,Coverage指数可以反映测序的群落覆盖度[19-20]。本研究中,Sobs及ACE指数显示,Mod组大鼠肠道菌群丰度较Con组显著降低,差异有统计学意义(P<0.001);Bif组及理中汤治疗组(LZDL组)大鼠肠道菌群丰度有一定程度的恢复,理中汤治疗后期菌群丰度略优于Bif组,见图3(A—B)。Shannon指数显示,Mod组大鼠肠道菌群多样性较Con组显著降低,差异有统计学意义(P<0.001);Bif组及理中汤治疗组(LZDL组)大鼠肠道菌群多样性有一定程度的恢复,但两组的差异无统计学意义(P>0.05),见图3(C—D)。可见,Bif及理中汤对AAD大鼠肠道菌群丰度及多样性均有一定程度的改善,两者作用相当。
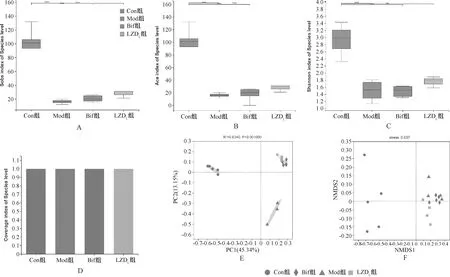
A.Sobs指数;B.ACE指数;C.Shannon指数;D.Coverage指数;E.PCoA分析; F.NMDS分析;组间比较,*P<0.05,**P<0.01,***P<0.001A. Sobs index; B. ACE index; C. Shannon index; D. Coverage index; E. PCoA; F. NMDS; comparison between groups, *P<0.05, **P<0.01, ***P<0.001图3 理中汤对AAD大鼠肠道菌群α多样性及β多样性的影响Fig 3 Effects of Lizhong decoction on α-diversity and β-diversity of gut microbiota in rats
β多样性分析是对不同样品间微生物群落的构成进行比较。本研究通过主坐标分析(PCoA)和非度量多维尺度分析(NMDS)2种分析方法对比各组大鼠的菌群构成。PCoA分析及NMDS分析可研究样本群落组成的相似性或差异性,不同颜色或形状的点代表不同分组的样本,两样本点越接近,表明两样本物种组成越相似[21]。本研究中,PCoA分析和NMDS分析结果显示,Con组、Mod组与各治疗组明显分为不同类群,相对于Bif组及Mod组,LZDL组各样本与Con组更为接近,见图3(E—F)。表明理中汤治疗后大鼠肠道菌群多样性与正常组更为接近,而Bif的作用稍弱。
3.4 理中汤对菌群组成的影响分析
基于ASV的绝对丰度及注释信息,在门水平上,根据群落Bar图分别对占比最多的厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、变形菌门(Proteobacteria)及放线菌门(Actinobacteria)进行分析,见图4;并进一步分析属水平上肠道菌群的组成,见图5。
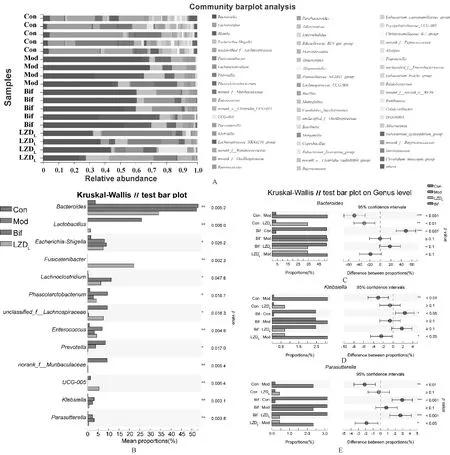
A.大鼠肠道菌群属水平群落组成bar图;B.Con、Mod、Bif及LZDL四组大鼠肠道菌群属水平各菌群类群相对丰度差异;C-E.各组大鼠肠道菌群属水平各菌群类群相对丰度两两比较结果,拟杆菌属(C)、克雷伯菌属(D)及Parasutterella菌属(E)多样本Kruskal-Wallis H检验结果A. bar chart of rat gut microbiota at the phylum level; B. differences of relative abundance of gut microbiota in Con, Mod, Bif and LZDL groups; C-E. pairwise comparison of relative abundance of each group at the genus level of rats, and Kruskal-Wallis H test results of Bacteroides spp. (C), Klebsiella spp. (D) and Parasutterella spp. (E) 图5 理中汤在属水平上对大鼠肠道菌群的影响Fig 5 Effects of Lizhong decoction on gut microbiota in rats at phylum level
由图4(A—C)可知,AAD模型制作完成后,厚壁菌门、拟杆菌门、变形菌门及放线菌门菌群丰度具有显著改变。由图4(A)及图5(B)可知,四组大鼠肠道菌群组成在门水平上有较明显的分类趋势。Con组厚壁菌门平均比例为(65.91±12.79)%;Mod组厚壁菌门平均比例为(28.02±12.57)%,与Con组比较,差异有统计学意义(P<0.001);LZDL组厚壁菌门平均比例为(55.03±5.27)%,较Mod组显著升高,差异有统计学意义(P<0.05);Bif组与Mod组厚壁菌门平均比例的差异无统计学意义(P>0.05),见图4(C—D)。另外,Mod组与Con组大鼠拟杆菌门、变形菌门及放线菌门等菌群比例比较,差异均有统计学意义(P<0.05);但Bif组与LZDL组大鼠拟杆菌门、变形菌门及放线菌门等菌群比例比较,差异均无统计学意义(P>0.05),见图4(E)。
由图5(A—B)可知,在属水平上,Con组、Mod组、Bif组及LZDL组大鼠拟杆菌属(Bacteroidesspp.)、乳酸杆菌属(Lactobacillusspp.)及埃希-志贺菌属(Escherichia-Shigellaspp.)等肠道菌群有显著差异。相对于Con组,Mod组中拟杆菌属(P<0.001)、克雷伯菌属(Klebsiellaspp.)(P<0.01)及Parasutterella属(P<0.01)均显著升高,差异均有统计学意义;相对于Mod组,LZDL组中拟杆菌属有一定程度恢复,但差异无统计学意义(0.05 目前,越来越多的研究开始关注AAD的潜在机制和治疗方法。研究结果显示,AAD发病的机制主要为抗菌药物的使用破坏了肠道正常菌群,导致肠道胆汁酸、短链脂肪酸等代谢紊乱,而后肠道屏障被破坏,影响水液吸收,最终导致腹泻[22-23]。在上述各种病因中,肠道菌群的改变被认为是AAD发生发展的基础,因此,益生菌被广泛用于治疗不同类型的AAD。此外,研究结果发现,一些天然药物及其加工产品可以通过恢复肠道菌群而改善AAD,如中华仙影海葵(Cereussinensis)多糖[24]、人参多糖[25]、山药[26]和中成药香连丸[27]等可加快肠道菌群的恢复,对缓解AAD有益。 理中汤为温中祛寒、补气健脾的代表方剂。本研究中发现,理中汤可以显著改善AAD大鼠的腹泻程度,可在一定程度上提高AAD大鼠肠道菌群的丰度和多样性,其作用在短期内优于Bif。值得注意的是,Bif并未对AAD大鼠有显著的治疗作用,可能与Bif使用时间有关,Bif的疗程一般为2周。临床研究结果显示,使用Bif 3个月可建立新的肠道稳态[28]。 本研究中,AAD大鼠经理中汤治疗后,在门水平上,厚壁菌门菌群显著恢复,而Bif干预后大鼠的厚壁菌门比例没有明显改变。在属水平上,AAD大鼠中拟杆菌属、克雷伯菌属及Parasutterella属菌群比例显著升高,而理中汤低剂量可较为显著地降低上述菌群的比例。拟杆菌为利害兼备菌,其有助于分解食物并产生身体所需的营养和能量、维持肠道免疫稳态,但当其易位至肠道以外的身体其他部位时,其会充当致病菌,导致脓肿和其他感染[29]。理中汤治疗AAD可能与拟杆菌属菌群的改变有关。值得注意的是,本研究结果显示,理中汤可显著降低克雷伯菌属菌群的比例。克雷伯菌属广泛被认为是有害菌,其主要可导致肺部的感染,另外,研究结果表明克雷伯菌属细菌如产酸克雷伯菌(Klebsiellaoxytoca)可导致AAD[30-31]。本研究结果显示,理中汤还可降低Parasutterella属菌群比例。目前关于Parasutterella属的研究较少,有研究结果表明,Parasutterella属与炎症性肠病及肠道炎症的发生密切相关[32]。其可能与AAD的发生发展存在正相关关系。综上,推测理中汤可能通过降低拟杆菌属、克雷伯菌属及Parasutterella属菌群而改善AAD大鼠的腹泻程度。4 讨论

