老年2型糖尿病患者25(OH)D3、Hcy、SUA水平变化及其与骨代谢、骨密度及骨质疏松的相关性
葛迎晓,王华,许丹妮,蓝敏,茹倩影
上海交通大学医学院附属同仁医院老年科,上海 200336
2 型糖尿病是一种慢性代谢性疾病,在我国具有较高的发病率,尤其是在老年人群中的发生率仍呈逐年增长的表现[1]。该病的发生涉及到诸多因素,例如机体葡萄糖代谢异常、遗传、环境、年龄等共同所致的机体胰岛素分泌功能障碍,对生活质量有着较多不良影响。当机体处于长期高血糖的状态下时,极易诱发较多急、慢性并发症,进一步影响到患者的预后,尤其骨质疏松,在2型糖尿病患者中的患病率可高达60.00%,不仅会加剧骨折风险,严重者甚至出现残疾[2-3]。因此,积极了解2 型糖尿病患者发生骨质疏松的发病机制、影响因素等在早期预防、改善预后中显得十分重要。本研究通过观察老年2 型糖尿病患者25 羟基维生素D3[25(OH)D3]、同型半胱氨酸(Hcy)、尿酸(SUA)水平的变化,旨在分析其与骨代谢、骨密度及骨质疏松发生的相关性,现报道如下:
1 资料与方法
1.1 一般资料 回顾性分析2019年1月至2020年7月上海交通大学医学院附属同仁医院收治的100例老年2型糖尿病患者的临床资料。纳入标准:①符合《中国2 型糖尿病防治指南(2017 年版)》[4]中相关诊断标准;②年龄≥60岁;③临床资料完整。排除标准:①同时患有其余对骨代谢有影响的疾病;②长期服用激素或者其余对骨代谢有影响的药物;③伴有原发性肾病、血液疾病、痛风、低蛋白血症、泌尿系统感染、免疫系统疾病等;④长期饮酒、高嘌呤饮食;⑤同时伴有其余糖尿病并发症;⑥长期卧床、营养不良者;⑦伴有其余器官功能障碍;⑧伴有恶性肿瘤。根据T 值=(骨密度测定值-同性别同种族正常成人骨峰值)/正常成人骨密度标准差进行分组[5],其中T值≤-2.5为骨质疏松组26 例,-2.5<T 值<-1.0 为骨量减少组45 例,T 值≥1.0为骨量正常组29例。本研究经我院伦理委员会批准后实施。
1.2 观察指标与方法
1.2.1 一般资料 收集所有患者的一般资料,包括性别、年龄、糖尿病病程、身体质量指数(BMI)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)指标。
1.2.2 血 清25(OH)D3、Hcy、SUA 及 骨 代 谢 检测 采集清晨空腹静脉血6 mL,采用3 500 r/min 的转速进行离心处理,时间15 min,收集上层血清液置于-80℃的冷冻箱中准备检测,25(OH)D3、Hcy 以及骨代谢指标包括β-胶原特殊序列(β-CTX)、甲状旁腺素(PTH)、骨钙素(OC),均使用电化学发光法进行检测,仪器选择罗氏全自动电化学发光免疫分析仪Cobas 8000 型,SUA 的检测选择西门子全自动生化分析仪ADVIA2400型及配套的试剂盒进行。
1.2.3 骨密度检测 采用双能X线吸收仪检测,检察前2~6 d 均严禁服用对图像分析有影响的药物,并去除身上的金属物品,检测部位包括腰椎L1~4骨密度、股骨颈骨密度以及全髋骨密度,并计算均值骨密度,均值骨密度为腰椎L1~4骨密度、股骨颈骨密度、全髋骨密度三者的平均值。
1.3 统计学方法 应用SPSS18.0 软件包进行数据统计学分析。计量资料以均数±标准差(x-±s)表示,三组比较采用方差分析,组间比较采用t检验;计数资料比较采用χ2检验;相关性分析采用Pearson相关系数分析法。以P<0.05表示差异具有统计学意义。
2 结果
2.1 三组患者的一般资料比较 三组患者的性别、年龄、糖尿病病程和FBG 比较差异均无统计学意义(P>0.05);骨质疏松组患者的BMI 明显低于骨量减少组和骨量正常组,HbA1c明显高于骨量减少组、骨量正常组,骨量减少组BMI明显低于骨量正常组,差异均有统计学意义(P<0.05),骨量减少组和骨量正常组患者HbA1c比较差异无统计学意义(P>0.05),见表1。
表1 三组患者的一般资料比较[±s,例(%)]

表1 三组患者的一般资料比较[±s,例(%)]
注:与骨质疏松组比较,aP<0.05;与骨量减少组比较,bP<0.05。
?
2.2 三组患者的25(OH)D3、Hcy、SUA 水平比较 骨质疏松组患者的血清25(OH)D3水平明显低于骨量减少组和骨量正常组,骨量减少组明显低于骨量正常组,骨质疏松组患者的血清Hcy、SUA水平明显高于骨量减少组和骨量正常组,骨量减少组明显高于骨量正常组,差异均有统计学意义(P<0.05),见表2。
表2 三组患者的25(OH)D3、Hcy、SUA水平比较(±s)

表2 三组患者的25(OH)D3、Hcy、SUA水平比较(±s)
注:与骨质疏松组比较,aP<0.05;与骨量减少组比较,bP<0.05。
?
2.3 三组患者的骨代谢指标比较 骨质疏松组患者的β-CTX、PTH水平明显高于骨量减少组和骨量正常组,骨量减少组明显高于骨量正常组,骨质疏松组患者的血清OC水平明显低于骨量减少组和骨量正常组,骨量减少组明显低于骨量正常组,差异均有统计学意义(P<0.05),见表3。
表3 三组患者的骨代谢指标比较(±s)
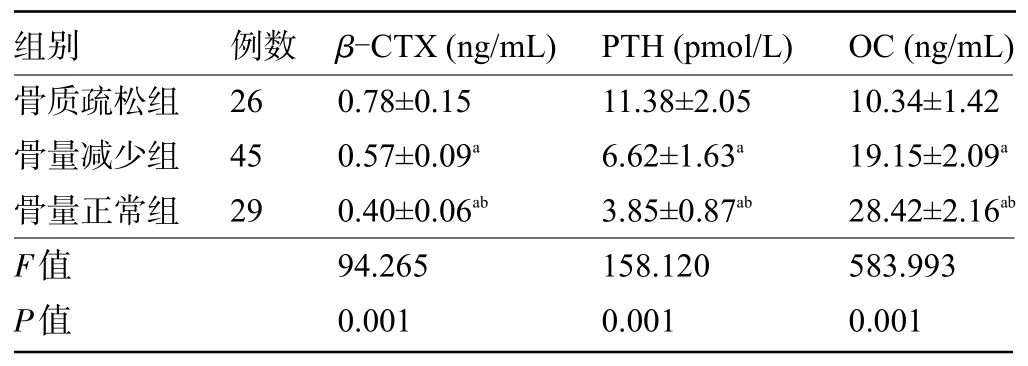
表3 三组患者的骨代谢指标比较(±s)
注:与骨质疏松组比较,aP<0.05;与骨量减少组比较,bP<0.05。
?
2.4 三组患者不同部位的骨密度比较 骨质疏松组患者的腰椎L1~4骨密度、股骨颈骨密度、全髋骨密度及均值骨密度明显低于骨量减少组和骨量正常组,骨量减少组明显低于骨量正常组,差异均有统计学意义(P<0.05),见表4。

表4 三组患者不同部位的骨密度比较(-x±s,g/cm2)
2.5 血清25(OH)D3、Hcy、SUA水平与骨代谢、骨密度的相关性 经Pearson相关性分析结果显示,血清25(OH)D3与β-CTX、PTH均呈负相关(P<0.05),与OC、均值骨密度呈正相关(P<0.05),血清Hcy、SUA 与β-CTX、PTH均呈正相关(P<0.05),与OC、均值骨密度呈负相关(P<0.05),见表5。
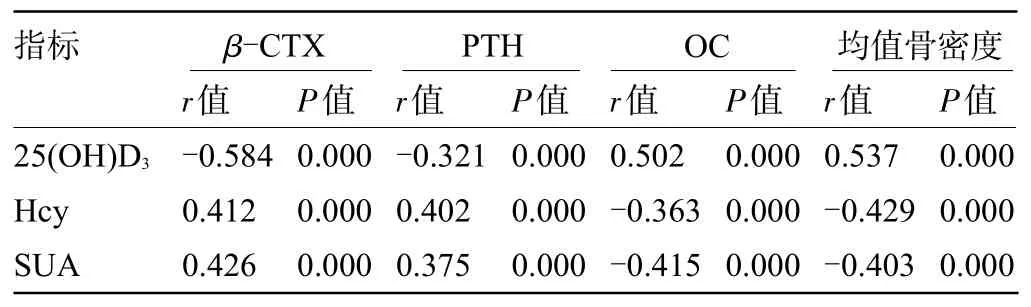
表5 血清25(OH)D3、Hcy、SUA水平和骨代谢、骨密度的相关性
3 讨论
随着人们生活方式、饮食结构的不断改变,2型糖尿病在临床上的发病率也不断增加,目前已成为老年人群中的常见疾病,严重危害着公共卫生安全。骨质疏松是2 型糖尿病患者十分常见的并发症之一,正常的人体中的骨形成和骨吸收活动均处于一个相对稳定的状态,然而在2 型糖尿病患者中,由于机体相对缺乏胰岛素,可导致代谢功能紊乱,造成破骨、成骨失衡,成骨细胞减少、骨量降低等,最终诱发骨质疏松[6-7]。2 型糖尿病患者一旦发生骨质疏松,不仅会加剧临床治疗难度,且会增加病理性骨折的发生率,影响着患者的康复。目前对骨质疏松的诊断中,主要是通过双能X 线,但在基层医院中难以普及。因此,选择一种方便、高效的辅助检查指标来早期预测骨质疏松则显得十分重要。
25(OH)D3是机体维生素D3的活性表达形式,在骨形成过程中具有着重要意义,不仅可促进小肠对钙磷代谢的吸收、增加血钙血磷水平,且对骨钙的沉积、释放具有调节作用[8-9]。Hcy是目前评价动脉粥样硬化硬化等心血管疾病的重要指标。随着研究的不断进步也发现,其浓度的增加也可能是导致骨质疏松性骨折的重要危险因素[10]。SUA 属于机体嘌呤代谢的终末产物,若机体核酸代谢增加、排泄减少等,均可造成SUA水平升高,是目前诊断痛风的关键标志物。近年来,也有研究显示,其在成骨细胞的增殖、分化过程中也有着调控作用,有助于评价机体的骨形成及骨吸收过程[11-12]。
本研究结果发现,骨质疏松患者的25(OH)D3水平降低,Hcy、SUA 明显升高,且骨量减少组25(OH)D3、Hcy、SUA 水平之间也具有明显差异,显示出三者在2 型糖尿病发生骨质疏松的过程中有着重要意义。①在长期高血糖、胰岛素β功能缺乏、胰岛素抵抗以及高龄等因素的影响下可导致机体维生素D缺乏,血清25(OH)D3降低。既往研究证实,低水平的25(OH)D3不仅是老年2 型糖尿病的独立危险因素,且是骨质疏松、骨骼肌质量降低的危险因素。②2 型糖尿病患者发生骨质疏松的原因主要与骨吸收程度大于骨形成程度相关。此过程可导致骨破坏程度增加,而Hcy 可通过骨髓基质细胞雌激素受体α基因启动子A区发生甲基化,致使骨髓基质细胞雌激素受体α基因的含量降低,成骨细胞活性降低,并加剧破骨细胞活性。近期的报道也发现,Hcy 和破骨细胞、成骨细胞的活性均有着密切关系[14]。③当SUA水平异常升高时,其可在关节处沉积,并形成尿酸结晶,加剧骨破坏,增加骨质疏松发生风险。井源等[15]实验中指出,除氧化应激反应等过程之外,SUA还可能是通过影响2 型糖尿病患者的肾功能,来进一步影响到骨代谢。
骨代谢标志物是评估机体成骨、破骨活性的重要指标,其中β-CTX可反映破骨细胞的活性和骨吸收情况;PTH则可调节机体的钙、磷代谢过程,且能促进破骨细胞的骨吸收作用;OC 主要由成骨细胞所分泌,当其表达升高,则可提高骨形成能力,降低骨质疏松、骨折等发生风险。本研究通过分析发现,血清25(OH)D3、Hcy、SUA 水平和骨代谢、骨密度之间均具有明显的相关性,显示出三者在评估患者的骨吸收、骨形成等活动中有重要作用,进一步显示出通过监测血清25(OH)D3、Hcy、SUA水平可了解2型糖尿病患者的骨代谢情况。本研究也为2型糖尿病合并骨质疏松的早期评估、预防提供了一定参考依据。然而研究也有部分不足,例如所纳入样本量较少、回顾性分析可能造成部分结果偏倚等,今后有待开展更高质量的试验进一步验证本结论。
综上所述,老年2 型糖尿病患者25(OH)D3、Hcy、SUA 水平变化与骨代谢、骨密度具有明显相关性,且与骨质疏松的发生密切相关,临床上应予以重视。

