LncRNA MEG3在前列腺癌中的表达及其分子调控网络研究
曹石金,罗锦斌,何海填,张新明,叶宗岳,曾灿,王可兵
深圳市前海蛇口自贸区医院泌尿外科,广东 深圳 518067
前列腺癌(prostate cancer,PCa)是一类严重威胁男性生命健康的恶性肿瘤。据美国癌症学会统计:2016年PCa 新发病占男性恶性肿瘤新发病例的21%,位列男性恶性肿瘤第1 位;死亡病例占恶性肿瘤死亡病例总数的8%,排名全球第2 位[1]。母系表达基因3(maternally expressed gene3,MEG3)是一段长度约1.6 kb的长链非编码RNA(long noncoding RNA,lncRNA),定位于人类染色体14q32.3中的印记基因[2]。已有较多文献报道MEG3是抑癌基因,在多种癌组织中发现其表达缺失[3]。MEG3 作为一个经典的抑癌基因[4],既可作为PCa诊断的生物标志物,又能调控PCa的进程,然而目前MEG3调控PCa的分子生物学机制仍知之甚少。本文首先用实验明确了MEG3 在PCa 组织中的表达情况,再用生物信息学方法预测MEG上游转录因子、下游靶miRNA 及靶miRNA 的靶基因,并绘制了其整个分子调控网络,为进一步研究MEG3 在PCa 发生中的分子生物学机制提供了新线索。
1 资料与方法
1.1 一般资料 选取2019 年7 月至2020 年5 月深圳市前海蛇口自贸区医院收治的20 例PCa 患者行前列腺穿刺活检术及根治术获取的样本作为Tumor组,20例经尿道前列腺剜除术的良性前列腺增生组织标本作为Normal 组。Tumor 组患者平均年龄(69.87±3.66)岁,平均病程(9.06±1.18)年。Normal组患者平均年龄(70.06±4.13)岁,平均病程(9.31±2.01)年。两组患者的年龄和病程比较差异均无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会审批通过。
1.2 实时荧光定量检测聚合酶链反应(PCR) 采用预冷的TRIzol(Invitrogen)提取样本组织中总RNA,检测合格后,逆转录成cDNA。根据Power SYBR Green(TaKaRa)试剂盒说明书进行操作后,将20 μL反应体系PCR反应体系按以下条件进行反应:95℃预变性30 s,95℃变性15 s,60℃退火30 s,72℃延伸30 s,36个循环。MEG3上游引物:5′-CTGCCCATCTACAC CTCACG-3′;下 游 引 物:5′-CTCTCCGCCGTCTGCGCTAGGGGCT-3′。内参基因选GAPDH 上游引物:5′-TGCAACGGATTTGGTCTGTATT-3′;下 游 引 物:5′-AGTCTTCTGGGTGGCAGTGAT-3′。上机检测后,按2-△△Ct法计算MEG3基因相对表达量。
1.3 生物信息学预测 在UCSC 数据库(http://genome.ucsc.edu)查询MEG3 在人类基因组中的定位及其保守性。用PROMO 数据库(http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi? dirDB=TF_8.3)预测MEG3 启动子序列的转录因子。用DIANA生物学软件(http://diana.imis.athena-innovation.gr/DianaTools/index.php? r=site/index )预测MEG3 下游靶miRNA。用miRTarBase 软 件(http://mirtarbase.mbc.nctu.edu.tw/php/search.php)在线预测MEG3 下游靶miRNA的靶基因,并绘制MEG3与PCa 发生有关的分子调控网络。
2 结果
2.1 两组患者的MEG3基因表达水平比较 Tumor组患者的MEG3 表达水平为2.64±0.305,明显低于Normal 组的8.23±0.759,差异有统计学意义(P<0.05),见图1。
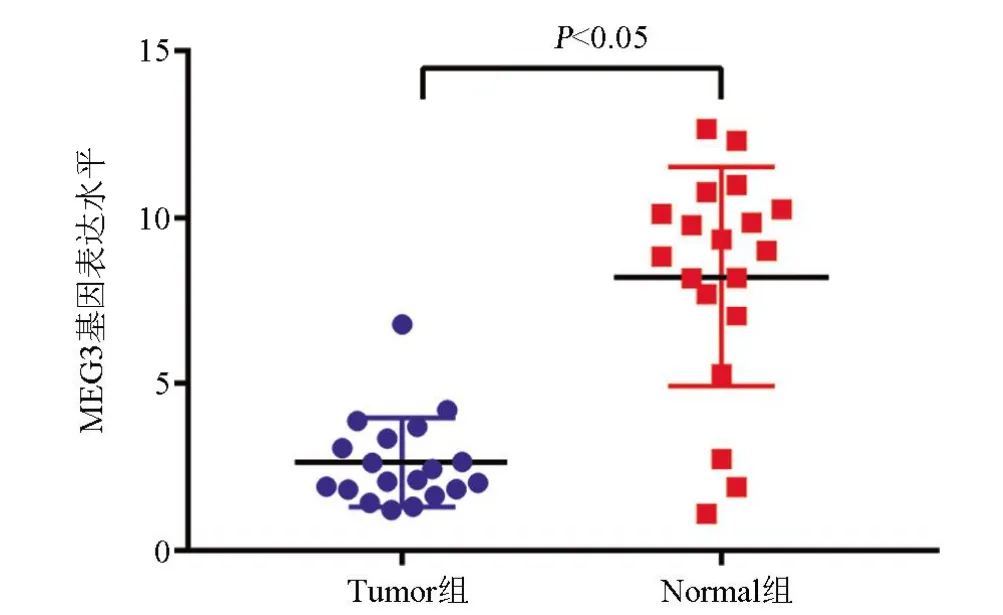
图1 两组MEG3基因表达水平比较
2.2 MEG3在人类基因组中的定位及保守性 运用UCSC 基因组工具[Human Dec. 2013 (GRCh38/hg38) Assembly] 明确MEG3 在人类基因组中的定位。MEG3 定位于人类14q32.3 染色体的100826118~100861026之间,见图2。MEG3的转录起始位点具有较高的保守性,见图3。

图2 UCSC基因组工具分析MEG3在人类基因组中的定位

图3 UCSC基因组工具分析MEG3在人类基因组中的保守性
2.3 MEG3 与上游序列结合的转录因子 首先运用UCSC 数据库得到MEG3 启动子序列后,在PROMO 数据库中,将容错率设置为0%的情况下预测MEG3启动子序列,共有18个转录因子,包括YY1、C/EBPβ、GR-α等,见图4。

图4 MEG3启动子序列上的转录因子
2.4 MEG3与miRNA 运用DIANA生物学软件进行预测,Threshold 调为0.8,结果可得到与MEG3 结合的miRNA 共有32 个。通过检索文献报道,结合评分大于0.9 以上,且在肿瘤研究中相对广泛的hsa-miR-877-3p进一步分析。
2.5 miR-877-3p 与靶基因 运用miRTarBase软件在线预测hsa-miR-877-3p 靶基因,统计Pred.Score≥0.800 分的基因共有40 个。选取与PCa 相关的3 个基因包括小泛素相关蛋白1(small ubiquitin related modifier 1,SUMO1)、富亮氨酸纤维连接蛋白跨膜2(fibronectin leucine rich transmemrane 2,FLRT2)、人类免疫缺陷病毒I 型增强子结合蛋白3(human immunodeficiency virus type I enhancer binding proteins,HIVEP3)等。
2.6 绘制MEG3 在PCa表达的分子调控网格经总结分析,对MEG3在PCa的分子调控网络进行绘制,如图5所示。
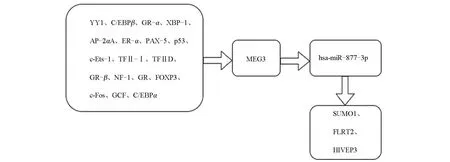
图5 MEG3参与PCa发病的分子调控网络
3 讨论
PCa 是泌尿外科临床上常见的恶性肿瘤之一,随着我国平均寿命的延长,其临床发病率呈现出不断上升的趋势[5]。早期PCa 患者经过综合治疗后,预后通常良好[6],然而目前仍有相当一部分PCa 患者在确诊时已发生远处转移,预后较差。虽然内分泌治疗可以在一定程度上控制和改善多数中晚期PCa 患者的病情,但其中绝大多数患者仍会进展为预后极差的去势抵抗性PCa[7-8]。因此,深入探寻PCa 发生发展的分子通路及相关基因异常,阐明肿瘤发生发展机制,寻找其转移及耐药的分子机制及有效靶点,对于提高PCa的早期诊断效率、发掘新的治疗靶点与预后判断方法具有重要意义。
生物信息学(bioinformatics)是在人类基因组计划下快速兴起的一门新兴交叉学科,主要涉及计算机、生物学和数学等多门学科的综合技术应用[9]。随着基因测序技术及数据库的不断发展,临床研究采用生物信息学深度挖掘与人类疾病有关的测序数据,发现新的分子信号通路已成为可能。并且该法具有经费投入少、样本量大和能优化处理大量数据等优点,为初步筛选有价值的分子标志物和继续深度研究提供了新线索[10]。利用生物信息学软件分析相应基因,从而提升研究方案的科学性和逻辑性,从而进一步使具体的深度研究更有针对性和目标性,能大幅度节约试验的工作量。LncRNA是一种转录本长度大于200 nt的非编码RNA,其参与了机体免疫调控、X 染色体沉默、染色质修饰和转录干扰等调控过程,可在表观遗传学水平、转录及转录后水平等多种层面上调控基因的表达[11-12]。目前,越来越多的lncRNA 被鉴定和研究,而在众多lncRNA 中,MEG3 的研究比较深入,其被发现在许多癌症如肝癌、白血病和脑癌等中表达缺失[13]。
本研究首先分析了MEG3在PCa组织和良性前列腺增生组织的基因表达差异,结果显示MEG3 在Tumor 组中的表达明显低于Normal 组,揭示了MEG3 在PCa 中也存在表达缺失的情况。为了进一步了解MEG3 在PCa 的分子生物学机制,本文进一步采用生物信息学方法预测及绘制MEG3在PCa的分子调控网络。本研究用UCSC基因组工具明确MEG3在人类基因组中的定位,MEG3 定位于人类14q32.3 染色体的100 826 118~100 861 026 之间;确定了MEG3 的转录起始位点具有较高的保守性;用PROMO 数据库预测MEG3 启动子序列一共有18 个转录因子,包括YY1、C/EBPβ、GR-α等;用DIANA 生物学软件进行预测得到与MEG3 结合的miRNA 共有32 个,且结合文献报道,筛选评分大于0.9以上,选在肿瘤研究中相对广泛的hsa-miR-877-3p进一步分析。已有研究表明,在乳腺癌中miR-877-3p 表达缺失,而人类表皮生长因子受体2(HER-2)则过表达,在进一步机制研究中发现,miR-877-3p mimic能降低细胞增殖、侵袭等生物学功能,这揭示了miR-877-3p 在乳腺癌转移过程中发挥重要的作用[14]。另外,在膀胱癌细胞中miR-877-3p和p16 基因均表达缺失,过表达miR-877-3p 能有效抑制膀胱癌细胞的增殖、平板克隆和皮下成瘤能力,其抑癌作用可能与特异性激活p16 基因表达有关[15]。为了进一步了解hsa-miR-877-3p 调控的靶基因,作者采用miRTarBase 软件在线预测其靶基因,统计Pred.Score≥0.800 分的基因共有40 个,选取与PCa 相关的3 个基因包括SUMO1、FLRT2、HIVEP3 等,最后对MEG3 在PCa 中的分子调控网络进行了绘制。SUMO 参与了SUMO化的修饰过程,其蛋白分子量约为12 kD。SUMO 化修饰是一种蛋白翻译后的修饰,在调节几乎所有细胞功能方面发挥重要的作用[16]。SUMO化修饰失调可能参与了人类疾病,如癌症、神经退行性疾病和心血管疾病等[17]。我国研究者发现壮观霉素B1和四逆汤均能通过下调人非小细胞肺癌A549中SUMO1 和p-Akt 表达,和上调PETN 和Caspase-9 表达,从而降低细胞的增殖、侵袭和迁移力[18]。国外有研究者发现通过去SUMO 化修饰能诱导HIF1α依赖型的血管生成及提高PCa 细胞的增殖力[19]。FLRT 家族首次由Lacy 在1999 年在细胞外基质中发现,其家族成员包括FLRT1、FLRT2 和FLRT3。FLRT 家族成员主要通过参与细胞分选、黏附、缩聚,以及对成纤维细胞生长因子信号及其受体的共同作用而在脊椎动物的发育过程中发挥重要的作用[20]。近来有国外研究者为了开发新的手段用来区分惰性PCa 和侵袭性PCa,利用了综合高通量阵列相对甲基化分析整个基因组差异甲基化区域(differentially methylated regions,DMRs),包括基于Gleason 分级的PCa 患者CpG岛(CGI)和非CGI 区域,结果发现Gleason 等级低vs高比较中排名前5 的候选DMRs 中,就包括了OPCML、ELAVL2、EXT1、IRX5和FLRT2,这揭示了FLRT2异常表达与PCa 密切相关[21]。HIVEP3,也被称为KBP-1、KBP1、KRC、SHN3、Schnurri-3、ZAS3 和ZNF40C,是HIVEP 家族成员之一。据研究表明,HIVEP3 在免疫球蛋白基因重排、细胞存活、巨噬细胞中肿瘤坏死因子信号转导、辅助T 淋巴细胞中IL-2 基因表达、成骨细胞骨形成、肿瘤形成等过程中发挥重要作用[22]。近来我国有研究者通过采用RNA 干扰在PCa 细胞系中敲除SOX9表达,并在体外分析SOX9 抑制对HIVEP3表达的影响,并用定量PCR 和免疫组化方法检测了人类PCa 组织中HIVEP3 和SOX9 的表达模式,结果发现SOX9 过表达会激活HIVEP9 表达,这可能是PCa 患者预后不良的重要因素,并提示联合分析HIVEP9 和SOX9 表达情况有助于预测PCa 患者的肿瘤进展和预后情况[23]。然而,这一系列推导出的MEG3 在PCa 的分子调控通路仍需进一步采用实验进行验证。
综上所述,本文证实了MEG3 在PCa 中存在表达缺失的情况。采用生物信息学方法预测分析显示与PCa 相关且可能与MEG3 结合的转录因子(YY1、XBP-1 和FOXP3 等)、miR-877-3p 和miR-877-3p 靶基因(SUMO1、FLRT2 和HIVEP3)相互关联,并构成以MEG3 为核心的基因表达调控网络,为进一步研究MEG3 在PCa 发生中的分子生物学机制提供了新线索。

