黄芪多糖对脂多糖诱导肠上皮细胞IPEC-J2氧化应激和炎症反应的缓解作用
崔海燕,纪龙翔,朱宇晴,李卫国
(河南师范大学 生命科学学院,河南 新乡 453007)
肠道是集消化、吸收、内分泌、免疫和防御功能于一体的器官.肠道黏膜屏障是阻止外界环境中有害物质侵入机体的一道天然屏障.当肠道炎症发生时,会引起肠粘膜坏死、通透性增加以及肠粘膜屏障功能降低[1].脂多糖(Lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁的主要成分,LPS刺激可破坏猪肠道上皮细胞间的紧密连接,损坏肠道的完整性而引发疾病[2].黄芪是一种传统的补益中药,含有黄酮类和皂苷等生物活性成分,其中黄芪多糖(Astragalus polysaccharides,ASP)具有抗氧化、抗炎、抗肿瘤和免疫调节等功能[3].已有研究大多关注ASP的抗炎作用,关于ASP对LPS诱导IPEC-J2氧化应激和炎症的保护作用研究较少.本研究通过建立猪肠道上皮细胞LPS损伤模型,探讨ASP对LPS刺激IPEC-J2的细胞活力、抗氧化相关指标及炎症相关基因表达的影响,以期为ASP的抗炎作用机制以及在畜牧业中的应用提供理论依据.
1 材料与方法
1.1 材料
黄芪多糖(质量分数>90%)购自北京索莱宝生物有限公司,脂多糖(LPS)购自Sigma-Aldrich公司.高糖DMEM培养基和胎牛血清(FBS)购自Biological Industries公司.超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和丙二醛(MDA)购自南京建成生物工程研究所.白细胞介素-6(IL-6)、白细胞介素-8(IL-8)和肿瘤坏死因子(TNF-α)ELISA检测试剂盒购自武汉酶免生物技术有限公司.
1.2 方法
1.2.1细胞培养与分组
猪空肠上皮细胞IPEC-J2系由河南农业大学牧医工程学院馈赠.IPEC-J2细胞培养液为质量分数10%FBS和1%青霉素-链霉素的高糖DMEM培养基,接种于25 cm2培养瓶中,并放在37 ℃、体积分数5% CO2的培养箱中培养.将原装LPS粉末溶解在磷酸盐缓冲液中,配成1 g/L母液.ASP和LPS均采用基础培养基稀释成不同浓度,现配现用.
1.2.2MTT法检测LPS和ASP对IPEC-J2细胞活力的影响
取对数生长期的IPEC-J2细胞,胰酶消化后以每孔1×104cells接种到96孔板中,每孔加100 μL细胞悬液.培养箱孵育24 h后,分别加入不同质量浓度LPS(0,0.5,1.0,10.0和100.0 mg/L)和ASP(0,12.5,25.0,50.0,100.0和200.0 mg/L),每组6个重复.之后向每孔中添加10 μL噻唑蓝(MTT)溶液(5 g/L),孵育4 h.小心除去上清液,每孔中加入150 μL二甲基亚砜(DMSO)溶解.震荡10 min充分混匀后用酶标仪检测490 nm波长和参考波长630 nm下的吸光度值.细胞存活率=(A实验孔490-A实验孔630)/(A对照孔490-A对照孔630).
1.2.3ASP对IPEC-J2细胞SOD和CAT酶活力及MDA含量的影响
取对数生长期的IPEC-J2细胞,胰酶消化后以每孔5×105cells在6孔板中培养细胞,每孔加2 mL细胞悬液.培养箱孵育24 h后,弃去旧培养基,按以下分组进行处理:空白对照组,LPS处理组,ASP处理组,ASP+LPS处理组.LPS组表示只加10.0 mg/L LPS处理12 h,ASP组表示只加100.0 mg/L ASP处理4 h,ASP+LPS组表示先用100.0 mg/L ASP处理4 h后再用10.0 mg/L LPS处理12 h,每组3个复孔.处理相应时间后收集细胞,然后按照相应试剂盒的实验步骤测定各处理组SOD,CAT酶活力及MDA含量.
1.2.4ELISA法检测细胞上清液中IL-6,IL-8,TNF-α的含量
取对数生长期的IPEC-J2细胞,用胰酶消化后以每孔5×105cells在6孔板中培养细胞,每孔加2 mL细胞悬液,培养箱孵育24 h后,弃去旧培养基,经过上述对照组,LPS组,ASP组,ASP+LPS组4个处理细胞后,分别收集细胞上清液后按照相应试剂盒说明书测定其IL-6,IL-8和TNF-α含量,之后向每孔加入1 mL Trizol裂解细胞,-80 ℃保存.
1.2.5实时定量PCR检测细胞IL-6,IL-8,TNF-α和IL-10基因的相对表达量
按照Trizol试剂盒(Invitrogen,美国)法提取RNA,-80 ℃保存备用.采用TB GREEN反转录试剂盒(Takara,日本)生成cDNA.PCR扩增条件为95 ℃预变性300 s,之后95 ℃ 15 s,60 ℃ 20 s和72 ℃ 20 s,35个循环.所有引物均,GAPDH,F:ATGACCACAGTCCATGCCATC,R:CCTGCTTCACCACCTTCTTG;IL-6,F:GCTCTCTGTGAGGCTGCAGTTC,R:AAGGTGTGGAATGCGTATTTATGC;IL-8,F:GACCCCAAGGAAAAGTGGGT,R:TGACCAGCACAGGAATGAGG;TNF-α,F:TTCCAGCTGGCCCCTTGAGC,R:GAGGGCATTGGCATACCCAC;IL-10,F:GACGTAATGCCGAAGGCAGA,R:TGGAGCTTGCTAAAGGCACT,引物方向均为3′至5′ ,上海生物工程技术股份服务公司合成.以GAPDH作为内参基因,使用2-ΔΔCT方法分析每个基因的相对表达量.
1.3 数据统计与分析
所有数据均使用SPSS 20.0一般线性模型通过单方差分析(ANOVA)进行统计分析,均用平均值±标准差表示,并使用Duncan检验进行多重比较.P<0.05表示差异显著.
2 结 果
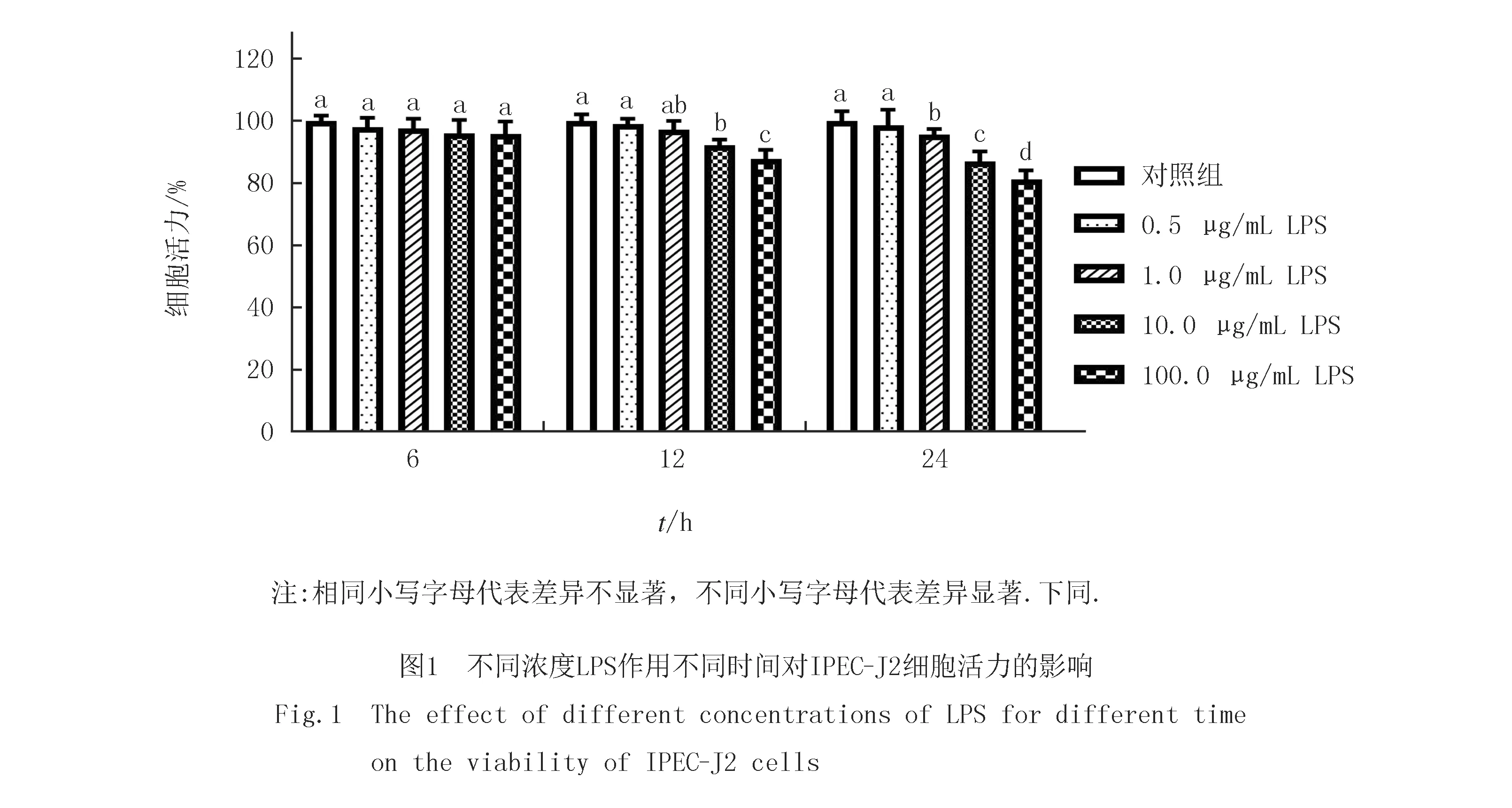
2.1 LPS对IPEC-J2细胞活力的影响
由图1可知,不同浓度的LPS作用不同时间对IPEC-J2细胞活力显示不同的抑制作用,当LPS作用6 h时,LPS对IPEC-J2细胞活力的抑制作用不显著(P>0.05);当LPS作用12 h时,随着LPS浓度的增加,IPEC-J2细胞活力逐渐降低,且在质量浓度为10.0 mg/L时显著降低了细胞活力(P<0.05).而当LPS作用24 h时,在质量浓度为1.0 mg/L时显著降低了细胞活力(P<0.05),但比10.0 mg/L LPS作用12 h的细胞活力略高.因此,考虑到对细胞的损伤程度,选择10.0 mg/L LPS作用12 h为后期IPEC-J2细胞的损伤模型.
2.2 ASP对IPEC-J2细胞活力的影响
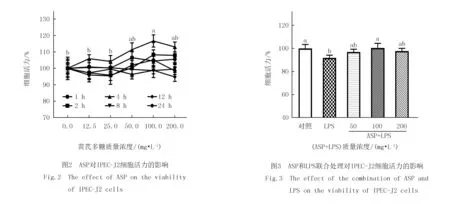
如图2所示,当ASP作用4 h时,随着ASP质量浓度的增大,细胞活力呈现增加趋势,且当ASP质量浓度为100.0 mg/L时,细胞活力达到最大值,显著促进了细胞增殖(P<0.05).而当ASP作用时间为1,2,8,12和24 h时,随着ASP质量浓度的增加,对IPEC-J2细胞增殖作用不显著(P>0.05).因此,后续实验选择ASP的作用时间为4 h,作用质量浓度为50.0,100.0和200.0 mg/L.
2.3 ASP减轻LPS致IPEC-J2细胞的损伤
如图3所示,10.0 mg/L LPS显著降低了细胞活力(P<0.05).而与LPS组相比,ASP与LPS共作用提高了细胞活力,且在ASP质量浓度为100.0 mg/L时,显著提高了细胞活力(P<0.05).因此,选择100.0 mg/L ASP作为缓解LPS对细胞损伤的最佳质量浓度进行后续实验.
2.4 ASP对LPS致IPEC-J2细胞内SOD,CAT酶活力和MDA含量的影响
由图4可知,LPS处理组的SOD和CAT酶活力显著降低(P<0.05),MDA含量显著升高(P<0.05),而ASP单独处理组对SOD,CAT活力及MDA含量无显著差异(P>0.05);与LPS组相比,ASP组和ASP+LPS组均显著提高了SOD和CAT酶活力(P<0.05),且显著降低了MDA含量(P<0.05).
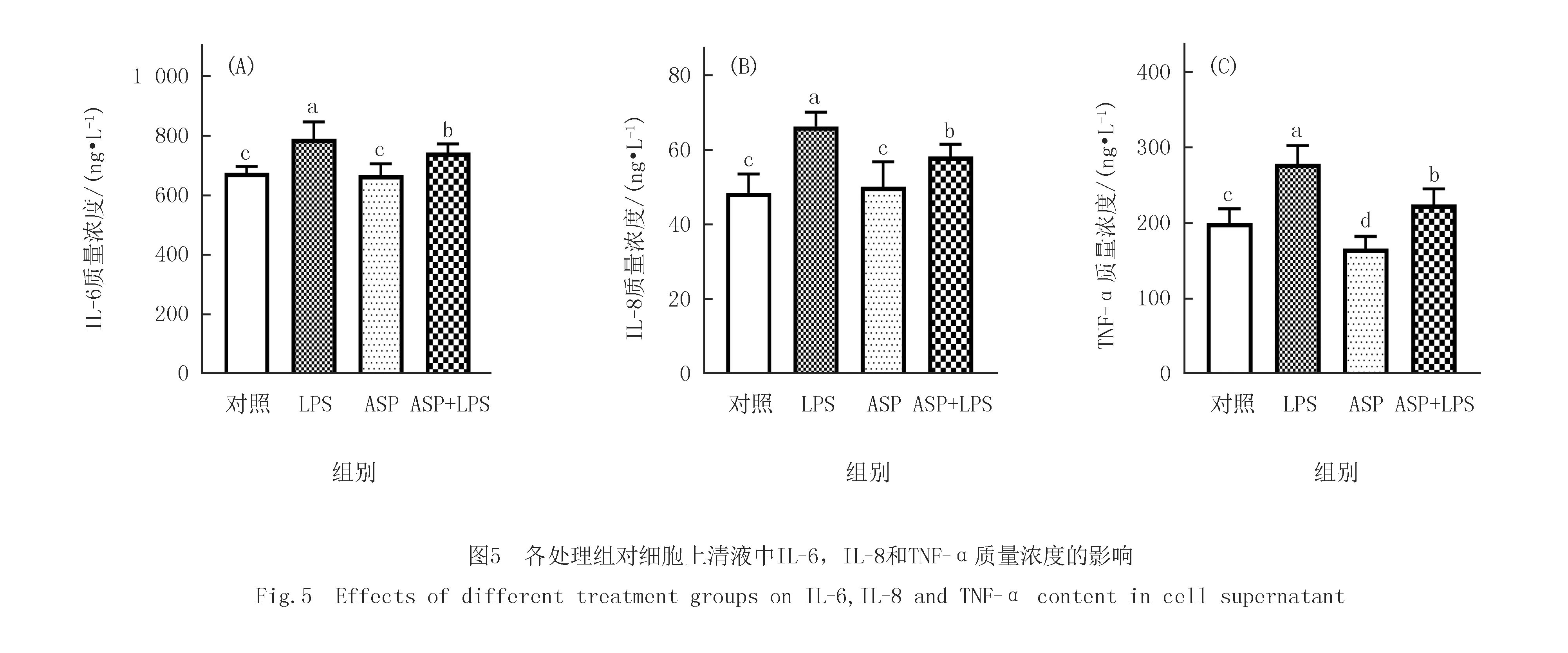
2.5 ASP对IPEC-J2细胞上清液中IL-6,IL-8和TNF-α含量的影响
如图5所示,添加LPS显著增加细胞上清液中IL-6,IL-8和TNF-α的含量(P<0.05),单独添加ASP显著降低了TNF-α的含量(P<0.05),但对上清液中IL-6和IL-8的含量影响不显著(P>0.05).与单独添加LPS组相比,ASP组和ASP+LPS组均可以显著降低细胞上清液中IL-6,IL-8和TNF-α的含量(P<0.05).
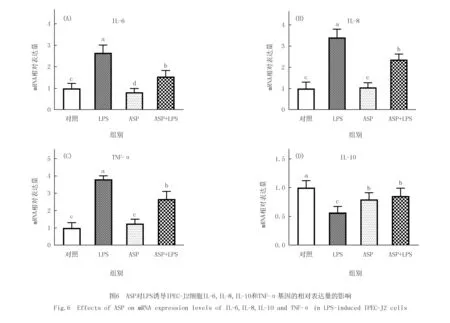
2.6 ASP对LPS致IPEC-J2细胞炎症相关基因表达的影响
如图6所示,添加LPS显著上调IL-6、IL-8和TNF-α基因的相对表达量(P<0.05),显著下调了IL-10基因.单独添加ASP显著下调IL-6基因的表达量(P<0.05),对IL-8和TNF-α基因的表达量无显著差异(P>0.05).与LPS组相比,ASP组和ASP+LPS组显著下调了IL-6,IL-8和TNF-α基因(P<0.05),显著上调了IL-10基因(P<0.05).
3 讨 论
黄芪是一味历史悠久、最为常用的中药之一,味甘、性温,有补气固表、利尿之功效.ASP是黄芪的主要生物活性成分,临床研究表明其具有增强机体免疫功能、降血糖、抗应激、抗肿瘤、抗氧化等多种功效[4].研究发现ASP对LPS诱导的内皮祖细胞功能损伤具有保护修复作用[5],腹腔注射LPS会造成肉仔鸡的炎症反应,肌肉注射ASP可以缓解其引发的炎症损伤,进而提高饲料效率[6-7].由此可见,LPS可以诱导机体发生炎症反应,而ASP则具有抗炎作用,然而ASP对缓解LPS诱导猪肠道氧化应激和炎症作用机制尚不清楚.本研究发现随着LPS浓度的增大及作用时间的延长对细胞活力的影响越大,且10.0 mg/L LPS刺激IPEC-J2细胞12 h能使细胞活力显著降低,这与ZHAO等[8]的研究结果一致.而ASP在作用4 h时即可促进IPEC-J2细胞的增殖,且用100.0 mg/L ASP预孵育细胞4 h后可显著提高细胞活力.由此推断ASP可能在参与细胞内免疫调节的受损细胞修复中发挥了关键作用.LPS可刺激细胞产生大量活性氧自由基,从而引发一系列氧化应激和炎症等反应[9].本研究中,LPS诱导的IPEC-J2细胞中SOD和CAT活性显著降低,MDA含量显著升高;而细胞经过ASP预处理后显著提高了抗氧化酶活力以及降低了MDA含量.这表明LPS诱导细胞发生氧化应激反应,且经ASP预处理后显著缓解了LPS引发的氧化应激反应.TNF-α,IL-6和IL-1β在肠道中表达上调,与炎症的严重程度相关,且TNF-α的过度表达会导致上皮屏障的损伤、上皮细胞凋亡的增加和趋化因子的分泌[10].研究发现,ASP通过影响THP-1源巨噬细胞IL-12,IL-10,TNF-α基因及蛋白的表达水平,从而起到调节细胞免疫功能,抑制肿瘤生长的作用.本研究发现LPS可诱导IPEC-J2细胞上清液中IL-6,IL-8,TNF-α的含量和其mRNA水平升高以及IL-10 mRNA水平的降低,可见,LPS可引起猪肠道上皮细胞的炎性细胞因子表达升高,引起炎症反应,该结果与文献报道结果一致[11].而当ASP预处理4 h后可以显著降低促炎因子的表达和提高抗炎因子的表达.此外,LI等[12]也发现ASP能有效抑制LPS诱导Caco 2细胞的炎症反应.表明ASP能够有效抑制LPS诱导的炎症反应,可通过抑制LPS刺激引起的炎症因子释放,达到对肠道上皮细胞炎症损伤的保护作用.
综上,10.0 mg/L LPS作用12 h可诱导IPEC-J2细胞发生氧化应激和炎症反应,而ASP处理可显著促进细胞增殖,减少LPS对细胞的损伤,显著升高细胞内SOD和CAT酶活力及降低MDA含量,并下调细胞上清液中IL-6,IL-8,TNF-α的含量和三者基因的表达,上调IL-10基因的表达,从而达到抗炎作用.

