不明原因复发性流产患者凝血功能、血液流变学状况及低分子肝素治疗效果
岳 蕾 宋晓晖* 徐 慧 李玉霞 徐婉丽
1.华中科技大学同济医学院附属武汉儿童医院(武汉市妇幼保健院)(430016);2.湖北省武汉市八医院
复发性流产(RSA)[1]发病机制复杂,有40%~60%病因不明为不明原因复发性流产(URSA)[2]。近年来,越来越多学者发现血栓前状态(PTS)与URSA关系密切,故诸多学者提出对URSA患者增加PTS相关指标的筛查并开展针对性治疗,但目前尚无统一标准[3]。低分子肝素(LMWH)是防治血栓的常用药物,近年有研究发现其用于URSA治疗可明显降低妊娠丢失率、改善妊娠结局[4]。本研究分析了URSA患者的凝血功能指标及血液流变学指标变化,观察LMWH治疗对其影响,为URSA患者PTS早期初筛及治疗提供参考。
1 资料与方法
1.1 一般资料
选择2019年1月-2020年6月本院妇产科就诊的URSA患者96例(URSA组)。纳入标准:①同一性伴侣连续发生≥2次自然流产史,临床检查诊断为URSA[1];②超声检查提示为宫内妊娠早期;③无生殖系统解剖畸形或器质性病变;④配偶精液检查正常,双方染色体核型及生殖内分泌检查结果正常;⑤精子抗体检查、抗心磷脂抗体、抗甲状腺过氧化物酶抗体及抗甲状腺球蛋白抗体等检查均呈阴性。排除标准:①合并严重脏器疾病、血液系统疾病、自身免疫性疾病;②合并生殖道及全身感染;③合并盆腹腔病变,如子宫肌瘤、子宫腺肌症、宫颈癌等;④入组前3个月内接受激素类药物、抗凝、抗血小板或促纤溶类药物治疗;⑤合并甲状腺疾病、糖尿病;⑥对本研究用药具有明确禁忌证。同期年龄匹配的健康早期妊娠女性48例作为健康组,既往无自然流产史,无其他不良妊娠史,排除标准同URSA组。纳入者均签署知情同意书,研究经医院伦理委员会审批。
1.2 研究方法
1.2.1治疗方法URSA组按随机数字表法分为观察组与对照组。两组均于备孕前3个月开始口服叶酸片0.4g/d;确定妊娠后给予常规保胎治疗,即绒毛膜促性腺激肌注1000 U/d,连续用药7~14d;黄体酮肌注20 mg/d,用药至妊娠10周后改口服黄体酮胶囊100 mg/次,2次/d;维生素E口服100mg/次,3次/d,用药至妊娠12周。怀疑同种免疫性流产者,患者及家属自愿情况下给予淋巴细胞主动免疫治疗或静脉注射免疫球蛋白(IVIG)被动免疫治疗。观察组给予低分子肝素皮下注射5000 IU/次,1~2次/d,最长用药至妊娠12周,期间严密监测凝血四项及D-二聚体(D-D),维持国际标准化比值(INR)为1.5~2.0,D-D<0.2mg/L或INR异常时停用低分子肝素。严密观察有无先兆流产症状,并于妊娠第6、8周B超复查,如发生胚胎停育及时终止妊娠,妊娠≥12周判定为成功妊娠。
1.2.2检测方法计划备孕期间(基线期)及妊娠第6周、8周末取纳入对象晨空腹静脉血,全自动凝血分析仪检测凝血指标D-D、凝血酶原时间(PT)、凝血酶时间(TT)、活化部分凝血酶活血酶时间(APTT)、纤维蛋白原(FIB),血液流变学分析仪检测血液流变学指标,包括高切(200/s)与低切(1/s)全血表观黏度、全血还原黏度、血浆黏度。
1.2.3资料收集记录受试者年龄、孕前体重指数(BMI)、停经时间、流产次数等一般资料。观察并记录URSA组治疗期间不良反应发生情况,如血小板减少症、出血相关并发症(皮肤瘀斑、出血)、注射局部渗出或疼痛等。
1.3 统计学方法
2 结果
2.1 一般临床资料比较
各组年龄、BMI、既往月经周期比较无差异,URSA组中观察组与对照组流产次数及免疫治疗情况比较无差异(P>0.05)。见表1。

表1 各组一般临床资料比较
2.2 URSA治疗效果评价
成功妊娠观察组43例(89.6%),对照组37例(77.1%),观察组成功妊娠率高于对照组(χ2=4.760,P=0.029)。
2.3 URSA治疗用药不良反应发生情况
对照组治疗期间无明显药物相关不良反应,观察组使用LMWH期间4例注射局部小面积瘀斑,1例注射局部疼痛,不良反应发生率为10.4%,但未发生骨质疏松、肝肾功能损害、血小板减少、大面积红斑或紫瘢等严重不良反应。
2.4 凝血功能指标比较
基线期URSA组D-D、FIB均高于健康组,PT、TT、APTT均短于健康组(P<0.05);妊娠6、8周时,观察组D-D、FIB均低于基线值且均低于对照组,PT、TT、APTT均较基线值延长且长于对照组(均P<0.05)。见表2。

表2 各组不同治疗时期凝血功能指标比较
2.5 各组血液流变学指标比较
基线期URSA患者全血表观黏度、全血还原黏度、血浆黏度均高于健康组(P<0.05);妊娠6、8周,观察组的全血表观黏度、全血还原黏度、血浆黏度无明显变化且与健康组差异不显著(P>0.05),而对照组与健康组均较基线值升高且对照组高于健康组和观察组(均P<0.05)。见表3。
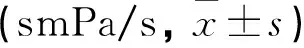
表3 各组不同治疗时期血液流变学指标比较
3 讨论
URSA由于病因不明,临床早期干预难度较大,具有极高的妊娠丢失风险。近年诸多研究发现,URSA可能与免疫紊乱、封闭抗体缺乏及PTS等密切相关,且50%以上的URSA患者存在至少一种易栓症[5]。PTS作为易栓症的主要病理表现,涉及血小板、抗凝-纤溶系统、血液流变学等多因素及过程,可引起子宫、胎盘血流动力学异常,导致胎盘微循环受损,影响胚胎或胎儿血供及养供,进而导致胚胎或胎儿停育[6]。
本研究结果显示,健康组在妊娠6、8周时D-D、FIB均有所升高,PT、TT、APTT均有所缩短。D-D是交联纤维蛋白(Fb)的一种特异性降解产物,其水平升高提示凝血-纤溶系统激活,被认为是机体高凝状态与纤溶系统激活的标识;凝血4项FIB、PT、TT、APTT则是评价机体凝血功能的敏感指标[7]。血液流变学指标是评价血液黏滞性、凝固性、流动性与变形性的重要指标,其过表达多提示血液高凝、高黏[8]。本研究中,健康组妊娠6、8周时,全血表观黏度、全血还原黏度、血浆黏度均较孕前升高,证实健康女性妊娠后可呈现生理性高凝、高黏状态,属正常自我保护机制,有利于维护胎盘完整性,并为产后子宫收缩以及止血提供物质基础。URSA患者孕前D-D、FIB即明显高于健康组,PT、TT、APTT较健康组明显缩短,全血表观黏度、全血还原黏度、血浆黏度均较健康组明显升高,与钟伟芬等[9]报道基本相符。提示URSA患者在孕前即已存在血液高凝、高黏状态,具有潜在血栓形成风险,而妊娠后PTS加重,血栓形成风险升高。过度血液高凝、高黏可增加子宫螺旋动脉或胎盘绒毛血管的血流阻力,导致血栓形成,进而导致胎盘-胚胎微循环障碍,影响母体与胎儿间物质交换,并可导致胎盘组织缺血缺氧,最终导致流产[10-11]。因此,充分重视对URSA患者的凝血功能及血液流变学参数监测,制定个性化的干预措施对于减少妊娠丢失具有积极意义。
目前,对于URSA的治疗尚缺乏统一标准,常规保胎治疗效果并不理想,虽有部分研究发现淋巴细胞主动免疫或静脉免疫球蛋白治疗具有一定疗效但仍存争议。LMWH是一种抗凝血酶依赖性凝血酶抑制剂[12]。其中抗血小板因子的能力远超普通肝素,具有强效抗凝作用及更少的出血反应,小剂量应用即可激活血管紧张素及血管活性物质,故可较好地改善脏器血流灌注,减少血管收缩所致渗出物并可缓解水肿症状[13]。同时,LMWH可刺激内源性肝素物质的释放,但不宜结合血小板及血小板因子4,故可促进血栓的溶解但不宜引起血小板减少症。此外,LMWH可激活纤溶酶,刺激纤溶酶原活性物质及前列环素样物质的生成与释放[14]。动物实验表明,LMWH可增强滋养层细胞的分化、侵袭能力,促进小鼠胚胎着床[15]。Karada等[16]研究显示,PTS相关复发性流产患者使用LMWH辅助治疗后妊娠成功率可达75%。岳钊平等[17]研究显示,使用LMWH治疗URSA能够较好地控制D-D至正常水平,提高妊娠成功率并延长妊娠时间。本研究结果显示,观察组使用LMWH治疗后,成功妊娠率高达89.6%,明显高于对照组的77.1%,有助于降低妊娠丢失风险。监测患者的凝血功能及血液流变学参数显示,妊娠6、8周时,观察组的D-D、FIB有所降低,PT、TT、APTT、FIB在妊娠8周时得以纠正,与健康组差异不明显,而对照组仍显著高于健康组与观察组;观察组全血表观黏度、全血还原黏度、血浆黏度增幅较小基本维持与健康组相当,而对照组呈现明显升高趋势且高于观察组与健康组。证实URSA患者妊娠后PTS有加重趋势,可能与妊娠早期滋养细胞侵袭血管内膜、纤维蛋白逐步沉积等有关。而使用LMWH干预能够调控凝血及血液流变学参数,改善PTS状态,这可能也是观察组成功妊娠率较高的原因之一。但在用药期间,观察组有10.4%的患者发生LMWH相关不良反应,用药期间严密监测凝血功能及不良反应非常必要。
综上所述,URSA患者在孕前可能已经存在PTS状态,妊娠早期凝血功能及血液流变学异常进一步加重。临床治疗时应加强对URSA患者凝血功能及血液流变学参数的检测,以指导临床早期筛查与干预治疗;使用LMWH干预能够在一定程度上改善患者PTS,减轻血液高凝、高黏状态,从而提高成功妊娠率。

