多育节荚孢霉感染的微生物实验室检测和诊疗现状
王星星,孟 涵,李曙光,王 启,王 辉
多育节荚孢霉(Lomentospora prolificans)隶属于真菌界,子囊菌门真子囊菌纲小囊菌目小囊菌科节荚孢霉属(Lomentospora),虽然按之前分类归类于赛多孢属,但其在形态学和临床特征上与赛多孢属其他菌种并不相同[1-3]。多育节荚孢霉作为一种土壤腐生菌随处可见,常在温带和热带地区的土壤中被分离出[4],也在污水、腐物等受污染的环境中存在。其所引起的感染呈世界范围内分布,主要存在于澳大利亚、美国西南部和西班牙等地区[5-7]。与其他国家相比,澳大利亚感染的发病率相对较高,可能是由于澳大利亚有利于真菌生长的气候和环境,也有专家认为土壤pH值起了一定的作用[8]。研究显示西班牙、美国和加拿大等国家的土壤pH值范围与澳大利亚土壤相 似[9],报告的病例主要来自这些地区。
多育节荚孢霉感染可累及人体的多个器官和系统,可引起致死性感染,常见于血液系统疾病和免疫功能低下人群。由于其感染所累及的器官和系统较多及患者免疫功能不全等因素,导致临床表现较为复杂,临床诊疗难度增大。现局限性和播散性感染病例逐年上升。播散性感染主要见于免疫功能不全患者,感染部位常累及多个部位,包括肺、脑、皮下组织等;而与创伤或溺水事件相关的感染通常导致局限性感染,感染以骨、关节、肺部和软组织等为主[10-11]。1984年,Malloch 等[12]首次报道了多育节荚孢霉所致的骨髓炎,西班牙学者的研究结果显示,血流感染的死亡率高于局限性感染[13]。回顾西班牙某医院1990—1999年由多育节荚孢霉导致的血行播散感染中6例患者有5例死亡,而多育节荚孢霉引起的局限性感染中12例患者有6例死亡[13]。研究发现多育节荚孢霉对多数抗真菌药物存在耐药性,包括临床常用的唑类、两性霉素、氟胞嘧啶类等药物[13]。西班牙学者对多育节荚孢霉感染中分离的15株多育节荚孢霉进行了体外抗真菌药敏试验,对氟胞嘧啶、两性霉素B、伊曲康唑、氟康唑、酮康唑和咪康唑等测试药物均为耐药,该研究中的多育节荚孢霉感染死亡率超过50%[11,13]。因此,及时诊断并抢先治疗对于多育节荚孢霉感染患者的最大生存期限和预后极为重要。现就多育节荚孢霉的微生物实验室检测、鉴定和诊疗现状作一综述。
1 分类
真菌主要依据形态特征进行分类,分级依次是门、亚门、纲、目、科,每个科又分为若干属,这些属又分为不同的种。目前真菌界分为7个门,主要有子囊菌门和担子菌门。多育节荚孢霉原是子囊菌门真子囊菌纲小囊菌目小囊菌科赛多孢属中的一种,因其在黏液团中能产生伸长的环痕细胞和倒卵球形的分生孢子,故早期被称作多育赛多孢霉(Scedosporium prolificans)。然而,分子研究证明多育节荚孢霉与赛多孢属亲缘关系相距甚远,故被重新分类于节荚孢霉属[14],更名为多育节荚孢霉。多育节荚孢霉是节荚孢霉属中唯一可引起人类致病的菌种,其感染呈世界性分布,但各地分离的多育节荚孢霉在生态学、耐药性和临床特征等方面也存在差异[13,15]。
2 微生物实验室检测
2.1 真菌培养
微生物实验室常规方法是通过真菌培养来鉴定多育节荚孢霉,多育节荚孢霉在普通培养基上均可生长,但因多育节荚孢霉不能耐受放线菌酮(环己酰亚胺),培养基中如含有放线菌酮将会抑制多育节荚孢霉的生长甚至不生长[13],因此,许多真菌学领域的学者建议选用半选择性培养基或选择性培养基对多育节荚孢霉进行培养,因为这类培养基可以抑制曲霉等的生长[15]。这类培养基包括Scedosporium Selective agar (SceSel+)及 其Scedo-Select Ⅲ,培养基中包含苯异甲基和氯硝铵[16-17],Blyth等[18]和Sedlacek等[19]大多数学者通过研究建议将非选择性培养基如SDA和选择性培养基联合使用,选择性培养基最好选SceSel+或DRBC,但微生物真菌培养工作选择SDA和SCDA联合使用,即可满足培养需求。
2.2 形态学
多育节荚孢霉生长速度较其他丝状真菌稍慢,且缺乏气生菌丝,所以如同时有快生长的丝状真菌(如曲霉等)常会掩盖多育节荚孢霉的生长,而导致漏检。多育节荚孢霉在平板上菌落形态较为多变,因此常常给临床初次分离鉴定带来困难。培养2 d一般可见菌落生长,在28℃温度下培养5~7 d,SCDA培养基上菌落表面平坦、扩展、黑色,绒毛样。SDA培养基上菌落表面平坦、扩展、橄榄灰绿色,绒面革样。见图1。多育节荚孢霉初步鉴定一般可用乳酸酚棉蓝(或苯胺蓝)染液染色后在荧光显微镜的400倍镜下观察,可见多育节荚孢霉以环痕产孢的方式产生分生孢子,分生孢子与菌丝相连的基部膨大,呈烧瓶形,分生孢子合轴成小堆,单细胞,透明到淡褐色,卵圆形到梨形,壁薄,光滑,见图2。
3 菌种鉴定
3.1 表型鉴定
丝状真菌的表型鉴定方法是利用碳水化合物和酶活性在40℃和45℃环境下生长。这些表型有助于菌种的鉴别,国外一些实验室有使用。用于表型鉴定的商业试剂盒有Taxa Profile Micronaut(Marlin Diagnostika GmbH, Berlin, Germany) 和GENⅢMicroPlateTM(BiologInc,Hayward, CA,USA)[20-21],用来检查真菌的各种生化反应系统。在实际工作中,表型方法已经基本被基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)鉴定和分子方法取代。
3.2 MALDI-TOF MS
尽管多位点DNA测序被认为是参考方法,MALDI-TOF MS能快速、相对经济地鉴定多育节荚孢霉感染,与许多分子方法相比具有相对的准确性,但前提是MS数据库包含参考谱图[22]。 Vitek®MS v3.0 (bioMerieux, Marcy L’etoile, France)在2017年7月被美国食品药品监督管理局(FDA)批准用于丝状真菌鉴定,但不包含多育节荚孢霉的谱图。其MALDI-TOF MS系 统 还 有MALDI Biotyper(Bruker Daltonics, Bremen, Germany)、Andromas(Andromas SAS, Paris, France) 和Axima-SARAMIS(Shimadzu/AnagnosTec,Duisburg, Germany)仅依靠这些数据库也不足以鉴定多育节荚孢霉[23-24]。虽然在Bruker数据库中有多育节荚孢霉,但4种菌株中只有1种被鉴定出来,然而4种菌株都是使用增强数据库进行鉴定的,这表明检测性能更依赖于数据库中是否包含本地菌株的谱型。
一般有两种方法:①双甲酸夹心法[25],即在靶板上先加1 μL甲酸,然后用无菌枪头取丝状真菌菌丝与甲酸充分混匀,自然干燥后再加1 μL的甲酸,最后在干燥后添加1 μL基质,然后放入质谱仪进行检测。②甲酸乙腈萃取法,按照Bruker和Vitek MS系统推荐的丝状真菌提取丝状真菌蛋白,在此基础上可以使用磁珠震荡破壁、预加热等[26]对破壁环节进行优化。提取后取1 μL样本点靶,自然干燥后添加1 μL基质,干燥后放入质谱仪进行鉴定。鉴定评分:每株菌点靶2次进行鉴定,记录结果一致时的菌名和鉴定得分[27],鉴定标准为鉴定到种水平得分≥1.7分或<1.7分但所有鉴定结果一致为同一种菌;鉴定得分在1.5~<1.7分可为属水平,<1.5分或者鉴定结果为多种菌,则鉴定结果不可靠。Sleiman等[28]通过将Bruker MS丝状真菌数据库与实验室自己建立的包含4种节荚孢霉参考谱图数据联合使用,可将鉴定合格率从18%提升至94%。
3.3 分子生物学
对患者感染部位的标本进行PCR检测是多育节荚孢霉感染的快速诊断方法,特别是在因真菌培养时间长而未报告结果之前。基于DNA序列的分析是目前所有真菌物种鉴定的“金标准”。对真菌的DNA进行识别,其特定区域能够鉴别出多育节荚孢霉。滚动循环扩增(RCA)是使用简单的恒温扩增模式鉴定单核苷酸序列,有学者利用ITS-directed RCA鉴定出了多育节荚孢霉[29]。RCA的优点是程序可以快速执行(2 h内)且仅需要恒温水浴,具有操作简单和成本低的优点。
3.4 二代测序技术(NGS)
应用NGS进行丝状真菌的鉴定正在应用于临床,但目前用NGS来鉴定多育节荚孢霉较少。国外的一项小型研究显示检测了一家医院8个月分离的4株多育节荚孢霉[30],各分离株间存在 10 000个单核苷酸多态性(SNP)。不同生物信息数据分析结果将干扰最终结果,在研究遗传多态性时将真菌的这种多态性考虑在内也很重要。而且NGS检测实验周期长,检测成本昂贵,对临床标本要求也高,因此并不适用于微生物日常真菌鉴定工作,但在患者难确诊病因且经济允许状况下可供选择。
4 诊疗现状
4.1 诊断
临床诊断多育节荚孢霉感染一般除了实验室诊断外,更多的还是依靠患者的流行病学史、临床特征、组织病理学、影像学和血清学进行诊断。
4.1.1 组织病理学 虽然用组织病理学的方法无法将真菌鉴别到种,但通过传统染色,如镀银(GMS)染色,苏木精和伊红(HE)和过碘酸-希夫(PAS)染色,对侵袭性真菌感染(IFD)的诊断都有很高的临床价值[31]。许多学者强烈推荐如高度怀疑多育节荚孢霉感染的患者可取组织进行组织病理学检查[15,31]。多育节荚孢霉能产生色素沉着于菌丝上,因此可直接镜检观察,组织病理学特点与曲霉感染相似,菌丝外观透明,也有分枝、分隔,且呈锐角。有学者认为患者组织中的菌丝常有两条平行菌丝分枝呈H型分布[31-32],可作为组织病理学观察依据,但并不具有特异性。
4.1.2 影像学 多育节荚孢霉引起的丝状真菌侵袭性感染影像学主要表现为实变、结节、坏死性肺炎、肺脓肿和胸膜渗出[12,14],无特异性可作为辅助诊断。
4.1.3 血清学 怀疑多育节荚孢霉感染的患者可进行G试验,G试验检测的主要成分是真菌细胞壁抗原(1,3)-β-D-葡聚糖。(1,3)-β-D-葡聚糖存在于真菌的细胞壁中,在除毛霉和隐球菌感染外的IFD患者血液中能够检测到。G试验检测快速,血清、脑脊液、肺泡灌洗液等标本都可用于临床检测,由于某些抗真菌药物(如米卡芬净、卡泊芬净等)会干扰G试验的结果,一般推荐在抗真菌用药前或用药6 d内进行G试验检测[33]。其阴性预测值可达96%~100%,但特异性不高,因此一般用G试验作为临床高危人群筛查和辅助诊断[34]。
4.2 治疗
国际上对于多育节荚孢霉感染在患病率和发病率数据上并没有大数据支持,很大程度上来说是未知的[35],而我国多育节荚孢霉感染病例报告较少[36]。Seidel等[3]分析了2000—2018年的相关数据(PubMed和FungiScope®registry),来自澳大利亚、美国、日本和西班牙等国家的56例多育节荚孢霉感染病例[澳大利亚(14例),美国和日本(各8例),西班牙(7例),法国和德国(各5例),其他国家(印度、意大利和英国各2例,巴西、荷兰和波兰各1例]被纳入分析。分离的56株多育节荚孢霉中18株有药敏结果(见表1),在所有抗真菌药物的药敏试验中,MIC中位数为 8 mg/L或更高。偶有米卡芬净、两性霉素B或伏立康唑对分离株的MIC为1 mg/L或更低。除米卡芬净外,所有被检测的抗真菌药物的MIC均至少为 4 mg/L。
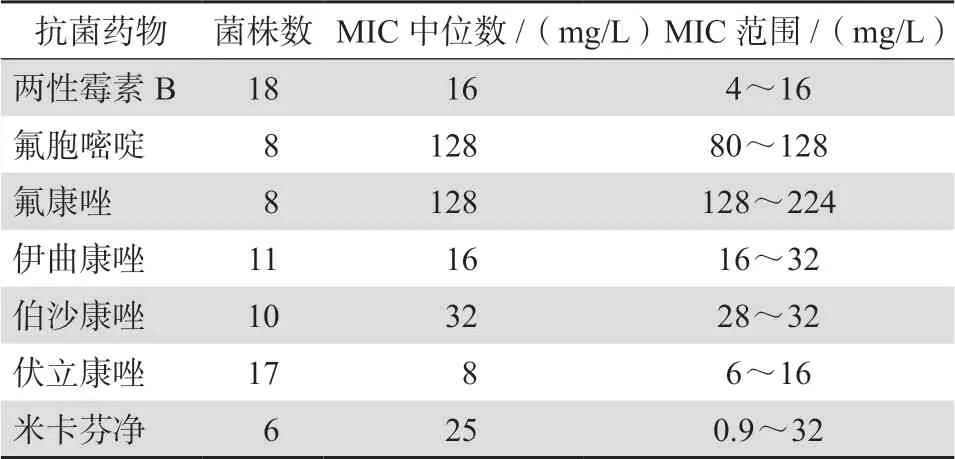
表1 18株多育节荚孢霉菌株的体外药敏
多育节荚孢霉对目前可选用的抗真菌药物均具有一定耐药性,而且由于存在着物种特异性易感模式,因此必须鉴定到种,才能准确地给予合理治疗,使患者有一个良好的预后[37]。近几年的研究显示联合抗真菌治疗要比单药治疗的28 d生存率高(联合治疗24例,生存15例,生存率为63%;单药治疗16例,生存4例,生存率为25%)[38]。一般首选治疗用药是伏立康唑,近几年研究显示特比萘芬和伏立康唑联合用药后患者预后相对更好[13,39-40]。虽然特比萘芬一般不单独用于临床治疗,但与伏立康唑联合在体外具有协同作用,泊沙康唑也有一定程度上的协同作用。有文献研究表明伏立康唑联合两性霉素B也有一定治疗效果,但患者生存率相对较低[38]。而指南一般推荐伏立康唑为一线药物联合其他抗真菌药物进行治疗,通常将特比萘芬与伏立康唑联合使用进行治疗[35]。虽然联合治疗可以改善临床表现但并不能根除真菌[41],因此一般在药物治疗的同时用手术作为辅助治疗,手术切除病变部位是治疗多育节荚孢霉感染的重要手段,手术后患者预后较好。对于免疫功能缺陷患者在药物治疗的同时提高患者免疫功能也是治疗的重要辅助手段。
4.3 预后
对于感染多育节荚孢霉的患者,其预后和感染者的基础疾病和感染部位相关,侵袭性感染的患者预后差,平均生存率低,局部感染患者经外科手术和抗真菌治疗后预后较好。国内2019年报道显示多育节荚孢霉感染仅3例[36],1例局限性鼻窦感染患者外科干预后预后良好,2例侵袭性感染患者中1例死亡,另1例未知。国外2019年研究数据显示多育节荚孢霉感染[3]中有恶性肿瘤的死亡率可达85.7%,恶性肿瘤中的侵袭性感染死亡率可高达91.7%;实体器官移植死亡率达85.7%;免疫功能正常的患者死亡率相对较低(25%)。
综上所述,微生物实验室检测和病理学检测都能辅助诊断多育节荚孢霉,其中PCR检测和质谱鉴定可用于确诊。而NGS方法常需要专业的检验人员和场所,而且由于NGS检测费用较高,一般不推荐用于临床常规检查,除非一些疑难且无法确定病因的患者,但同时也要考虑患者经济条件。因此,在资源有限的情况下,真菌培养和形态检测仍然是诊断的主要手段,在菌种鉴定方面,可优先考虑质谱。因多育节荚孢霉感染存在早期诊断困难和诊断时间长的问题,我们应提高对该病的认识,并促进质谱和分子生物学鉴定的开展,从而提高早期诊断率,以便临床及时合理治疗改善患者预后,降低多育节荚孢霉感染的死亡率。

