重症患者持续与间歇输注万古霉素血药浓度监测结果分析
黎命娟,鹿中华,杨 翔,曹利军,孙 昀
万古霉素是一种糖肽类抗生素,对多种病原菌有杀菌作用,比如耐甲氧西林金黄色葡萄球菌(MRSA)、表皮葡萄球菌、肠球菌、化脓链球菌等,尤其是MRSA感染的一线用药。万古霉素是一种时间依赖型抗生素,其杀菌作用与抗生素后效应(PAE)及血药浓度高于最低抑菌浓度(MIC)的持续时间有关。相关研究表明,万古霉素血药谷浓度过低,病死率越高,可能与未达到治疗效果有关;而血药浓度过低(<10 mg/L)与出现万古霉素中介金黄色葡萄球菌(VISA)和异质性万古霉素中介金黄色葡萄球菌(hVISA)有直接关系[1-2]。同时万古霉素治疗指数小,血药浓度过高,可导致耳毒性和肾毒性。因此,监测万古霉素血药浓度和指导临床用药显得尤为重要。临床采用间歇输注万古霉素经常出现血药谷浓度不达标的情况,特别是重症感染患者个体差异大,合并脏器功能不全、低蛋白血症、使用肾毒性药物等多种影响因素,持续药物治疗浓度不达标必然导致临床治疗效果不理想。因此,静脉持续输注万古霉素方式受到临床关注。一些医院尤其是ICU已将万古霉素持续静脉输注作为标准的给药方式[3-5]。本研究比较万古霉素持续和间歇输注时血药浓度达标情况及临床治愈率,分析两种输注方式血药浓度的差异,探索适合重症患者的输注方式;同时比较两种输注方式对临床结局的影响。
1 材料与方法
1.1 临床资料
回顾性分析2018年10月—2021年5月安徽医科大学第二附属医院ICU持续和间歇输注万古霉素的危重症患者。收集两组患者万古霉素血药浓度和临床基本资料:包括性别、年龄、体重指数(BMI)、白蛋白水平、肌酐清除率(Ccr),以及万古霉素疗程前后血肌酐(Scr)值。纳入标准:年龄18~80岁,确诊或疑似革兰阳性菌感染,持续或间歇静脉使用万古霉素,并监测血药稳态(谷)浓度的患者。排除未成年人、孕妇、Scr异常、接受血液净化治疗、万古霉素过敏、给药剂量过少,用药时间过短,未监测血药浓度的患者。本研究经医院伦理委员会批准。
1.2 研究方法
所有患者静脉使用万古霉素(稳可信,500 mg/瓶,美国礼来公司),持续输注组给予15 mg/kg的负荷剂量,维持剂量2 g/24 h持续泵入,使用24~48 h后监测万古霉素稳态浓度;间歇输注组通常给予15 mg/kg负荷剂量,每12小时或8小时给予1 g静脉滴注,即2 g~3 g/24 h,持续时间需>1 h,在第5剂使用前监测首次血药谷浓度。万古霉素血药浓度检测方法采用酶放大免疫法,检测仪器为西门子仪器厂生产,万古霉素试剂盒为西门子公司产品,质控试剂为美国公司 BIORAD 产品。
输注万古霉素导致的肾毒性定义为:经过数天的万古霉素治疗后,如果有多次(至少2个或3个连续性)Scr浓度升高(增加44.2 μmol/L,或者从基线增幅>50.0%,以较高者为准),在无其他原因可解释时,被视为万古霉素导致的肾毒性。
1.3 统计方法
采用SPSS 20.0统计软件分析数据;对研究变量进行描述性统计分析,计量资料以均数±标准差表示,正态分布的计量资料采用t检验,计数资料采用卡方检验;应用logistic回归进行相关分析,多重线性回归法分析万古霉素血药浓度的影响因素;P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
纳入研究的万古霉素持续输注组32例,间歇输注组44例;两组比较,患者性别、年龄、BMI、Ccr、白蛋白差异均无统计学意义(P>0.05),见表1。
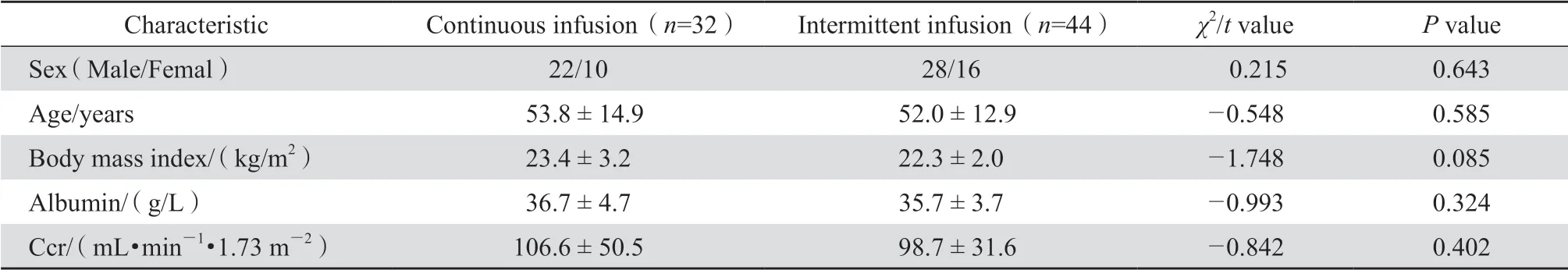
表1 持续输注与间歇输注组患者的临床基本资料Table 1 Clinical data of patients receiving vancomycin by continuous or intermittent infusion
2.2 持续和间歇输注万古霉素血药浓度分布情况
万古霉素持续输注组血药浓度范围为9.4~29.8 mg/L,平均为(17.3±4.8)mg/L;其中< 10 mg/L占3.1%(1/32),10~<15 mg/L占31.2%(10/32),15~20 mg/L占43.8%(14/32),>20~25 mg/L占15.6%(5/32),>25 mg/L占6.2%(2/32)。达到2020年万古霉素治疗严重MRSA感染指南[6]推荐的目标稳态治疗浓度(15~25 mg/L)的比例为59.4%。
万古霉素间歇输注组血药谷浓度范围为2.0~24.8 mg/L,平均为(9.4±4.9)mg/L;其中< 10 mg/L占56.8%(25/44),10~<15 mg/L占31.8%(14/44),15~20 mg/L占9.1%(4/44),>20 mg/L占2.3%(1/44)。达目标谷浓度(10~ 20 mg/L)范围的比例仅为40.9%,达到重症MRSA感染的目标谷浓度15~20 mg/L的比例仅为9.1%。
万古霉素持续输注组血药浓度[(17.3±4.8)mg/L]高于间歇输注组[(9.4±4.9)mg/L],两组血药浓度差异具有显著统计学意义(P<0.01)。
根据血药浓度范围分组:A组(<10 mg/L)、 B组(10~20 mg/L)、C组(>20 mg/L),比 较 不同输注方式时三组血药浓度分布是否存在差异。持续输注组血药浓度≥10 mg/L的患者占96.9%;而间歇输注组血药浓度<10 mg/L的患者占56.8%。两种输注方式三组总体均存在显著差异(P<0.001):A组与B组、A组与C组差异均有统计学意义 (P<0.05),B组与C组差异无统计学意义(P>0.05)。
2.3 血药浓度达标情况对临床结局和微生物学结局影响
分别统计持续输注组和间歇输注组血药浓度达标与未达标时患者临床结局和微生物学结局的影响。结果显示两组差异均无统计学意义(P>0.05)。见表2、表3。
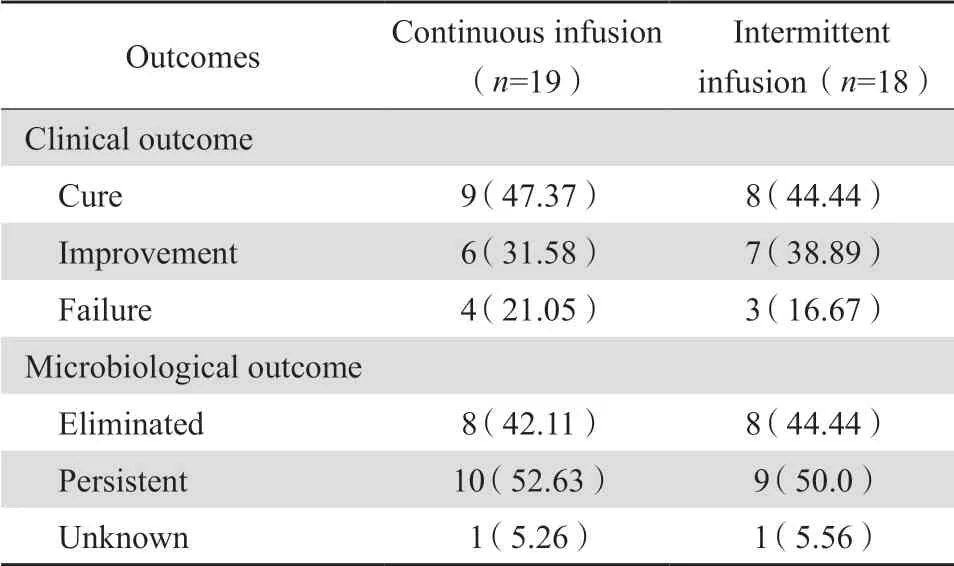
表2 血药浓度达标患者的临床结局和微生物学结局Table 2 Clinical and microbiological outcomes of patients after reaching target blood concentration of vancomycin via continuous or intermittent infusion[n(%)]
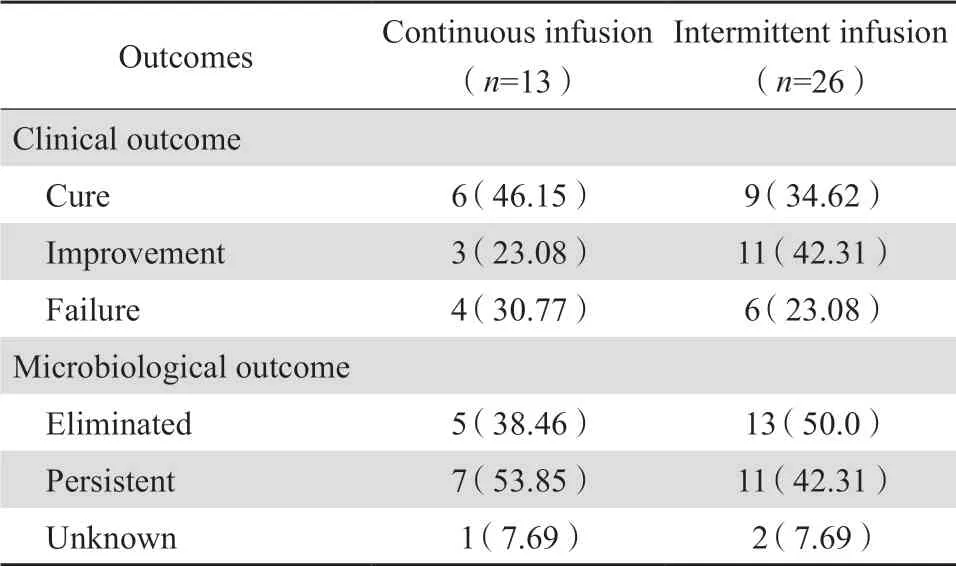
表3 血药浓度未达标患者的临床结局和微生物学结局Table 3 Clinical and microbiological outcomes of patients not reaching target blood concentration of vancomycin via continuous or intermittent infusion[n(%)]
logistic回归分析显示,间歇输注组和持续输注组血药浓度与临床结局相关性均不显著,P>0.05。
2.4 影响万古霉素血药浓度的因素
多重线性回归分析结果显示,Ccr对间歇输注组血药浓度的影响差异有统计学意义(P<0.05);持续输注组年龄、BMI、白蛋白、Ccr对血药浓度的影响差异均无统计学意义(P>0.05)。
2.5 万古霉素两种输注方式对肾功能的影响
万古霉素血药浓度<15 mg/L时,持续输注组和间歇输注组发生肾毒性比例分别为9.1%(1/11)和10.3%(4/39),两组差异无统计学意义(P=0.909);万古霉素血药浓度≥15 mg/L时,两组患者发生肾毒性比例分别为9.5%(2/21)和60.0%(3/5),两组的肾毒性差异有显著统计学意义(P=0.01)。
3 讨论
万古霉素常用于治疗MRSA和其他革兰阳性球菌感染,临床上间歇输注时血药浓度不达标者比比皆是,从而影响临床疗效。美国感染病学会(IDSA)及中国万古霉素临床应用指南均认为万古霉素血药谷浓度应保持在10 mg/L以上[7-8];而且2011年IDSA关于MRSA感染的治疗指南建议对于ICU的重症MRSA感染患者,血药谷浓度维持在15~20 mg/L以使感染灶的药物浓度达到有效杀菌作用[8]。而重症感染患者因多种影响因素常伴有药物浓度的改变,因此监测血药浓度达标率显得尤为重要。
万古霉素持续静脉滴注,近些年被广泛用于临床。万古霉素属于长PAE的时间依赖型抗生素,有研究表明,就疗效而言,万古霉素既可以间歇输注,也可以持续静脉给药[9-11]。持续输注万古霉素监测的是稳态浓度,相比于间歇输注,持续输注可以更快地达到稳态浓度,而且较间歇输注时达标率更高,本研究结果也表明达到IDSA推荐的目标谷(稳态)血药浓度两组达标率分别为40.9%(间歇输注组)和59.4%(持续输注组),但间歇输注组达到重症MRSA感染的目标谷浓度比例仅为9.1%,且两组的平均血药浓度差异显著[(9.4±4.9)mg/L对(17.3±4.8)mg/L,P<0.01]。此 外,持续输注组稳态浓度监测更方便,对于间歇输注组,谷浓度监测时间非常重要,通常在血药浓度达到稳态后并在下一次给药前30 min采集样本,而临床上,采样时间不正确已成为影响谷浓度的一个重要因素[12]。而持续输注时,一旦万古霉素达到稳态浓度,可随时进行监测,临床工作更方便且可根据结果随时调整药物剂量,也一定程度上节约了治疗成本。
就临床疗效而言,本研究结果显示,间歇输注与持续输注万古霉素临床结局和微生物学结局差异无统计学意义。相关研究也显示,持续输注与间歇输注万古霉素临床失败率两组差异无统计学意义[13-14]。纳入观察性研究7篇和随机对照研究1篇的相关荟萃分析比较了持续输注组535例、间歇输注组334例,两组间临床失败率及死亡率差异均无统计学意义[15]。部分研究虽然认为持续输注组相比于间歇输注组有更好的疗效,但临床样本量太少,尚待进一步研究。
本研究显示,间歇输注组血药谷浓度结果与Ccr存在相关性,与较多分析万古霉素间歇输注时血药浓度影响因素的研究一致。研究表明,Ccr较高,尤其是高Ccr(Ccr>120 mL·min-1·1.73 m-2) 和 肾 功 能 亢 进(Ccr>130 mL·min-1·1.73 m-2) 时,万古霉素血药浓度普遍较低[16-17]。重症患者在疾病早期通常存在大量补液、机体的高代谢状态等会导致Ccr的增加,而万古霉素90%以原型从肾小球滤过,因此导致万古霉素的清除过多,血药浓度过低。重症感染患者间歇输注万古霉素时,需根据Ccr及时调整给药剂量。而持续输注万古霉素血药浓度与Ccr等影响因素相关性不显著,持续输注监测的是稳态浓度,而根据2020年万古霉素治疗药物监测指南[6],持续输注万古霉素后24~48 h内即可开始药物浓度监测;有关研究也指出,持续输注组有79.0%的患者在用药2 h后血药浓度保持相对稳定[18],说明万古霉素持续输注时可以在较短时间内达到稳态血药浓度,血药浓度不存在间歇输注时的峰-谷浓度变化,稳态浓度可以在持续输注期间保持一定的水平。
持续和间歇输注万古霉素对肾功能的影响一直备受关注,本研究结果显示,血药浓度<15 mg/L 时,两种输注方式的肾毒性差异无统计学意义;而血药浓度≥15 mg/L时,间歇输注组的肾毒性显著高于持续输注组。持续输注万古霉素可以使血药浓度保持在相对稳定且合理的范围,避免间歇输注时的峰-谷浓度变化,从而避免了肾损伤的风险[15],在达到目标浓度范围内导致肾毒性发生风险相似或更低[6]。Flannery等[19]荟萃分析显示,与间歇输注比较,持续输注可以降低急性肾损伤(AKI)的发生率约50.0%,可以避免间歇输注的高峰值浓度,最大限度地降低万古霉素相关 AKI 的风险;并可以减少血药浓度的变异性。以往AUC/MIC作为万古霉素等糖肽类抗生素的主要药动学/药效学(PK/PD)的靶标,至2009年IDSA指南推荐谷浓度15~20 mg/L作为AUC/MIC的替代指标,而有研究表明,与基于谷浓度的给药相比,基于AUC的万古霉素给药与AKI的发生率降低相关,特别是考虑到越来越多的证据表明谷浓度与AUC的相关性较差,当达到15~20 mg/L 的谷浓度可能会提供超治疗的AUC/MIC[20-21]。因此血药浓度>15 mg/L时,相比于持续输注,间歇输注会明显增加患者的肾毒性。
综上所述,持续输注万古霉素可以更快地达到目标治疗浓度,但是持续和间歇输注对患者的临床结局及微生物学结局影响差异并无统计学意义。临床上间歇输注万古霉素应考虑Ccr对血药浓度的影响,同时当达到目标范围的血药浓度时,应注意监测患者的肾功能变化。持续输注的方式可使血药浓度达标率更高,且肾毒性较小,是一种安全有效的输注方式。

