circ_0062389通过靶向miRNA-331-3p对ox-LDL诱导的血管内皮细胞损伤的影响及其机制研究*
曹俊杰,黄 剑,刘占鳌,霍桂军,汤 尧
[南京医科大学姑苏学院/南京医科大学附属苏州医院/苏州市立医院(本部)血管外科,江苏苏州 215002]
动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病的病理基础,极大威胁人类生命健康。血管内皮细胞是维持血管壁结构和功能的重要屏障,其损伤是AS发生的始动环节[1]。因此,抑制或减轻血管内皮细胞损伤是预防和治疗AS的重要途径。环状RNA(circRNA)是一类非编码RNA,可作为微RNA(microRNA,miRNA)分子海绵发挥作用,调控miRNA靶基因的表达,进而影响细胞生理或病理过程,参与人类多种疾病的发展进程[2-4]。研究显示,circ_0062389在心力衰竭大鼠心肌组织中高表达,沉默其表达可明显降低大鼠心肌细胞凋亡,改善大鼠心肌功能,其作用机制与调控转化生长因子-β1(transforming growth factor-β1,TGF-β1)/SMAD家族成员3(Smad3)信号通路有关,有可能成为治疗心力衰竭的分子靶点[5]。但目前,circ_0062389对AS发生、发展的影响和机制还不清楚。Circular RNA Interactome靶基因在线软件预测显示,circ_0062389可能竞争性结合miRNA-331-3p。ZHANG等[6]研究显示,脊髓损伤大鼠脊髓中miRNA-331-3p表达下调,miRNA-331-3p过表达可改善脊髓损伤大鼠运动能力,减轻脊髓组织损伤、神经元凋亡和炎性反应,可用作治疗脊髓损伤的分子靶点。而目前miRNA-331-3p对AS发生、发展的影响还不清楚,因此,本研究通过建立氧化型低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)诱导的血管内皮细胞损伤模型,观察circ_0062389和miRNA-331-3p对血管内皮细胞氧化应激和凋亡的影响及circ_0062389可否通过调控miRNA-331-3p发挥作用,以期为AS的治疗提供分子靶点。
1 材料与方法
1.1 材料
细胞:人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVEC),购自上海弘顺生物科技有限公司。试剂:改良杜氏伊格尔培养基(Dulbecco′s Modified EagleMedium,DMEM)和膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-fluoresceinisothiocyanate/propidium iodide,Annexin V-FITC/PI)细胞凋亡试剂盒,购自北京索莱宝公司;LipofectamineTM2000试剂盒,购自美国Invitrogen公司;胎牛血清(fetal bovine serum,FBS),购自浙江天杭州生物科技股份有限公司;circ_0062389小干扰RNA(si-circ_0062389)、小干扰RNA阴性序列(si-NC)、miRNA-331-3p抑制剂(anti-miRNA-331-3p)、抑制剂阴性序列(anti-miRNA-NC)、miRNA-331-3p 模拟物(mimics)、模拟对照序列(miRNA-NC)和聚合酶链反应(polymerase chain reaction,PCR)引物,均购自上海生工生物工程有限公司;RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒,购自大连宝生物工程有限公司;丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒,购自南京建成生物工程研究所;兔抗人活化型半胱氨酸天冬氨酸蛋白酶(cleaved-caspase)3和cleaved-caspase9单克隆抗体,购自美国Santa Cruz公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒和双荧光素酶活性检测试剂盒,购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1细胞培养和转染
复苏HUVEC,用含10% FBS的DMEM培养液培养。取对数期HUVEC,将其接种至6孔板中(1.0×105个/孔),培养12 h后弃培养液。采用LipofectamineTM2000脂质体法,分别转染si-NC、si-circ_0062389、miRNA-NC、miRNA-331-3p mimics、共转染si-circ_0062389与anti-miRNA-NC、si-circ_0062389与anti-miRNA-331-3p,转染12 h后更换新鲜培养液,再培养24 h后,实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)法检测细胞中circ_0062389或miRNA-331-3p表达验证转染效果,并收集细胞备用。
1.2.2细胞分组处理
将未转染、转染后的HUVEC均接种至6孔板中(1.0×105个/孔),培养12 h后弃培养液。未转染的HUVEC分为对照组(Con组)和ox-LDL组,Con组细胞用常规培养液培养24 h,ox-LDL组细胞用含ox-LDL终浓度为100 μg/mL[7]的培养液培养24 h。转染si-NC、si-circ_0062389、miRNA-NC、miRNA-331-3p mimics、共转染si-circ_0062389与anti-miRNA-NC、si-circ_0062389与anti-miRNA-331-3p的细胞均用含ox-LDL终浓度为100 μg/mL的培养液培养24 h,并依次记为 ox-LDL+si-NC组(A组)、ox-LDL+si-circ_0062389组(B组)、ox-LDL+miRNA-NC组(C组)、ox-LDL+miRNA-331-3p组(D组)、ox-LDL+si-circ_0062389+anti-miRNA-NC组(E组)、ox-LDL+si-circ_0062389+anti-miRNA-331-3p组(F组)。培养结束后,收集各组细胞并用磷酸盐缓冲液(phosphate buffer solution,PBS)清洗2次,然后检测以下指标。
1.2.3RT-qPCR检测circ_0062389和miRNA-331-3p表达
用RNA抽提试剂盒提取各组HUVEC中总RNA,经逆转录生成cDNA后,行PCR扩增。扩增程序:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共35个循环。引物序列:circ_0062389上游5′-GTA CGA GAT GAG TCG ACG CGC-3′,下游5′-CGA TAG GCG CGA GCG AGC-3′;miRNA-331-3p上游5′-TCG GCA GGG CCC CTG GGC CTA-3′,下游5′-GCC CCU GGG CCU AUC CUA GAA-3′;GAPDH上游5′-GTT GGA GGT CGG AGT CAA CGG-3′,下游5′-GAG GGA TCT CGC TCC TGG AGG A-3′;U6上游5′-GCT TCG GCA GCA CAT ATA CTA AAA T-3′,下游5′-CGC TTC AGA ATT TGC GTG TCA T-3′。2-ΔΔCt法计算circ_0062389 相对于GAPDH、miRNA-331-3p相对于U6的表达水平。
1.2.4酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测HUVEC中MDA水平及SOD和GSH-Px活性
向HUVEC中加入细胞裂解液,充分裂解细胞,3 500 r/min离心5 min,取上清液,分别参照MDA、SOD和GSH-Px试剂盒,检测上清液中其表达水平。
1.2.5流式细胞仪检测细胞凋亡
向各组HUVEC中加500 μL结合缓冲液,将细胞重悬。然后利用Annexin V-FITC/PI试剂盒,依次加10 μL Annexin V-FITC和5 μL PI,室温避光孵育15 min后,用流式细胞仪检测细胞凋亡。
1.2.6Western blot检测cleaved-caspase3和cleaved-caspase9蛋白表达
将各组HUVEC中加放射免疫沉淀试验(radioimmunoprecipitation assay,RIPA)试剂,充分裂解细胞,提取细胞中总蛋白。将蛋白溶液经BCA法定量、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、转膜及封闭后,分别置于cleaved-caspase3(1∶1 000)、cleaved-caspase9(1∶1 000)、GAPDH(1∶1 000)一抗孵育液,在4 ℃冰箱中孵育过夜。洗膜后置于山羊抗兔二抗(1∶2 000)孵育液中,在37 ℃摇床中孵育1 h。洗膜后加显影液避光显影,凝胶成像系统曝光拍照,Image J软件分析cleaved-caspase3和cleaved-caspase9相对于GAPDH表达水平。
1.2.7双荧光素酶报告基因实验
根据Circular RNA Interactome靶基因在线软件预测circ_0062389与miRNA-331-3p核苷酸序列的结合位点,分别构建circ_0062389野生型荧光素酶载体(WT-circ_0062389)及突变型荧光素酶载体(MUT-circ_0062389),该过程由上海生工生物工程有限公司设计并完成。将HUVEC接种至6孔板中(1.0×105个/孔),用LipofectamineTM2000脂质体法,分别将WT-circ_0062389和miRNA-NC、WT-circ_0062389和miRNA-331-3p mimic、MUT-circ_0062389和miRNA-NC、MUT-circ_0062389和miRNA-331-3p mimic共转染至HUVEC中。转染12 h后,更换新鲜培养液,再培养24 h收集细胞,加细胞裂解液裂解,3 500 r/min离心5 min,取上清液,参照荧光素酶活性检测试剂盒检测荧光素酶活性,结果以萤火虫与海肾荧光强度的比值表示。
1.3 统计学分析
2 结 果
2.1 ox-LDL组与Con组HUVEC中circ_0062389和miRNA-331-3p表达水平比较
ox-LDL组HUVEC中circ_0062389表达水平高于Con组(3.01±0.29vs.1.00±0.00,t=20.79,P<0.01),而miRNA-331-3p表达水平低于Con组(0.33±0.03vs.1.00±0.00,t=67.00,P<0.01)。
2.2 各组HUVEC中MDA水平及SOD、GSH-Px活性比较
B组HUVEC中circ_0062389表达低于A组(0.23±0.03vs.1.00±0.00,t=77.00,P<0.01)。与Con组比较,ox-LDL组HUVEC中MDA水平升高(P<0.05),SOD和GSH-Px活性降低(P<0.05)。与A组比较,B组HUVEC中MDA水平降低(P<0.05),SOD和GSH-Px活性升高(P<0.05)。ox-LDL组与A组各检测指标比较差异均无统计学意义(P>0.05),见表1。
表1 各组HUVEC中MDA水平及SOD、GSH-Px活性比较
2.3 各组HUVEC中凋亡相关蛋白表达水平比较
ox-LDL组HUVEC中细胞凋亡率高于Con组[(30.38±3.45)%vs.(5.14±0.43)%,P<0.05],凋亡相关蛋白cleaved-caspase3和cleaved-caspase9表达水平高于Con组(P<0.05)。A、B组HUVEC中细胞凋亡率分别为(32.57±3.17)%、(10.14±0.84)%,与A组比较,B组HUVEC中细胞凋亡率明显降低(P<0.05);且凋亡相关蛋白cleaved-caspase3和cleaved-caspase9表达水平均低于A组(P<0.05)。ox-LDL组与A组各检测指标比较差异均无统计学意义(P>0.05),见图1、2。
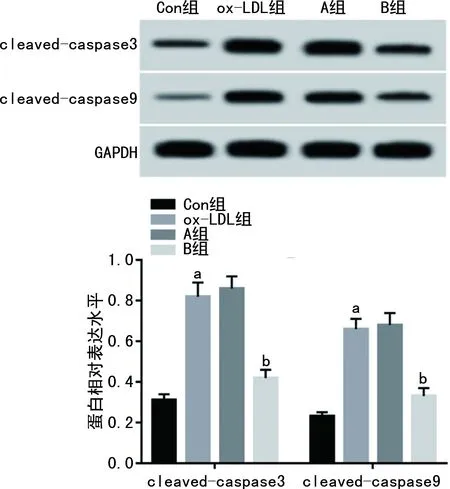
a:P<0.05,与Con组比较;b:P<0.05,与A组比较。
2.4 Circular RNA Interactome靶基因在线软件预测circ_0062389与miR-331-3p核苷酸序列的结合位点
Circular RNA Interactome靶基因在线软件预测显示,circ_0062389与miRNA-331-3p的核苷酸序列存在结合位点,见图3。双荧光素酶报告基因结果显示,共转染miRNA-331-3p mimics和WT-circ_0062389的HUVEC荧光素酶活性较共转染miRNA-NC和WT-circ_0062389的细胞明显降低(0.52±0.04vs.0.96±0.07,t=16.37,P<0.01),但共转染miRNA-331-3p mimics和MUT-circ_0062389的HUVEC荧光素酶活性与共转染miRNA-NC和MUT-circ_0062389的细胞比较差异无统计学意义(0.99±0.07vs.0.98±0.08,t=0.28,P=0.78)。同时,转染si-circ_0062389的HUVEC中miRNA-331-3p表达明显高于转染si-NC的细胞(3.01±0.28vs.1.03±0.06,t=20.74,P<0.01)。

图2 各组HUVEC细胞凋亡流式图
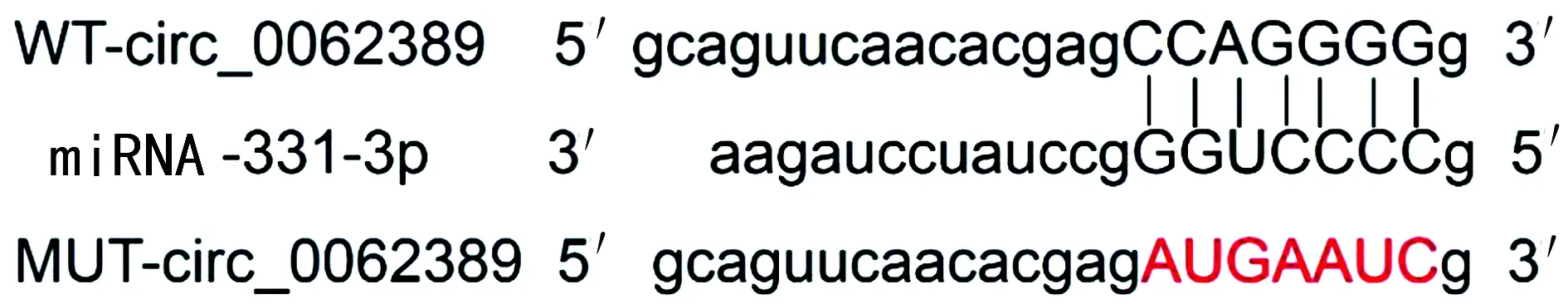
图3 circ_0062389的序列中含有与miRNA-331-3p互补的核苷酸序列
2.5 C、D组HUVEC细胞损伤相关指标比较
D组HUVEC中miRNA-331-3p表达高于C组细胞(3.79±0.31vs.1.00±0.00,t=27.00,P<0.01)。与C组比较,D组HUVEC中MDA水平降低(P<0.05),SOD和GSH-Px活性升高(P<0.05),细胞凋亡率及凋亡相关蛋白cleaved-caspase3和cleaved-caspase9表达水平均降低(P<0.05),见表2、图4。
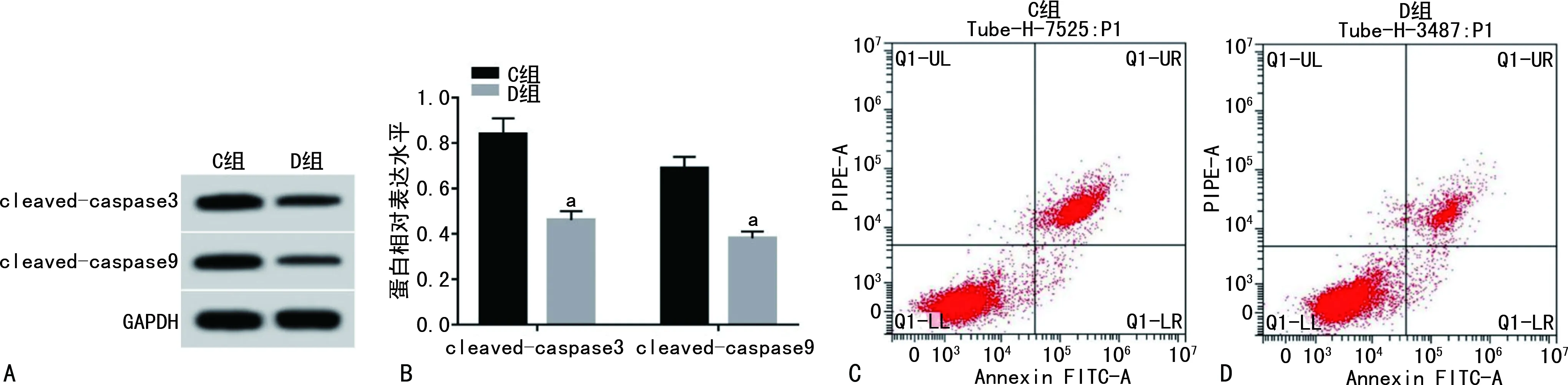
A:Western blot检测;B:蛋白相对表达水平柱状图;C、D:细胞凋亡流式图;a:P<0.05,与C组比较。
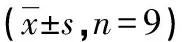
表2 C、D组HUVEC细胞损伤相关指标比较
2.6 E、F组HUVEC细胞损伤相关指标比较
F组HUVEC中miRNA-331-3p表达低于E组细胞(0.26±0.02vs.1.00±0.00,t=111.00,P<0.01)。与E组比较,F组HUVEC中miRNA-331-3p表达水平降低(P<0.05),MDA水平升高(P<0.05),SOD和GSH-Px活性降低(P<0.05),细胞凋亡率及凋亡相关蛋白cleaved-caspase3和cleaved-caspase9表达水平均升高(P<0.05),见图5、表3。
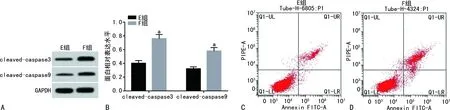
A:Western blot检测;B:蛋白相对表达水平柱状图;C、D:细胞凋亡流式图;a:P<0.05,与E组比较。
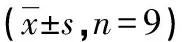
表3 E、F组HUVEC细胞损伤相关指标比较
3 讨 论
ox-LDL是重要的致病因子,其可诱导血管内皮细胞产生过度氧化应激反应及细胞凋亡,促进AS的发生、发展过程[8]。本研究显示,HUVEC经100 μg/mL ox-LDL干预24 h后,细胞中氧化应激指标MDA表达明显增加,SOD和GSH-Px活性明显降低,且细胞凋亡率升高,与相关报道结果一致[9],说明ox-LDL诱导HUVEC产生了氧化应激反应,且加剧了HUVEC凋亡,ox-LDL诱导的HUVEC损伤模型建立成功。
circRNA呈闭合环状结构,可通过竞争性结合miRNA,影响miRNA靶基因的表达,进而发挥生物学功能。研究显示,circRNA参与调控血管内皮细胞功能障碍,可作为减轻血管内皮细胞损伤的分子靶点。如PENG等[10]研究显示,circ-USP36可通过靶向miRNA-98-5p/VCAM1轴促进ox-LDL诱导的血管内皮细胞凋亡及炎性反应,减轻血管内皮细胞损伤,其有望成为治疗AS的分子靶点;QIN等[11]研究显示,circ_0003645的沉默可减轻ox-LDL诱导的血管内皮细胞凋亡及炎症损伤,对揭示AS的发病机制及治疗靶点的选择提供了新途径。探究影响AS血管内皮细胞损伤的分子机制可为其治疗提供新靶点。
circ_0062389是circRNA家族成员之一,可靶向miRNA-103a-3p/CCNE1轴促进非小细胞肺癌的发展进程,为非小细胞肺癌的治疗提供了新策略[12]。本研究结果显示,circ_0062389在ox-LDL诱导的HUVEC中表达升高,敲减其表达可明显减少ox-LDL诱导的HUVEC细胞凋亡,提示circ_0062389可能成为降低ox-LDL诱导的HUVEC细胞损伤的分子靶点。细胞凋亡受多种基因分子调控,其中caspase级联反应对细胞凋亡发挥重要调控作用[13]。caspase9是caspase级联反应的起始分子,再接受到上游凋亡信号后被活化,向下游传递凋亡信号。caspase3处于caspase级联反应的核心位置,其被活化后,执行细胞凋亡。本研究结果提示,circ_0062389可能通过间接抑制caspase级联反应来减少ox-LDL诱导的HUVEC凋亡。
ox-LDL引起的血管内皮细胞氧化应激是血管内皮细胞损伤的主要通路,抑制ox-LDL诱导的氧化应激可保护血管内皮细胞免受氧化损伤[14]。MDA是脂质过氧化产物之一,细胞中其水平越高,说明氧化应激反应越剧烈。SOD是机体内重要的抗氧化酶,其可清除氧自由基,减轻机体组织损伤。GSH-Px也是抗氧化酶,与SOD具有协同作用,对机体组织发挥保护作用。本研究显示,敲减circ_0062389通过降低ox-LDL诱导的HUVEC中MDA表达及提高SOD和GSH-Px活性减轻细胞氧化损伤。
为了进一步探究敲减circ_0062389抑制ox-LDL诱导的HUVEC氧化应激和凋亡的分子机制,本研究证实了circ_0062389可靶向结合并负调控miRNA-331-3p,这与本文ox-LDL促进HUVEC中circ_0062389的表达而抑制miRNA-331-3p表达的结果一致。有研究显示,miRNA-331-3p在阿尔茨海默病(Alzheimer′s disease,AD)患者血清中表达降低,且与AD患者简易智能精神状态量表(mini-mental state examination,MMSE)评分和血清促炎细胞因子的表达密切相关,是诊断AD的潜在生物标志物;过表达miRNA-331-3p可提高β-淀粉样蛋白(amyloid beta,Aβ)1-40诱导的神经母细胞瘤(SH-SY5Y)细胞活性,并抑制细胞炎性损伤,miRNA-331-3p具有潜在的神经保护作用[15]。本研究结果显示,miRNA-331-3p过表达明显减轻了ox-LDL诱导的HUVEC氧化应激水平,并减少了细胞凋亡,提示miRNA-331-3p可作为AS治疗的分子靶点。此外,本研究实验结果还显示,敲减miRNA-331-3p逆转敲减circ_0062389对ox-LDL诱导的HUVEC氧化应激及凋亡的抑制作用,进一步提示circ_0062389可能通过靶向负调控miRNA-331-3p来影响ox-LDL诱导的HUVEC氧化应激和凋亡,但其具体调控的miRNA-331-3p靶基因还有待进一步探究。
综上所述,ox-LDL促进HUVEC中circ_0062389的表达,而抑制miRNA-331-3p表达;circ_0062389可能通过靶向抑制miRNA-331-3p来促进ox-LDL诱导的HUVEC氧化应激及凋亡,其可能成为AS治疗的分子靶点。

