夏枯草提取物对子痫前期大鼠氧化应激损伤及AMPK/p62/Nrf2通路的影响*
刘宝峰,昝双江,骆伟舜,韩 梅
(1.天津市第四中心医院药剂科 300140;2.天津市小淀社区卫生服务中心内科 300251)
子痫前期(preeclampsia,PE)是特发于妊娠期的一种高血压疾病,患者出现血压升高、蛋白尿症状,且其肝、肾功能及胎盘功能发生障碍,极大威胁母婴生命安全,亦是导致死胎、孕产妇死亡的重要原因[1-2]。胎盘缺血缺氧是PE的一个主要特征,可导致炎症信号异常激活,促进氧自由基大量释放,最终引发母体全身氧化应激及胎盘组织脂质过氧化,造成母体高血压及胎儿发育受限,减轻氧化应激可有效防治PE[3-4]。腺苷酸活化蛋白激酶(adenylate-activated protein kinase,AMPK)是一种蛋白激酶,刺激其激活,可扩张血管,恢复PE患者胎盘血流灌注,缓解其缺血缺氧症状,还可上调下游核孔糖蛋白62(p62)、核因子E2相关因子2(nuclear factor E2-related factor2,Nrf2)信号分子表达,增强机体自噬与抗氧化活性,减轻氧化应激损伤,促进胎儿生长发育,改善PE症状[5-7],因而激活AMPK/p62/Nrf2信号是PE的一个有效治疗手段。夏枯草是广泛用于清热消炎、软坚散结、降火明目的一种常用中药,而夏枯草提取物(prunella vulgaris extracts,PVE)具有明显的清除自由基、消炎及抗氧化的功效,可增强抗氧化酶活性,减轻急性束缚诱发的小鼠氧化应激损伤,还可降低血压,改善老年高血压患者各种临床症状[8-9],但PVE是否可用于治疗PE及其对PE大鼠模型AMPK/p62/Nrf2通路的影响,目前尚未见确切报道,本文以不同剂量PVE干预处理PE模型大鼠,并对此进行探讨。
1 材料与方法
1.1 材料
1.1.1实验动物
SD大鼠150只(雌、雄各75只),生产许可SCXK(沪)2018-0004,雌性180~220 g,雄性260~300 g,均来自上海杰思捷实验动物有限公司,于天津市第四中心医院动物中心的屏障系统适应饲养,饲养房内温度22.5~25.5 ℃,相对湿度52%~57%,照明为12 h/12 h明暗循环光照,房内保持噪音小、通气良好。本研究通过天津市第四中心医院伦理委员会审批。
1.1.2主要试剂与仪器
(1)试剂:左旋硝基精氨酸甲酯(L-nitro arginine methyl ester,L-NAME,货号FT011014)购自上海梵态生物科技有限公司;夏枯草全草(批号20141005)购自西安天瑞生物技术有限公司;硫酸镁(批号20180125)、放射免疫沉淀法(radio immunopreci pitation assay,RIPA)裂解液(货号P0013B)购自上海碧云天生物技术有限公司;活体组织活性氧(reactive oxygen species,ROS)测定试剂盒(货号HL10016.4)购自上海哈灵生物科技有限公司;过氧化氢酶(catalase,CAT)活性测定试剂盒(货号ab83464)、丙二醛(malondialdehyde,MDA)检测试剂盒(货号ab238537)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白检测试剂盒(货号ab102536)、兔源Anti-三磷酸甘油醛脱氢酶(glyceyaldehyde-3-phosp-hate dehydrogenase,GAPDH)一抗(货号ab181602)、兔源Anti-AMPK一抗(货号)、兔源Anti-p-AMPK一抗(货号ab133448)、兔源Anti-p62一抗(货号ab109012)、兔源Anti-Nrf2一抗(货号ab31163)、羊抗兔二抗(ab150077)购自美国Abcam公司。(2)仪器:电子尾袖式血压计(型号HD-QB52)购自美国IITC公司;自动生化分析仪(型号Au1000)购自日本Olympus公司;精密电子天平(型号MS-TS)购自瑞士梅特勒-托利多公司;酶标仪(型号Power Wave XS)购自美国Bio-Tek公司;电泳仪(型号iniPROTEAN Tetra)购自美国Bio-Rad公司;一体式凝胶成像仪、转印电泳仪(型号WD-9413D、DYCZ-40D)均购自北京六一生物科技有限公司。
1.2 方法
1.2.1构建PE模型大鼠及分组给药
将雌、雄SD大鼠以1∶1比例合笼,次日早上检查,发现阴栓即可得到孕鼠,最终获取孕鼠72只,此时为妊娠1 d,取60只孕鼠于妊娠13 d皮下注射200 mg/kg[10]的L-NAME,每天注射1次,连续注射4次,然后测量大鼠血压,若升高30 mm Hg及以上即表明PE模型构建成功,将60只PE构建成功大鼠分为模型组、PVE低剂量(6 mg/kg)组、PVE中剂量(12 mg/kg)组、PVE高剂量(24 mg/kg)组、硫酸镁(30 mg/kg)组,每组12只。另取12只妊娠13 d大鼠皮下注射等剂量生理盐水,作为对照组。将夏枯草全草剪碎后,加入10倍量的蒸馏水煮沸后过滤、浓缩,得到生药浓度为1 g/mL的浓缩液,加入磷酸盐缓冲液(PBS)稀释,配制成浓度分别为0.6、1.2、2.4 mg/mL的药液[11],以PBS溶解硫酸镁,配制成浓度为3 mg/mL的药液[12],各药物干预组大鼠均以10 mL/kg的剂量灌胃给药,模型组与对照组大鼠灌胃10 mL/kg的PBS干预,于妊娠16 d开始每天1次,持续至妊娠21 d。
1.2.2大鼠妊娠晚期血压及24 h尿蛋白、血尿素氮(blood urea nitrogen,BUN)水平测定
以血压测试仪测量妊娠21 d大鼠收缩压、舒张压,并计算得出平均动脉压(mean arterial pressure,MAP)。以代谢笼收集妊娠21 d大鼠24 h内尿液,取少量尾静脉血,采用全自动生化分析仪测量24 h尿液中尿蛋白及尾静脉血中BUN水平。
1.2.3大鼠妊娠结局情况及标本收集
将妊娠21 d大鼠置于乙醚气体中麻醉,开腹,取出胎鼠,计数后,测量其体重,得到每组孕鼠平均子代数目与平均子代体重;然后找到胎盘,分离出后剪下约0.8 g,加入RIPA裂解液,剪碎后匀浆、离心,收集上清液获得蛋白样品液,通过BCA法进行蛋白定量后保存在-80 ℃冰箱中备用。
1.2.4大鼠胎盘组织ROS、CAT、MDA水平测定
取出1.2.3中的胎盘组织蛋白样品液,提前放入4 ℃冰箱中,解冻后每组各取0.15 mL,参照各自试剂盒说明书指导步骤测定其中ROS、CAT、MDA水平。
1.2.5Western blot检测大鼠胎盘组织Nrf2/血红素氧合酶-1(hemeoxygenase-1,HO-1)/醌氧化还原酶1(quinone oxidoreductase-1,NQO1)通路蛋白水平
取1.2.4中剩余的蛋白样品液,每组均上样20 μg总蛋白,经电泳后通过湿转转膜,以3%牛血清白蛋白封闭液孵育1.5 h后,以均稀释2 000倍的一抗溶液4 ℃条件下处理9 h,漂洗后以稀释1 000倍的二抗溶液室温处理1.5 h,以化学发光试剂显色,在凝胶成像仪中成像,通过Image J软件对图像中各蛋白条带完成灰度定量,使用GAPDH作内参,对目的蛋白与内参蛋白灰度值比值进行统计分析,即可得到各个蛋白的相对表达水平。
1.3 统计学处理
2 结 果
2.1 各组大鼠妊娠晚期MAP、24 h尿蛋白及BUN水平比较
与对照组比较,模型组大鼠妊娠晚期MAP、24 h尿蛋白及BUN水平明显升高(P<0.05);与模型组比较,PVE低、中、高剂量组及硫酸镁组大鼠妊娠晚期MAP、24 h尿蛋白及BUN水平均降低(P<0.05),且PVE各组呈剂量依赖性(P<0.05);与硫酸镁组比较,PVE高剂量组大鼠妊娠晚期MAP、24 h尿蛋白及BUN水平差异无统计学意义(P>0.05),见表1。
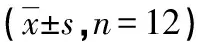
表1 各组大鼠妊娠晚期MAP、24 h尿蛋白及BUN水平比较
2.2 PVE对PE大鼠妊娠结局情况的影响
与对照组比较,模型组大鼠妊娠晚期平均子代数目、平均子代体重明显降低(P<0.05);与模型组比较,PVE低、中、高剂量组及硫酸镁组大鼠妊娠晚期平均子代数目、平均子代体重均升高(P<0.05),且PVE各组呈剂量依赖性(P<0.05);与硫酸镁组比较,PVE高剂量组大鼠妊娠晚期平均子代数目、平均子代体重差异无统计学意义(P>0.05),见表2。
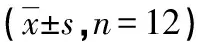
表2 各组大鼠妊娠晚期平均子代数目、平均子代体重比较
2.3 PVE对PE大鼠胎盘组织ROS水平的影响
与对照组比较,模型组大鼠胎盘组织ROS、MDA水平明显升高,CAT水平明显降低,差异均有统计学意义(P<0.05);与模型组比较,PVE低、中、高剂量组及硫酸镁组大鼠胎盘组织ROS、MDA水平均降低,CAT水平均升高,且PVE各组呈剂量依赖性,差异均有统计学意义(P<0.05);与硫酸镁组比较,PVE高剂量组大鼠胎盘组织ROS、MDA、CAT水平差异无统计学意义(P>0.05),见表3。
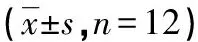
表3 各组大鼠胎盘组织ROS、CAT等水平比较
2.4 PVE对PE大鼠胎盘组织AMPK/p62/Nrf2通路相关蛋白表达的影响
与对照组比较,模型组大鼠胎盘组织p-AMPK/AMPK、p62及Nrf2蛋白表达水平明显降低(P<0.05);与模型组比较,PVE低、中、高剂量组及硫酸镁组大鼠胎盘组织p-AMPK/AMPK、p62及Nrf2蛋白表达水平均升高(P<0.05),且PVE各组呈剂量依赖性(P<0.05);与硫酸镁组比较,PVE高剂量组大鼠胎盘组织p-AMPK/AMPK、p62及Nrf2蛋白表达水平差异无统计学意义(P>0.05),见图1、表4。
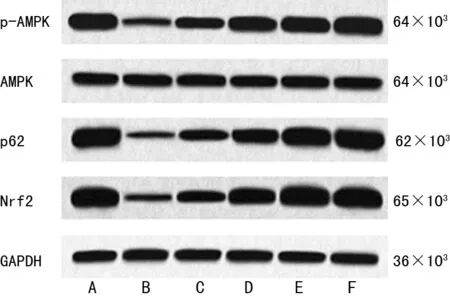
A:对照组;B:模型组;C:PVE低剂量组;D:PVE中剂量组;E:PVE高剂量组;F:硫酸镁组。
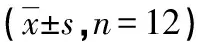
表4 各组大鼠胎盘组织p-AMPK/AMPK、p62及Nrf2蛋白相对表达水平比较
3 讨 论
PE不仅可损害母体肝、肾功能,若病情未能有效控制,还可诱发脑出血、代谢紊乱、早产等各种并发症,并明显增加产妇及新生儿的死亡,虽然近年来医疗科技进展迅速,但其发病机制复杂,目前仍无特别安全有效的防治措施,因而PE一直是学者亟待解决的临床难点和热点[13-14]。本文采用皮下注射L-NAME的方法诱导建立PE大鼠模型,结果显示,L-NAME可诱导ROS大量产生释放,引发严重的氧化应激反应,并导致孕鼠出现高血压及蛋白尿症状,危害胎鼠生长发育,使大鼠平均子代数目及平均子代体重降低,妊娠晚期MAP、24 h尿蛋白及BUN水平升高。本研究结果显示,皮下注射L-NAME可较全面准确的模拟PE病理症状,本实验模型构建成功。
研究发现,PE患者机体抗氧化活性减弱,氧化应激增强,降低氧自由基水平,可抑制氧化应激发生及进展,从而减轻胎盘组织损伤,改善PE症状[15-16]。夏枯草作为一种药食同源植物,能清肝明目、降火祛瘀、散结消肿,在临床中得到了广泛应用,不仅可抑制小胶质细胞活化引发的神经炎症,减轻氧化应激反应,在临床中通过抗炎及抗氧化活性而用于阿尔茨海默病、桥本甲状腺炎等疾病的治疗,还可明显降低老年高血压患者血压,缓解其临床症状[8-9,17-18]。邓静等[19]研究表明,夏枯草对酒精诱导的肝损伤大鼠具有很好的保护作用,因而可推测PVE可能对PE具有较好的治疗作用。本实验以不同剂量PVE干预处理PE模型大鼠,可降低胎盘组织ROS及MDA水平,升高胎盘组织CAT水平,减轻胎盘氧化应激反应,降低妊娠大鼠血压,并改善大鼠蛋白尿症状,最终提高其平均子代数目及平均子代体重。本研究结果表明,PVE具有良好的抗氧化作用,能明显抑制ROS产生释放,增强PE大鼠抗氧化水平,降低胎盘氧化应激损伤,保证胎鼠的正常生长发育,提升其生存率,且随PVE剂量升高而作用增强。
AMPK/p62/Nrf2是机体调控氧化应激、细胞代谢与凋亡的重要信号通路,广泛参与介导PE的发病及病情进展过程,刺激AMPK磷酸化,可促进下游Nrf2、p62蛋白分子的表达,明显抑制氧自由基的产生,增强组织细胞抗氧化活性,减轻过氧化氢诱导的滋养层细胞氧化应激损伤,降低母体血压,修复胎盘功能,保证胎儿正常发育生长,改善PE临床症状[5-7,20-21],因而,AMPK/p62/Nrf2信号可作为PE的一个重要治疗靶点。本研究结果显示,PE模型大鼠胎盘组织p-AMPK/AMPK、p62及Nrf2蛋白表达水平明显降低,经PVE干预处理后,其表达水平均升高,且呈剂量依赖性,表明AMPK/p62/Nrf2通路参与介导PE的病理过程,PVE可刺激其激活,减轻孕鼠氧化应激损伤,促使胎鼠发育及存活,并改善PE症状。
综上所述,PVE可增强AMPK磷酸化,上调p62及Nrf2蛋白表达,降低氧自由基水平,提升内源性抗氧化活性,减轻PE大鼠胎盘组织氧化应激损伤,降低其血压,减轻蛋白尿症状,改善孕鼠胎盘功能,提升其子代生存率,减少不良妊娠结局发生,促进AMPK/p62/Nrf2信号途径传导可能是其发挥上述药理功效的分子机制。本研究证实了PVE对PE大鼠具有很好的治疗作用,是本研究的创新点,为PE的临床治疗提供了新的候选药物,但本文关于其药理机制的研究还不全面,后续还会进行回复实验进行深入研讨。

