丝胶通过影响自噬和氧化应激发挥保护STZ致胰岛素瘤细胞损伤的作用
胡万祥,李金尧,李雨欣,韩思雨,程露阳,陈志宏
(承德医学院基础医学院,河北承德 067000)
自噬在2型糖尿病中发挥着重要作用[1]。在自噬的3种方式(微自噬、分子伴侣介导的自噬和巨自噬)中,巨自噬被认为具有保护胰岛素抵抗和胰岛β细胞功能障碍的作用[2,3]。同时,巨自噬可特异性作用于线粒体,通过清除功能障碍的线粒体调控线粒体的质量和功能[4]。当前,针对线粒体治疗药物的研究越来越受到重视。本课题组前期研究发现,丝胶(蚕茧提取物)有良好的抗糖尿病功效,然而丝胶具有的抗糖尿病功效是否与调控自噬和线粒体作用有关尚不明确,对此,本研究进行了进一步的探讨。
1 材料与方法
1.1 实验用细胞、培养及分组处置
1.1.1 细胞 大鼠胰岛素瘤细胞(INS-1细胞,CL-0368),武汉普诺赛生物技术有限公司。
1.1.2 INS-1细胞培养 完全培养基的构成:85% RPMI-1640基础培养基+10% FBS+5%双抗+50μmol/L β-巯基乙醇。培养条件:37℃,5%二氧化碳培养箱。
1.1.3 INS-1细胞分组及处置 将INS-1细胞随机分为A、B、C、D、E五组。A组为正常组,将INS-1细胞按上述条件培养24h;B组为链脲佐菌素(streptozotocin,STZ)致损伤组,向INS-1细胞完全培养基中加入含10mmol/L的STZ,培养24h;C组,在B组细胞的培养基中加入低剂量的丝胶(150μg/mL),培养24h;D组,在B组细胞的培养基中加入中剂量的丝胶(300μg/mL),培养24h;E组,在B组细胞的培养基中加入高剂量的丝胶(600μg/mL),培养24h。
1.2 检测INS-1细胞LC3B-II/LC3B-I、SIRT1、ATG5、BECLIN1、PINK1的表达
1.2.1 蛋白 采用免疫蛋白印迹法。常规提取INS-1细胞总蛋白,定量后确定上样量(30~60μg),SDS-PAGE凝胶电泳后转膜(稳流200mA,转膜时间30min~2h),脱脂奶粉封闭,一抗室温孵育2h,二抗室温孵育1h,Super ECL Plus超敏发光液显影,分别测定指标蛋白条带与相应β-actin条带的灰度值,使用Image J软件分析二者的比值,作为各指标蛋白的相对表达水平。各检测指标的凝胶浓度、封闭奶粉浓度,一抗和二抗稀释浓度见表1:
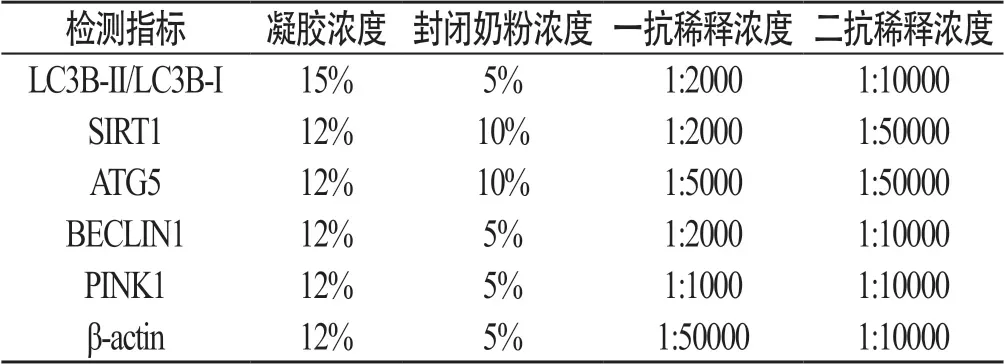
表1 各检测指标的凝胶浓度、封闭奶粉浓度,一抗和二抗稀释浓度
1.2.2 mRNA 按照试剂盒的说明进行操作提取样品的RNA,确定无污染、无降解后逆转为cDNA,扩增后进行Realtime PCR反应,每个指标重复3次,得到各检测指标mRNA表达的CT值后进行定量分析,采用公式2-△△Ct法。各检测指标的引物序列(引物购于上海生工工程有限公司)和扩增条件分别见表2,表3:
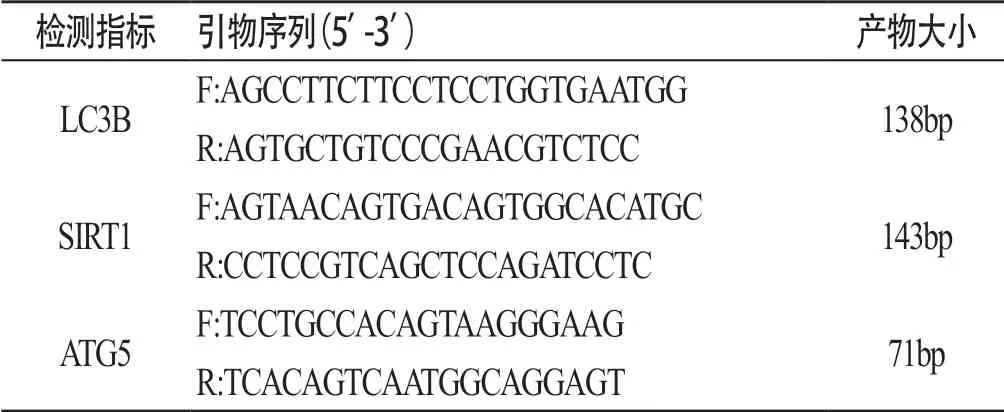
表2 各检测指标的引物序列和产物大小

检测指标 引物序列(5’-3’) 产物大小BECLIN1 F:TCAAGATCCTGGACCGAGTGACC 85bp R:TCCTGGCTCTCTCCTGGTTTCG PINK1 F:CACGACGCTCAACTTGGCTACTC 137bp R:ACGCACTCCTCGGCACCATAC β-actin F:GGAGATTACTGCCCTGGCTCCTA -R:GACTCATCGTACTCCTGCTTGCTG

表3 PCR反应程序
1.3 检测INS-1细胞活性氧(reactive oxygen species,ROS)的含量
采用DCFH-DA ROS荧光探针检测:INS-1细胞按照上述条件培养后,按照试剂盒说明进行操作,荧光显微镜下观察、拍照,每次选取3个视野,重复3次。应用Image J软件分析总的荧光强度,作为ROS含量的相对值。
1.4 统计学分析
应用SPSS 23.0统计学软件处理所得数据,多组间数据的比较采用单因素方差分析,有统计学差异后的组间两两比较采用LSD-t检验,检验水准α=0.05。实验所得数据均以)表示。
2 结果
2.1 丝胶可提高STZ致损伤INS-1细胞LC3B-II/I蛋白和LC3B mRNA的表达
比较各组INS-1细胞LC3B-II/I蛋白和LC3B mRNA的表达:B组较A组明显降低(P<0.05);C组、D组、E组均较B组明显升高(P<0.05),且3组细胞的表达水平依次为E组>D组>C组,差异有统计学意义(P<0.05)。见表4、图1、图2。
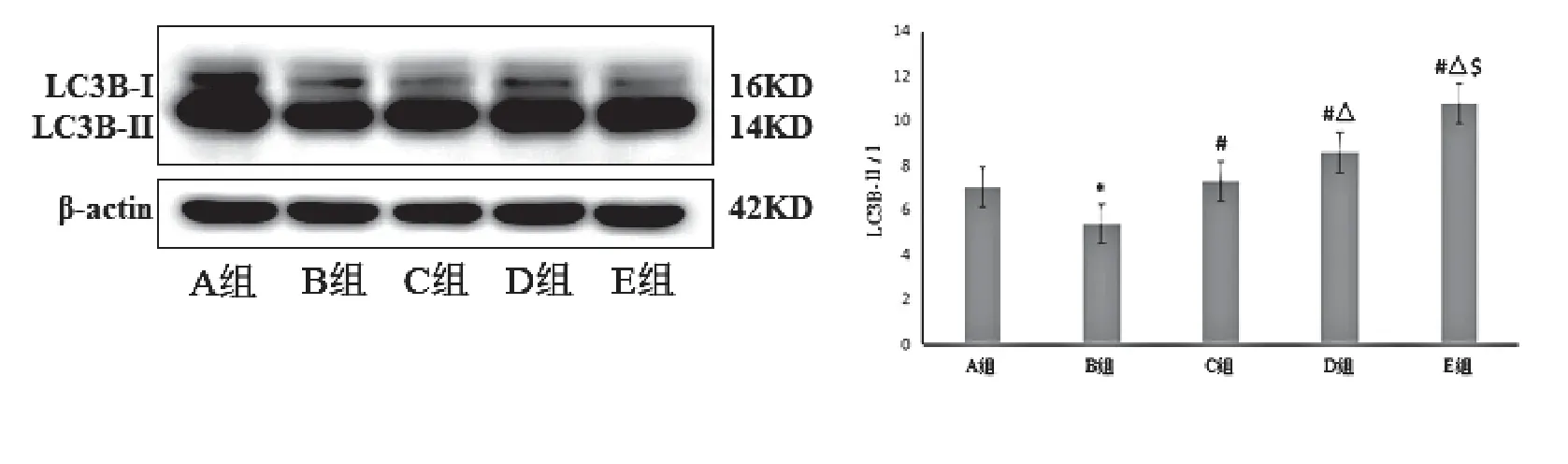
图1 各组INS-1细胞LC3B-II/I蛋白
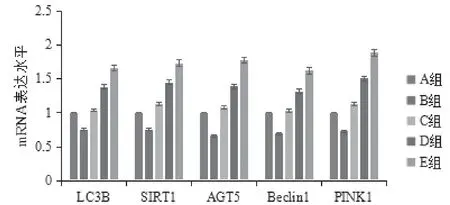
图2 各组INS-1细胞各检测指标mRNA的表达
表4 各指标蛋白和mRNA的表达(

表4 各指标蛋白和mRNA的表达(
与A组比较:*P<0.05;与B组比较:#P<0.05;与C组比较:△P<0.05;与D组比较:$P<0.05
组别 LC3B-II/I/LC3B SIRT1 AGT5 BECLIN1 PINK1蛋白A组 7.031±0.686 0.805±0.125 0.425±0.041 0.769±0.093 1.903±0.163 B组 5.374±0.858* 0.498±0.135* 0.314±0.019* 0.598±0.008* 0.982±0.108*C组 7.307±0.374# 0.736±0.136# 0.422±0.019# 0.892±0.034# 1.334±0.124#D组 8.568±0.688#△ 1.030±0.123#△ 0.524±0.057#△ 1.051±0.024#△ 1.702±0.153#△E组 10.766±0.605#△$ 1.287±0.127#△$ 0.634±0.056#△$ 1.187±0.066#△$ 2.080±0.225#△$mRNA A组 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 B组 0.756±0.087* 0.753±0.016* 0.667±0.067* 0.700±0.091* 0.729±0.052*C组 1.040±0.092# 1.114±0.093# 1.085±0.060# 1.028±0.049# 1.139±0.185#D组 1.387±0.160#△ 1.456±0.128#△ 1.394±0.049#△ 1.323±0.105#△ 1.509±0.180#△E组 1.667±0.086#△$ 1.738±0.103#△$ 1.782±0.220#△$ 1.625±0.176#△$ 1.894±0.129#△$
2.2 丝胶可提高STZ致损伤INS-1细胞SIRT1蛋白和mRNA的表达
比较各组INS-1细胞SIRT1蛋白和SIRT1 mRNA的表达:B组较A组明显降低(P<0.05);C组、D组、E组均较B组明显升高(P<0.05),且3组细胞的表达水平依次为E组>D组>C组,差异有统计学意义(P<0.05)。见表4,图2,图3。
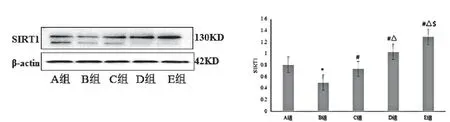
图3 各组INS-1细胞SIRT1蛋白的表达
2.3 丝胶可提高STZ致损伤INS-1细胞AGT5蛋白和mRNA的表达
比较各组INS-1细胞AGT5蛋白和AGT5 mRNA的表达:B组较A组明显降低(P<0.05);C组、D组、E组均较B组明显升高(P<0.05),且3组细胞的表达水平依次为E组>D组>C组,差异有统计学意义(P<0.05)。见表4,图2,图4。

图4 各组INS-1细胞AGT5蛋白的表达
2.4 丝胶可提高STZ致损伤INS-1细胞BECLIN1蛋白和mRNA的表达
比较各组INS-1细胞BECLIN1蛋白和BECLIN1 mRNA的表达:B组较A组明显降低(P<0.05);C组、D组、E组均较B组明显升高(P<0.05),且3组细胞的表达水平依次为E组>D组>C组,差异有统计学意义(P<0.05)。见表4、图2、图5。
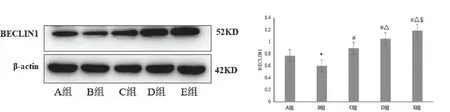
图5 各组INS-1细胞BECLIN1蛋白的表达
2.5 丝胶可提高STZ致损伤INS-1细胞PINK1蛋白和mRNA的表达
比较各组INS-1细胞PINK1蛋白和PINK1 mRNA的表达:B组较A组明显降低(P<0.05);C组、D组、E组均较B组明显升高(P<0.05),且3组细胞的表达水平依次为E组>D组>C组,差异有统计学意义(P<0.05)。见表4、图2、图6。

图6 各组INS-1细胞PENK1蛋白的表达
2.6 丝胶可降低STZ致损伤INS-1细胞ROS的含量
B组INS-1细胞ROS含量为(5.770±0.724),较A组(1.034±0.035)明显降低(P<0.05)。C组(3.622±0.636)、D组(2.385±0.523)、E组(1.652±0.664)INS-1细胞ROS含量,较B组明显降低(P<0.05);并且,3组细胞ROS含量依次为E组<D组<C组,差异有统计学意义(P<0.05)。如图7:

图7 各组INS-1细胞ROS检测情况(×10)
3 讨论
我国自古就对蚕茧的应用进行了探索,但仅针对蚕茧的组分——丝素。近年来,针对占蚕茧25%左右的丝胶蛋白(也称丝胶)进行了较多研究,发现丝胶不仅具有良好的生物相容性,还具有抗氧化、抗炎的功效,并可用作生物材料等[5]。当今,糖尿病的病因尚未完全阐述清楚,专家学者们认为其与饮食、精神神经因素、炎症反应、遗传因素等有关。本课题组前期在整体和细胞水平上发现,丝胶具有较好的抗糖尿病作用,结合研究发现的丝胶的生物学作用,进一步探究了丝胶抗糖尿病的作用机制,以期为临床糖尿病治疗提供新思路。
本研究以大鼠胰岛素瘤INS-1细胞为研究对象,用STZ模拟糖尿病时的β细胞损伤,并给予低、中、高三种不同剂量的丝胶进行干预。结果显示,STZ致损伤的β细胞ROS水平明显升高,自噬相关指标的表达水平明显降低,丝胶干预可显著逆转上述指标的变化,且600μg/mL高剂量丝胶的逆转效果最强。本研究一方面可部分揭示丝胶抗糖尿病的作用机制,另一方面为丝胶的生物学作用研究提供了数据支持。
胰岛β细胞中抗氧化酶的含量和活性均相对较低,因而对ROS介导的氧化应激损害非常敏感,ROS可导致β细胞的直接和间接损伤[6]。同时,ROS还可以通过激活核因子Kappa-B、p38丝裂原活化蛋白激酶、己糖胺等信号通路,抑制胰岛素刺激的酪氨酸磷酸化,从而降低胰岛素的生物效应,导致胰岛素抵抗[7-9]。自噬在维持线粒体、内质网等细胞器的功能方面发挥重要作用,进而维持胰岛β细胞的稳态[10]。当自噬缺陷或自噬水平降低时,可引起β细胞功能失调。另外,自噬水平降低的β细胞对内质网应激的适应性降低,可加重β细胞细胞损伤,甚至导致β细胞衰竭,造成恶性循环[3]。可见,氧化应激损伤和自噬缺陷均在2型糖尿病的发病过程占有一定地位。
本研究中,丝胶可降低STZ致损伤INS-1细胞ROS的水平,提高自噬相关指标LC3B-II/LC3B-I、SIRT1、ATG5、BECLIN1、PINK1等的表达水平,说明丝胶可减轻氧化应激对细胞的直接和间接损伤;另外,丝胶可以改善细胞自噬水平的降低,进而通过维持细胞稳态、提高对内质网应激的适应性,以减轻细胞损伤。就此提示,丝胶确有保护STZ致INS-1细胞损伤的作用,且其保护机制与丝胶减轻氧化应激和增强自噬作用的功能有关。
另外,关于丝胶对氧化应激和自噬水平相互关系的影响尚未可知,且丝胶增强自噬作用进而改善线粒体功能的关系仍不明确。后续,本课题组将针对上述内容进行研究,进而为开发针对线粒体治疗的药物提供实验数据。

