铜催化噁唑硼烷一锅法氢转移:芳香醛的还原胺化反应研究
GIMAH AMY SAMBOLLAH, 熊万金, 李 雷, 伍建军, 唐鋆磊, 周太刚*
(1.西南石油大学 化学化工学院,四川 成都 610500; 2.天府新能源研究院,四川 成都 610299)
胺是一种重要的化合物,存在于在精细化工以及制药工业中,广泛用作农用化学品、添加剂和染料。如何简单高效且绿色环保的合成胺类化合物一直是近代有机合成化学研究的重点。近年来,氢转移还原由于其反应条件温和、操作简单、原子经济性高、对实验设备的要求低等优点而成为有机合成领域的研究热点,如Corey-Bakshi-Shibata(CBS)还原反应、Brown硼氢化反应和Fukuyama还原反应[1-3]。氢转移还原反应常用的氢转移试剂有HCOOH、Hantzsch酯、NaBH4和噁唑硼烷络合物等[4-9]。
传统合成胺化合物通常采用分步法完成,还原亚胺为其中最常见的方法。该方法首先通过羰基化合物或醛与胺缩合生成亚胺,然后通过亚胺还原得到不同的胺类化合物。尽管分步法能有效地应用于胺的合成,但其操作步骤多,过程繁琐。因此,如何通过醛和胺一锅法制备二级胺成为了目前的研究重点[10-11]。如Yang课题组[12]报道了用三乙基硅烷作氢转移试剂,三氯化铟被用作添加剂,由InCl3和Et3SiH结合原位形成的[In-H]被用作不对称氢转移试剂,实现醛/酮的还原胺化得到二级胺。Zhang课题组[13]选择Hantzsch酯作为氢转移试剂,发展了一种由Au/Ag复合金属盐催化剂催化醛的还原胺化合成二级胺。Tibor Soós等[14]报道了三种硼的非金属催化剂,催化醛的还原胺化得到仲胺。Cristiano Bolchi课题组[15]以硼氢化钠作为氢转移试剂实现醛的还原胺化合成了二级胺。Markus Hölscher课题组[16]设计了一种双氮配体与铱配位作催化剂,甲酸为还原试剂,催化醛的还原胺化合成二级胺。目前氢转移方法仍存在氢源昂贵、需使用特殊催化剂等缺点,因此寻找廉价催化剂和氢源成为了一锅法氢转移还原的研究方向。
本课题组基于CBS还原机理和反应优点,将噁唑硼烷体系应用于氢转移还原制胺类化合物,并且发展了廉价金属催化剂和噁唑硼烷形成的催化还原体系。2019年,课题组报道了硫酸铁催化1,3,2-噁唑硼烷络合物氢转移还原硝基化合物合成胺类化合物[17]。此后,课题组又相继发展了铜催化恶唑硼烷络合物用于异喹啉[18]和N-杂环芳烃[19]的转移加氢反应(Chart 1a)。最近,课题组还报道了铜催化腈基转移加氢制伯胺硼烷和仲胺[8](Chart 1b)。2021年,课题组报道了首先通过胺与醛生成亚胺,然后通过铜催化噁唑硼烷氢转移还原亚胺化合物制备二级胺[9](Chart 1c)。通过胺与醛先生成亚胺再生成二级胺,需要两步,并且亚胺容易水解。
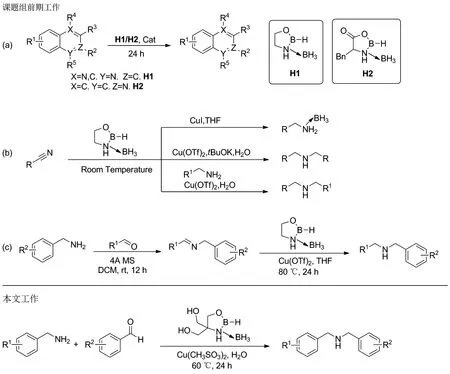
Chart 1
经过探索,本文实现了铜催化噁唑硼烷一锅法氢转移还原胺和醛的胺化还原(Chart 1, Scheme 1)。该方法操作简便、反应条件温和、原子利用率高且经济环保。

Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker AVANCE Ⅲ HD-400/600 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标)。
硼烷四氢呋喃络合物(1 M),阿达玛斯试剂;铜催化剂(分析纯),阿法埃莎试剂或阿达玛斯试剂;芳香醛类化合物(分析纯),阿达玛斯试剂或百灵威试剂;胺类化合物(分析纯),阿达玛斯试剂或阿拉丁试剂;其余所用试剂均为分析纯。
1.2 3的合成通法
氩气环境下,将三羟甲基氨基甲烷(121.1 mg, 1.0 mmol)加入到装有磁子的干燥的Schlenk管中,氩气置换3次以上。冰浴下缓慢加入BH3·THF(2 mL, 2.0 mmol, 1 mol/L四氢呋喃溶液),随后置于室温反应12 h。反应结束后,减压除去溶剂即得1,3,2-噁唑硼烷络合物,此即反应的氢源供体。
氩气保护下加入胺(0.5 mmol)、醛(0.5 mmol)、甲磺酸铜(20 mol/mol)和水(2 mL),于60 ℃下反应24 h。反应结束后,反应溶液冷却至室温,用乙酸乙酯萃取3次,合并有机相,用饱和食盐水洗涤,经无水硫酸钠干燥,减压浓缩除去溶剂,残留物通过硅胶柱层析(洗脱剂:石油醚∶乙酸乙酯=3∶1~1∶1,V∶V)纯化得到目标化合物3。
二苄胺(3a): 黄色油状液体,产率75%, 74 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.42~7.32(m, 8H), 7.31~7.27(m, 2H), 3.84(s, 4H), 1.81(brs, 1H)。核磁数据与文献[8]报道值一致。
N-(4-甲基苄基)苄胺(3b): 黄色油状液体,产率80%, 85 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.37~7.30(m, 4H), 7.24(d,J=7.8 Hz, 3H), 7.14(d,J=7.8 Hz, 2H), 3.80(s, 2H), 3.78(s, 2H), 2.33(s, 3H), 1.79(brs, 1H)。核磁数据与文献[8]报道值一致。
N-(4-甲氧基苄基)苄胺(3c): 无色油状液体,产率71%, 81 mg;1H NMR(400 MHz, Chloroform-d)δ: 7.35~7.28(m, 4H), 7.28~7.20(m, 3H), 6.85(d,J=8.6 Hz, 2H), 3.77(d,J=2.1 Hz, 5H), 3.72(s, 2H), 1.75(s, 1H)。核磁数据与文献[8]报道值一致。
N-(4-三氟甲基苄基)苄胺(3d): 黄色油状液体,产率62%, 82 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.51(d,J=7.9 Hz, 2H), 7.39(d,J=7.9 Hz, 2H), 7.26(t,J=2.8 Hz, 4H), 7.19(dt,J=10.0 Hz, 4.9 Hz, 1H), 3.79(s, 2H), 3.73(s, 2H), 1.60(s, 1H)。核磁数据与文献[8]报道值一致。
N-(4-溴苄基)苄胺(3e): 黄色油状液体,产率65%, 90 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.57(d,J=7.8 Hz, 1H), 7.44~7.35(m, 4H), 7.32~7.27(m, 3H), 7.15(t,J=7.6 Hz, 1H), 3.91(s, 2H), 3.83(s, 2H), 1.77(brs, 1H)。核磁数据与文献[20]报道值一致。
N-(4-氟苄基)苄胺(3f): 无色油状液体,产率79%, 85 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.41~7.29(m, 7H), 7.07~6.99(m, 2H), 3.82(s, 2H),3.80(s, 2H), 1.71(brs, 1H)。核磁数据与文献[8]报道值一致。
N-(3-甲基苄基)苄胺(3g): 黄色油状液体,产率67%, 71 mg;1H NMR(400 MHz, Chloroform-d)δ: 7.36~7.20(m, 5H), 7.17(dd,J=9.1 Hz, 2.5 Hz, 1H), 7.13~7.03(m, 3H), 3.76(s, 2H), 3.69(s, 2H), 2.23(s, 3H), 1.53(s, 1H)。核磁数据与文献[21]报道值一致。
N-(3-氟苄基)苄胺(3h): 无色油状液体,产率73%, 78 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.44(d,J=4.3 Hz, 4H), 7.39~7.34(m, 2H), 7.22~7.15(m, 2H), 7.04(td,J=10.1 Hz, 8.0 Hz, 2.7 Hz, 1H), 3.90(s, 4H), 1.81(brs, 1H)。核磁数据与文献[8]报道值一致。
N-(3-溴苄基)苄胺(3i): 黄色油状液体,产率60%, 83 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.44~7.31(m, 5H),7.29(d,J=6.6 Hz, 2H),7.18(d,J=3.3 Hz, 3H),3.88(s, 2H),3.81(s, 2H), 1.61(brs, 1H)。核磁数据与文献[20]报道值一致。
N-(2-甲基苄基)苄胺(3j): 无色油状液体,产率60%, 63 mg;1H NMR(400 MHz, Chloroform-d)δ: 7.44~7.35(m, 5H), 7.34~7.28(m, 1H), 7.27~7.18(m, 3H), 3.91(s, 2H), 3.84(s, 2H), 2.38(s, 3H), 1.67(s, 1H)。核磁数据与文献[8]报道值一致。
N-(2-溴苄基)苄胺(3k): 黄色油状液体,产率55%, 76 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.55(dd,J=8.0 Hz, 1.3 Hz, 2H),7.35(td,J=8.1 Hz, 1.6 Hz, 5H), 7.16(dd,J=14.9 Hz, 7.6, 1.8 Hz, 2H), 3.89(s, 2H), 3.81(s, 2H), 1.69(brs, 1H)。核磁数据与文献[22]报道值一致。
N-(2-氟苄基)苄胺(3l): 无色油状液体,产率69%, 74 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.46~7.34(m, 5H), 7.30(q,J=3.3 Hz, 2.1 Hz, 2H), 7.16(t,J=7.5 Hz, 1H), 7.09(dd,J=10.1 Hz, 8.3 Hz, 1H),3.92(s, 2H), 3.86(s, 2H), 0.94(brs, 1H)。核磁数据与文献[8]报道值一致。
N-(苯甲基)-2-噻吩甲胺(3m): 无色油状液体,产率59%, 60 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.32~7.30(m, 3H),7.22(dd,J=15.5 Hz, 5.2 Hz, 1.4 Hz, 2H),6.93(dd,J=5.0 Hz, 3.4 Hz, 1H),6.90(dd,J=3.4, 1.1 Hz, 1H),3.97(d,J=0.9 Hz, 2H),3.81(s, 2H), 1.61(brs, 1H)。核磁数据与文献[8]报道值一致。
N-(苯甲基)-2-吡啶甲胺(3n): 无色油状液体,产率45%, 45 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.41~7.31(m, 5H),7.28(s, 1H),7.18(q,J=2.7 Hz, 3H),3.88(s, 2H), 3.81(s, 2H), 1.61(brs, 1H)。核磁数据与文献[14]报道值一致。
N-(4-甲氧基苄基)苄胺(3o): 无色油状液体,产率73%, 83 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.37~7.28(m, 4H), 7.24~7.19(m, 3H), 6.92~6.80(m, 2H), 3.74(d,J=2.1 Hz, 5H), 3.72(s, 2H), 1.78(brs, 1H)。核磁数据与文献[8]报道值一致。
N-(4-氯苄基)苄胺(3p): 无色油状液体,产率68%, 79 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.24(d,J=5.1 Hz, 3H), 7.22~7.19(m, 4H), 7.18(d,J=8.3 Hz, 2H), 3.70(s, 2H), 3.68(s, 2H), 1.70(brs, 1H)。核磁数据与文献[8]报道值一致。
N-(3-氟苄基)苄胺(3q): 无色油状液体,产率58%, 62 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.43~7.30(m, 7H), 7.08~6.99(m, 2H), 3.82(s, 2H), 3.80(s, 2H), 1.71(brs, 1H)。核磁数据与文献[8]报道值一致。
N-(3-氯苄基)苄胺(3r): 无色油状液体,产率56%, 65 mg;1H NMR(600 MHz, Chloroform-d)δ: 7.33(d,J=5.1 Hz, 4H), 7.30~7.27(m, 5H), 3.79(s, 2H), 3.78(s, 2H), 1.63(s, 1H)。核磁数据与文献[8]报道值一致。
N-(2-氯苄基)苄胺(3s): 无色油状液体,产率51%, 59 mg;1H NMR(400 MHz, Chloroform-d)δ: 7.43~7.36(m, 5H), 7.34~7.25(m, 4H), 3.85(s, 2H), 3.84(s, 2H), 1.68(s, 1H)。核磁数据与文献[8]报道值一致。
N-(2-氟苄基)苄胺(3t): 无色油状液体,收率45%, 49 mg;1H NMR(400 MHz, Chloroform-d)δ: 7.45~7.34(m, 5H), 7.29(m, 2H), 7.14(t,J=7.4 Hz, 1H), 7.09~7.03(m, 1H), 3.91(s, 2H), 3.85(s, 2H), 1.70(s, 1H)。核磁数据与文献[8]报道值一致。
2 结果与讨论
2.1 反应条件的优化
以苄胺1a和对甲基苯甲醛2b作为模板底物,对一锅法氢转移还原胺化进行条件优化,考察了氢源前驱体、催化剂、溶剂、反应温度等因素对反应的影响。以下产率为气相色谱产率。
(1)氢源前驱体
首先考察了不同氢源前驱体对一锅法氢转移还原胺化反应的影响(表1)。以氢源前驱体(1.0 mmol)和BH3·THF(2.0 mmol)生成的1,3,2-噁唑硼烷络合物(2.0 equiv.)为氢源,以三氟甲磺酸铜(20 mol/mol)为催化剂,水(2 mL)为溶剂,60 ℃下反应24 h。结果显示,无氢源前驱体时无产物生成,说明氢源前驱体对该反应是至关重要。当使用3-氨基-2,2-二甲基丙醇(HSP 2)作为氢源前驱体时,无产物生成。当选用HSP 1、HSP 3-9作为氢源前驱体时,能够生成目标产物,其中使用三羟甲基氨基甲烷(HSP 8, Chart 2)作为氢源前驱体时产率最高,达到60%。因此,选用HSP 8作为氢源前驱体进行后续条件筛选。

表1 氢源前驱体对反应的影响
(2)催化剂
其次,在完成了氢源前驱体的筛选后,设计了一系列实验来考察铜催化剂对一锅法氢转移还原胺化反应的影响(表2)。以三羟甲基氨基甲烷(1.0 mmol)和BH3·THF(2.0 mmol)生成的1,3,2-噁唑硼烷络合物(2.0 equiv.)为氢源,水(2 mL)为溶剂,60 ℃下反应24 h。结果显示,当不加入催化剂时,无反应发生,说明催化剂对该反应至关重要。在反应中加入不同的铜催化剂(B~K)时,均能得到目标产物。其中CuSO4·5H2O(B)或Cu(CH3CN)4BF4(D)作为催化剂时,反应效果最差。当使用Cu(CH3SO3)2作为催化剂时,产率最高,达到83%。因此选用20 mol/mol的Cu(CH3SO3)2催化剂进行后续条件筛选。

表2 催化剂对反应的影响
(3)溶剂
基于氢源前驱体和催化剂对一锅法氢转移还原胺化反应的影响,接着考察了5种不同溶剂对反应的影响(表3)。以三羟甲基氨基甲烷(1.0 mmol)和BH3·THF(2.0 mmol)生成的1,3,2-噁唑硼烷络合物(2.0 equiv.)为氢源,以甲磺酸铜(20 mol/mol)为催化剂,60 ℃下反应24 h。结果显示,水作为反应溶剂时效果最好,使用其它有机溶剂时目标产物产率反而降低。因此该反应仍选用水为溶剂。

表3 溶剂对反应的影响
(4)温度
最后,考察了温度对一锅法氢转移还原胺化反应的影响(表4)。以三羟甲基氨基甲烷(1.0 mmol)和BH3·THF(2.0 mmol)生成的1,3,2-噁唑硼烷络合物(2.0 equiv.)为氢源,以甲磺酸铜(20 mol/mol)为催化剂,水(2 mL)为溶剂,反应24 h。结果显示,在20 ℃时,反应不发生。当温度升高到40 ℃时,有目标产物生成并且产率达到72%。继续升高温度至60 ℃时,目标产物的产率继续增加,达到83%。当反应温度增加到80 ℃时,产率反而降低至70%。因此该反应选择在60 ℃下进行。
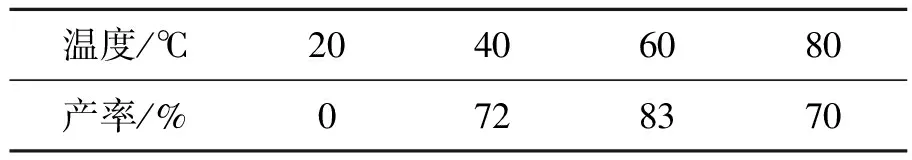
表4 温度对反应的影响
综上,铜催化噁唑硼烷一锅法氢转移还原胺和醛的胺化反应最佳条件为:以三羟甲基氨基甲烷(1.0 mmol)和BH3·THF(2.0 mmol)生成的1,3,2-噁唑硼烷络合物(2.0 equiv.)为氢源,以甲磺酸铜(20 mol/mol)为催化剂,水(2 mL)为溶剂,60 ℃下反应24 h,3b的GC产率为83%,分离产率为80%。
2.2 底物拓展
在最佳反应条件下,对底物进行拓展,研究了芳香醛在芳环上的电子效应对一锅法氢转移还原胺化的影响(3a~3n, Scheme 1)。结果显示,芳香醛底物芳环的4-位上有给电子取代基时,目标产物产率良好(3b~3c, 71%~80%)。芳环的4-位上有吸电子取代基时产率略有降低(3d~3f, 62%~79%)。芳香醛底物芳环的3-位和2-位有给电子和吸电子取代基时,目标产物仍然能获得中等至良好的产率(3g~3l, 55%~73%)。为了进一步考察底物的适用性,对含有杂环的醛进行了考察。例如将2-噻吩甲醛(2m)、吡啶-2-甲醛(2n)应用于一锅法氢转移还原胺化反应,也获得中等的产率(3m~3n, 45%~59%)。
接下来考查了不同取代基的苄胺1和苯甲醛2a的一锅法氢转移还原胺化(3o~3t)。结果显示,当苄胺芳环上2-位、3-位和4-位均有取代基时,其中4-位取代基的苄胺在反应中能获得良好的产率(3o~3p, 68%~73%),而苄胺芳环上2-位和3-位有取代基时,降低了反应活性,目标产物的产率略有降低(3q~3t, 45%~58%)。
在温和的反应条件下,发展了铜催化1,3,2-噁唑硼烷络合物一锅法氢转移还原胺与醛的胺化反应,以中等至良好的产率(45%~80%)成功合成了20种二级胺类化合物。该一锅法氢转移还原胺化的反应方法具有高效、反应条件温和、底物适用范围广等优点。

