长链非编码RNA与肾脏疾病研究进展
范佳综述 何平审校
非编码RNA(non-coding RNA,ncRNAs)是在RNA水平而不是蛋白质水平上发挥作用的基因组转录本,主要包括miRNAs、lncRNAs、circRNAs、snoRNAs和tRNAs。长链非编码RNA(long non-coding RNA,lncRNA)被定义为长度超过200个核苷酸但没有蛋白质编码能力的RNA分子,主要通过对基因印记的调控、染色质重构、增强子、分子海绵及小RNA前体等作用调控基因表达。lncRNA广泛参与细胞的生长、发育、分化及凋亡等生物学过程。其异常表达或基因突变可能会导致包括出生缺陷、肿瘤等人类多种疾病,成为某些疾病治疗的潜在靶点。近年来,越来越多的研究表明,lncRNA与肾脏疾病密切相关,在肾脏疾病中发挥重要作用,其异常表达参与肾脏疾病的发生发展。本文就长链非编码RNA与肾脏疾病的研究进展进行综述。
1 LncRNA概述
lncRNAs是一类长度大于200 bp的非蛋白质编码的RNA。与蛋白质编码的mRNAs类似,lncRNAs也由RNA聚合酶Ⅱ转录,并经历转录后修饰,如5’加帽、多聚腺苷化和剪接[1]。lncRNAs在大多数生物体中具有不同的功能,它们可以作为支架、引物、诱饵、信号等多种方式调控基因的表达和功能,并可通过基因组靶向、顺式或反式调控发挥作用。考虑到lncRNA功能范围广泛,lncRNA在肾脏疾病中的作用评估,可以提供新的诊断和治疗机会。
2 LncRNA与肾小球疾病
2.1 糖尿病肾病 糖尿病肾病(DKD)是糖尿病的常见并发症,其患病率在全球范围内呈上升趋势。目前,在西方国家,DKD被认为是终末期肾病(ESKD)的主要原因[2]。
2.1.1 lncRNA在DKD中上调: 沉默的lncRNA PVT1通过上调FOXA1抑制足细胞损伤和凋亡[3],通过miR-9/SIRT1轴诱导的自噬,证实了lncRNA SOX2OT可以减轻高糖诱导的足细胞损伤。因此,SOX2OT可能成为DKD的潜在治疗靶点[4]。Li等[5]发现,高糖诱导的肾小管上皮细胞中,MALAT1通过靶向miR-23c和连续上调的ELAVL1和NLRP3导致凋亡增加。研究表明,MALAT1的上调与糖尿病小鼠肾小球足细胞损伤和蛋白尿有关,在高糖处理的足细胞中,MALAT1与β-catenin(肾脏纤维化的中介物)的移位有关,也与SPSF1(前mRNA剪接分子)的过表达有关,参与诱导了DKD的进展[6]。Sun等[7]发现,lncRNA Erbb4-IR在db/db小鼠中高度表达,并通过Smad3依赖性机制特异性诱导AGEs。敲除Erbb4-IR基因可防止db/db小鼠微量白蛋白尿升高、血清肌酐升高和进行性肾纤维化,从而预防2型糖尿病的发生。Gm4419是近期在肾组织中发现的一种促炎基因。Yi等[8]研究表明,Gm4419可能通过NF-κB/NLRP3炎性信号在DKD炎性反应中发挥作用。综上,上调的lncRNA参与了DKD的发生和发展,并可能成为DKD治疗的新靶点,但其具体机制仍需进一步研究,见图1。
2.1.2 lncRNA在DKD中下调:在不同的DKD模型中,TUG1既可作为miR-377的海绵,减轻细胞外基质沉积,又可通过调节内质网应激信号、PGC-1α和TRAF5来保护足细胞免于凋亡[9-11]。MIAT通过稳定Nrf2的表达来调节近曲小管细胞活性,Nrf2是细胞抵御高血糖引起的氧化应激和遗传毒性的关键分子。Nrf2可以从病理和功能上保护肾脏免受糖尿病的损害[12-13]。在45 mmol/L葡萄糖培养的肾小管上皮细胞(HK-2细胞)中,过表达MIAT可增强Nrf2的表达[14]。CYP4B1-PS1-001在DKD的早期阶段被显著下调,其过表达可抑制系膜细胞的增殖和纤维化。其作用是通过核仁中的核蛋白酶体降解途径介导的[15]。LINC01619在DKD患者肾活检组织中表达下调,并且与蛋白尿和肾功能受损相关。它主要表达在足细胞胞质中,并作为miR-27A的“海绵”。此外,LINC01619能够在糖尿病大鼠体内引发氧化应激和足细胞损伤,表现为足细胞凋亡增加,足细胞足突弥漫性消退,肾功能受损。这种影响也在高糖处理的足细胞的体外实验研究中产生[16]。
综上,下调的lncRNA可为DKD的发病机制提供潜在的治疗靶点和分子生物学标志物,可能为DKD的治疗提供新的方法,见图1。

图1 DKD中lncRNA的作用机制
2.2 IgA肾病 在亚洲人群中,IgA肾病(IgAN)被认为是最常见的原发性慢性肾小球疾病。IgAN的主要特征是IgA1沉积在肾小球系膜区,Zuo等[17]通过基因芯片分析,在IgAN患者和健康对照组外周血中共鉴定出167个差异表达的lncRNAs和94个差异表达的mRNAs,提示这些mRNAs和lncRNAs可能是诊断IgAN的潜在生物标志物。并且发现lncRNAs和mRNAs的相互调节可能参与了IgAN相关的先天免疫紊乱。LncRNA—mRNA网络的失调可能是IgAN进展的一个可能机制。Guo等[18]的研究表明,LncRNA-G21551在IgAN患者中表达下调,其可能通过调节FCGR3B(IgG Fc段的低亲和力受体)的表达在IgAN的发病机制中发挥重要作用,lncRNA-G21551的表达水平可作为IgAN诊断的生物标志物,尽管该研究未阐明lncRNAs在IgAN中的具体调控机制和功能,但这些发现为进一步研究IgAN中的lncRNAs奠定了基础,从而为确定潜在的生物标志物和治疗该疾病提供新靶点。
2.3 膜性肾病 膜性肾病(MN)又称膜性肾小球肾炎,是一种非炎性免疫性肾脏疾病,常导致肾病综合征。Huang等[19]利用实验性MN小鼠模型,发现XIST和NEAT1在肾小管上皮细胞和肾小球细胞中的水平都显著上调,凸显了这些lncRNAs在MN发病机制中的潜在价值。在MN患者肾组织中,TLR4表达上调,血管紧张素Ⅱ(AngⅡ)通过上调TLR4表达促进足细胞凋亡[20],提示TLR4表达促进MN足细胞凋亡。MN中也观察到Ang Ⅱ水平升高,并导致人类肾小管间质损伤和其他慢性肾脏疾病[21- 22]。细胞培养的数据表明,XIST可能与miR-217相互作用,上调TLR4的表达,从而导致足细胞凋亡和MN的发生[23]。随着XIST/miR-217/TLR4轴的验证,为MN的诊断和治疗提供了新的靶点和生物标志物。
2.4 狼疮性肾炎 系统性红斑狼疮(SLE)是一种以多种自身抗体和器官损害为特征的异质性自身免疫性疾病,狼疮性肾炎(LN)是SLE最常见、最严重的并发症之一。转移相关肺腺癌转录本1(Malat-1),也被称为NEAT2,在SLE和LN患者中表达上调[24- 25]。CTC-471J1.2作为LN的诊断标志物具有较高的敏感度和特异度,仅在LN患者中与肾小球滤过率呈正相关[24]。与单纯SLE患者相比,LN患者中TUG1的表达下调[26],且TUG1水平测定可作为SLE诊断和预测LN并发症的生物标志物。RP11-2B6.2在LN患者中表达上调,主要见于LN活动期患者[27]。马洪波等[28]研究表明,lncRNA TUG1吸附miR-144,进而抑制LN小鼠肾小球系膜细胞炎性因子分泌,从而减少细胞增殖,并促进凋亡。总之,以上研究表明,lncRNA作为一种特异性标志物,在LN中具有预测和诊断的潜力,有助于深入了解LN的发病机制。
3 LncRNA与急性肾损伤
急性肾损伤(AKI)是由缺血再灌注、肾毒性损伤、脓毒症等多种刺激引起的以肾功能急剧下降为特征的疾病。越来越多的研究表明,大量的lncRNA在AKI中发挥重要作用。
3.1 脓毒症AKI Chen等[29]研究表明,NEAT1在脓毒症AKI患者中高表达,且上调的程度与AKI的严重程度相关。Jiang等[30]研究发现,过表达lncRNA HOTAIR可通过下调miR-34a/Bcl-2信号通路,抑制肾组织凋亡,从而减轻脓毒症大鼠AKI的发生。Liu等[31]研究表明,下调lncRNA TUG1可能通过调控miR142-3p/SIRT1轴和NF-κB信号促进脓毒症AKI的发生发展。Shen等[32]提出,TapSAKI在脓毒症AKI中升高,通过miR-22/PTEN/TLR4/NF-κB通路促进HK-2细胞凋亡和炎性反应。综上所述,这些发现表明lncRNAs可能在脓毒症AKI的炎性反应调节中起关键作用,见表1。
3.2 缺血再灌注AKI Yu等[33]研究显示,lncRNA PRINS通过在体外缺氧条件下以HIF-1α依赖方式上调,PRINS可能与RANTES相互作用并抑制RANTES,以减轻肾缺血再灌注损伤(IRI)中的急性肾小管坏死和炎性反应。MALAT1也以HIF-1α依赖的方式诱导。在体外,沉默MALAT1与抑制细胞增殖有关。然而,在体内,MALAT1基因敲除只引起缺血性AKI的微小变化,但由于其在血浆和肾活检组织中的高浓度,它仍然是肾脏缺血再灌注损伤的一个潜在的生物标志物[34]。此外,TapSAKI、LncRNA Gas5和LINC00520在缺血再灌注损伤的小鼠中上调[35-37]。综上,这些发现表明,lncRNAs可能在缺血性AKI的炎性反应调节中起关键作用,见表1。
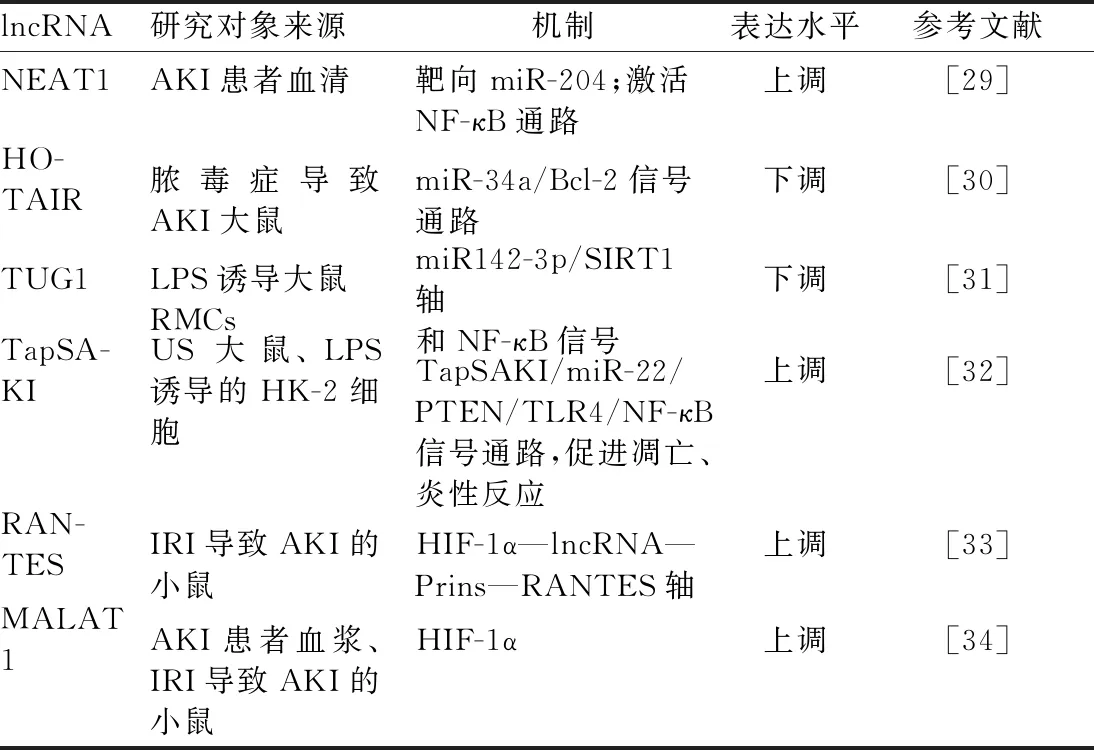
表1 lncRNA与AKI的发生机制
4 LncRNA与肾纤维化
肾纤维化是以细胞外基质过度积聚为特征的病理过程,是慢性肾脏疾病(CKD)进展为慢性肾功能衰竭(CRF)的关键因素。目前的研究表明,一些与肾纤维化相关的lncRNA是通过转化生长因子β1(TGF-β1)和结缔组织生长因子(CTGF)发挥调控作用的。TGF-β1是肾脏纤维化发生发展中的主要细胞因子。Jia等[38]研究显示,与对照组相比,MALAT1和MIAT在肾纤维化动物模型和CKD患者中普遍上调。MALAT1/miR-145/黏着斑激酶(FAK)通路被证实在TGF-β1诱导的肾纤维化中起重要作用[39]。在体外实验中敲除MIAT可以缓解TGF-β1刺激HK-2细胞所致的增殖、迁移和上皮—间充质转化[40]。GAS5在TGF-β1处理的HK-2细胞和糖尿病小鼠中表达上调。GAS5的敲除通过结合miR-96-5p来减轻肾纤维化[41]。CTGF是由TGF-β诱导产生的一种致纤维化蛋白,是TGF-β的下游产物。Chen等[42]最近发现,在5/6肾切除大鼠CKD模型中,降低lncRNA LINC00667可通过miR-19b-3p/LINC00667/CTGF信号通路促进CRF肾小管上皮细胞增殖,改善CRF肾纤维化。总之,了解lncRNAs和TGF-β1、CTGF之间的关系可能有助于找到治疗肾纤维化的有效策略。
5 LncRNA与肾细胞癌
肾细胞癌(RCC)是肾癌的常见形式,基因改变和表观遗传途径的失调参与了肿瘤的发生。Hirata等[43]发现,MALAT1在人RCC组织中的表达较高,这与患者生存期降低有关。沉默MALAT1导致RCC细胞增殖和侵袭减少,以及细胞凋亡的增加。MALAT1被c-Fos转录激活,并与Ezh2和miR-205相互作用。该发现表明,MALAT1的过表达在RCC中的致癌功能,可能为该疾病提供新的治疗标志物。Li等[44]通过微阵列分析发现,转移性肾细胞癌相关转录本1(MRCCAT1)为一种新型lncRNA。MRCCAT1在肾透明细胞癌(ccRCC)中高度表达,并与ccRCC的转移特性有关。MRCCAT1通过抑制NPR3并激活p38-MAPK信号通路来促进ccRCC细胞增殖、迁移和侵袭。叶志华等[45]的研究证明,PEBP1P2在RCC组织和细胞中呈低表达。上调PEBP1P2可抑制RCC A498细胞的增殖和迁移,其作用机制可能是PEBP1P2通过下调CARD10基因表达抑制NF-κB信号通路的转导。此外,Xiao等[46]发现了FILNC1低表达与RCC患者的不良临床预后相关。Quinn等[1]揭示了一个名为lncARSR的lncRNA,可促进RCC细胞中AXL和c-MET的表达,可作为预测肾细胞癌对舒尼替尼耐药的指标和潜在的治疗靶点。
6 小结与展望
大量研究表明,lncRNA与肾脏疾病的发生发展有关,它可以提供新的诊断和预后生物标志物,以及为肾脏病理生理领域的预防和治疗提供新策略。然而,lncRNA在肾脏疾病中具体的发病机制仍不清楚,目前仍未深入探讨其特定的作用和潜在的作用机制,lncRNA作为药物靶点和治疗手段的应用还处于起步阶段。相信在不久的将来,在肾脏炎性反应、损伤、移植和癌症等领域,调控lncRNA的表达将是一种很有前途的治疗策略。

