超声造影下细针抽吸活检联合洗脱液甲状腺球蛋白测定诊断甲状腺乳头状癌颈部淋巴结转移的价值
阿不都沙特·阿不都热西提,米尔艾力·阿力木,吴仕吉,努尔艾力·木台力甫,马爱琳,阿布都乃比·托合提
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)占甲状腺癌的70%~80%,具有高分化、低恶性和生长缓慢的特点,但是PTC早期淋巴结转移率高,颈部淋巴结转移明显增加PTC术后复发率[1-2]。淋巴结手术活检是诊断颈部肿大淋巴结性质的“金标准”,但对位置较深或血管紧邻淋巴结仍有一定的困难。随着医疗穿刺器械的发展,超声引导下细针穿刺细胞学检查(fine-needle aspiration cytology,FNAC)逐渐成为评估淋巴结性质的主要方法[3]。超声造影(contrast-enhanced ultrasound,CEUS)可通过超声造影剂的微循环获得血流灌注信息,清晰显示肿瘤组织新生血管和血管网络,鉴别坏死组织类型[4]。通过超声造影下细针抽吸活检(contrast-enhanced ultrasound- fine-needle aspiration,CEUS-FNA)靶向取材可大大提高取材成功率及淋巴结转移诊断的准确性[5]。甲状腺球蛋白(thyroglobulin,Tg)是甲状腺激素的蛋白质前体,由甲状腺滤泡上皮细胞特异性分泌,Tg水平升高则高度提示甲状腺癌转移的可能,细针穿刺洗脱液甲状腺球蛋白(fine needle aspiration-thyroglobulin,FNA-Tg)水平增高与 PTC淋巴结转移有关[6-7]。本研究拟采用CEUS-FNA联合FNA-Tg检测诊断PTC颈部淋巴结转移,以期为临床诊断提供参考依据,报道如下。
1 资料与方法
1.1 临床资料 选取2020年1月—2021年12月喀什地区第一人民医院乳腺甲状腺外科收治经术后组织病理学或甲状腺细针穿刺细胞学检查证实为PTC且超声可疑颈部淋巴结转移患者85例,其中男46例,女39例,年龄30~52(46.25±5.02)岁;民族:维吾尔族70例,汉族15例;可疑淋巴结101枚,淋巴结直径5~19(12.24±3.02)mm;可疑淋巴结分布:左侧Ⅱ区(颈内静脉淋巴结上组)11枚,左侧Ⅲ区(颈内静脉淋巴结中组)26枚,左侧Ⅳ区(颈内静脉淋巴结下组)39 枚,右侧Ⅱ区6枚,右侧Ⅲ区7枚,右侧Ⅳ区12枚。本研究获得医院伦理委员会批准[2020快审研 (第63号)],患者及家属均知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准[8]:①超声提示颈区淋巴结砂砾样钙化或液化或囊性变,伴或不伴淋巴结纵横比<2、皮髓质分界不清、出现多发团片样高回声、内部血供异常,即可诊断颈部淋巴结转移;②均行外科手术治疗同时行颈淋巴结清扫,获得完整颈部淋巴结组织标本及病理检查结果;③术后病理结果证实为PTC;④年龄>18岁。(2)排除标准:①其他类型甲状腺癌,合并其他恶性肿瘤;②甲状腺手术史、未行中央淋巴结清扫;③凝血功能异常、严重心肺功能异常及大面积颈部皮肤破损患者;④临床资料及超声图像资料不完整者。
1.3 检查方法
1.3.1 CEUS-FNA检查:采用Philips IU elite 彩色超声诊断仪,L12-5、L9-3线阵,探头频率3~12 MHz。患者仰卧位,颈部垫高,充分暴露检查和穿刺部位,常规超声对可疑淋巴结进行体表标记。定位可疑淋巴结于屏幕中央切换至造影模式,经肘静脉通道团注注射用六氟化硫微泡(声诺维,Bracco公司)悬液(声诺维59 mg +生理盐水5 ml)2.4 ml,再推注生理盐水5 ml 冲管。启动增强图像,嘱患者屏气,动态观察目标淋巴结内造影剂增强模式,存储动态图像。常规消毒铺巾,2%利多卡因5 ml局部浸润麻醉,超声实时监测下,采用22 G×50 mm活检穿刺针(美国巴德公司,型号MN1413)进入超声造影异常增强区域或血流异常丰富区域,针尖到达预定穿刺点进行多角度提插,根据穿刺涂片质量和细胞量多少确定所需穿刺针数,常规每个淋巴结穿刺3次。穿刺完成后取出标本,其中一次将穿刺针芯内组织推注于载玻片上,推片固定,一次穿刺针芯内组织装入细胞保存液瓶中,一次用于洗脱液的检测。注明穿刺淋巴结具体位置(所在颈部的解剖分区)送细胞病理学检查,以病理结果明确发现肿瘤细胞为阳性,未发现肿瘤细胞或涂片细胞组数不够诊断为阴性。穿刺完毕后对穿刺部位局部按压 15~20 min。
1.3.2 FNA-Tg检测:选择第二次穿刺针芯内组织,用生理盐水1 ml反复冲洗10 次,制成洗脱液送检。洗脱液Tg检测方法:采用罗氏全自动化学发光免疫分析仪e601(德国罗氏公司)运用电化学发光免疫测定法测定洗脱液中FNA-Tg,以FNA-Tg>1.0 μg/L为淋巴结转移阳性[9]。

2 结 果
2.1 术后病理检查结果 术后病理结果提示,存在颈部淋巴结PTC转移72枚(72/101,71.29%);非PTC转移29枚(29/101,28.71%),其中细胞病理学提示为血液成分7枚,炎性细胞、反应性增生18枚,不典型增生4枚。
2.2 CEUS影像表现 PTC转移淋巴结CEUS表现为局部区域增强、不均匀低增强,中心部位灌注增加合并灌注损伤(图1A);非PTC转移淋巴结CEUS表现为离心性灌注,多不合并灌注缺损,均匀增强(图1B)。在CEUS引导下穿刺及CEUS-FNA细胞病理表现见图1C、D。

注:A.PTC转移淋巴结:淋巴结周边异常高增强区(白色箭头);B.非PTC转移淋巴结;C.在CEUS引导下穿刺;D.CEUS-FNA细胞病理图,深紫色提示肿瘤细胞
2.3 转移和非转移洗脱液中Tg值比较 PTC转移淋巴结洗脱液72枚中Tg值为1.02~462.02(132.02±26.35)μg/L,非PTC转移淋巴结洗脱液29枚中Tg值为0~10.25(5.21±1.74)μg/L,二者比较差异有统计学意义(t=25.816,P<0.001)。
2.4 CEUS-FNA诊断PTC颈部淋巴结转移与病理结果比较 CEUS-FNA检出PTC转移淋巴结63枚,非PTC转移淋巴结24枚,漏诊9枚(血液成分2枚,不典型增生7枚),误诊5枚(均为淋巴结炎性反应性增生)。以术后病理结果为准,CEUS-FNA诊断PTC颈部淋巴结转移的敏感度为0.875(63/72),特异度为0.828(24/29),阳性预测值为0.927(63/68),阴性预测值为0.727(24/33),漏诊率为12.50%(9/72),误诊率为17.24%(5/29),准确率为86.14%(87/101)。Kappa检验CEUS-FNA与术后病理结果一致性较好(Kappa=0.659,P<0.05)。
2.5 CEUS-FNA联合FNA-Tg诊断PTC颈部淋巴结转移与病理结果比较 以CEUS-FNA检测结果阳性和/或FNA-Tg>1.0 μg/L为联合诊断结果阳性,CEUS-FNA联合FNA-Tg检出PTC转移淋巴结68枚,非PTC转移淋巴结26枚,漏诊4枚(1枚为血液成分,3枚为不典型增生),误诊3枚(均为淋巴结炎性反应性增生)。以术后病理结果为准,CEUS-FNA联合FNA-Tg诊断PTC颈部淋巴结转移的敏感度为0.944(68/72),特异度为0.897(26/29),阳性预测值为0.958(68/71),阴性预测值为0.867(26/30),漏诊率为5.56%(4/72),误诊率为10.34%(3/29),准确率为93.07%(94/101)。Kappa检验CEUS-FNA联合FNA-Tg检测结果与术后病理结果一致性较好(Kappa=0.841,P<0.05)。
2.6 CEUS-FNA、FNA-Tg及二者联合诊断PTC颈部淋巴结转移的ROC分析 CEUS-FNA、FNA-Tg及二者联合诊断PTC颈部淋巴结转移的AUC(95%CI)为0.846(0.781~0.912)、0.822(0.752~0.892)、0.928(0.881~0.976),敏感度为0.875、0.854、0.944,特异度为0.828、0.786、0.897,约登指数分别为0.703、0.640、0.841,CEUS-FNA联合FNA-Tg诊断PTC颈部淋巴结转移的AUC高于单独诊断(Z=3.749、3.956,P均<0.001),见图2。
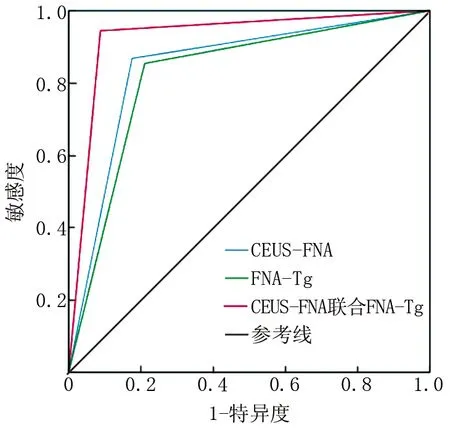
图2 CEUS-FNA、FNA-Tg及二者联合诊断PTC颈部淋巴结转移的ROC图
3 讨 论
PTC颈淋巴结转移的发生率达40%~90%,颈部淋巴结转移是PTC复发的主要危险因素,PTC颈淋巴结转移与男性、年龄≤45岁、多灶性、肿瘤大小>1.0 cm、肿瘤位于甲状腺上1/3、包膜浸润、甲状腺外侵犯、超声检出微钙化病灶等多种因素有关[10]。FNA是评估可疑甲状腺结节或超声提示恶性甲状腺结节最常用、最有效的方法,超声引导下FNA可实时可视化针头,提高活检取材成功率和诊断准确率,检测结果良性可避免不必要的甲状腺手术,如果检测到恶性细胞,FNA将是手术策略的决定性因素,但是由于检测方法和技术的限制,部分甲状腺结节仍无法通过 FNA 诊断[11]。CEUS是一种重要的无辐射成像方式,是近年来超声医学研究的热门,该技术可通过静脉注射超声造影剂,辨别正常组织和病理组织中血管血流灌注差异,观察病灶内增强方式,提供常规超声无法反映的微血管信息,为病灶性质的鉴别、疾病严重程度评估、治疗反应性监测、并发症或疾病复发风险评估提供更可靠的信息[12]。临床实际工作中,对于大部分坏死或钙化的淋巴结,如何保证FNA有充足的细胞量,成为目前临床工作的重点。有学者将CEUS和FNA 2种技术结合用于乳腺癌前哨淋巴结活检取得显著的效果[13]。
本研究采用CEUS-FNA诊断颈部淋巴结转移曲线下面积达0.846,说明CEUS-FNA在诊断PTC颈部淋巴结转移有较高的价值。Zhu等[14]研究显示,将CEUS和FNA 2种技术结合可提高甲状腺良恶性结节的敏感度、阳性预测值和准确度。当颈部淋巴结内含有甲状腺滤泡上皮特性癌细胞时,在超声造影图像上可显示高增强特征[15],在超声造影提示异常或高增强区域进行FNA操作,可实现精确穿刺。另外肿瘤不同病理类型坏死区域缺乏血流灌注,造影图像表现为灌注缺损,穿刺时应选择微钙化区或边缘血流异常丰富区域,注意避开无灌注区域,也能在一定程度上提高穿刺准确率。本研究CEUS-FNA诊断颈部淋巴结转移时,5枚淋巴结误诊为炎性反应性增生,推测原因为:首先,癌细胞早期转移至颈部淋巴结,尚未在淋巴结内形成局灶性改变,肿瘤细胞尚未对淋巴结皮质血供造成明显影响,因此超声造影可能无法观察到明显增强或异常表现,导致FNA穿刺时漏掉病灶部位;其次,部分转移淋巴结新生血管管径小、管腔内有血栓形成,因此导致淋巴结血流灌注减少,超声造影无法显示高增强图像,易与正常淋巴结混淆,进而错误引导FNA穿刺。
Tg是甲状腺滤泡上皮细胞特异性合成的一种大分子糖蛋白复合物,由2 768个氨基酸组成,在甲状腺滤泡中最重要,含量最丰富,Tg参与甲状腺激素合成,同时抑制甲状腺激素合成,在甲状腺细胞生长分化中发挥关键调控作用[16]。多数研究证实,甲状腺癌患者Tg增高,且高水平Tg与甲状腺癌复发有关,因此,Tg作为甲状腺癌复发的肿瘤标志物在临床得到广泛的应用[17-19]。淋巴结活检组织洗脱液中检测出Tg表明该淋巴结组织内出现甲状腺滤泡上皮细胞,甲状腺滤泡上皮细胞具备分泌Tg的能力,因此洗脱液中Tg浓度升高,FNA-Tg阳性被认为是甲状腺淋巴结转移的强有力证据,且FNA-Tg诊断淋巴结转移的效能不受甲状腺或血清中抗TG 抗体水平的影响[20]。李飞波等[9]研究结果也显示,FNA-Tg>1 μg/L时,诊断甲状腺癌淋巴结转移的敏感度为0.983,特异度为0.706,阳性预测值为0.922,阴性预测值为0.923。然而受超声识别引导、FNA取材等因素影响,FNA-Tg也存在一定假阴性率和假阳性率,现有研究显示,单一FNA-Tg检测漏诊率1.67%,误诊率29.41%,将FNA-Tg与超声技术结合可降低漏误诊率。本研究将CEUS-FNA与FNA- Tg结合,以FNA- Tg>1.0 μg/L为诊断PTC颈部淋巴结转移的标准,曲线下面积为0.928,高于单独CEUS-FNA和FNA-Tg检测,表明CEUS-FNA联合FNA-Tg可提高PTC颈部淋巴结转移诊断的效能,在诊断PTC颈部淋巴结转移中具有更高的价值。
综上,与单独CEUS-FNA、FNA-Tg比较,二者联合检测可提高PTC颈部淋巴结转移诊断的敏感度、特异度和准确率,降低漏诊和误诊率,诊断效能更高,在PTC患者颈部淋巴结转移评估中更具应用价值。本研究局限之处在于未比较传统二维超声与CEUS引导下FNA结合FNA-Tg检测的效能,尚待进一步研究证实。
利益冲突:所有作者声明无利益冲突
作者贡献声明
阿不都沙特·阿不都热西提:实际技术操作、数据统计分析,论文撰写;米尔艾力·阿力木:临床沟通,病例收集、追踪,数据整理;吴仕吉、努尔艾力·木台力甫:辅助技术操作,数据收集;马爱琳:选题指导,质量控制;阿布都乃比·托合提:临床资料收集及随访

