同步放化疗联合安罗替尼治疗局部晚期非小细胞肺癌疗效分析
李廷轩,杨 亚,刘俊启,樊锐太
(郑州大学第一附属医院放疗科,河南 郑州 450052)
非小细胞肺癌是最常见的肺癌类型,约占肺癌总数的80%~85%,由于前期症状隐匿,近1/3非小细胞肺癌确诊时已是局部晚期[1]。目前临床控制局部晚期非小细胞肺癌进展的主要手段是同步放化疗,但大多数患者仍易复发,5 a生存率仅为15%~25%[2-3]。近年来肺癌分子靶向药物的临床应用取得了不少进展,相比较于传统化疗药物,具有不良反应轻、靶向性强的特点,是一类具有抗肿瘤潜力的新型药物[4]。持续异常的血管生成是肿瘤的特征之一,促进肿瘤的生长和转移。安罗替尼的抗肿瘤原理是抑制血管生成,作为一种小分子酪氨酸激酶抑制剂,可以抑制包括成纤维细胞生长因子受体(fibroblast growth factor receptor,FGFR)、血小板衍生生长因子受体(platelet derived growth factor receptor,PDGFR)、血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)等在内的激酶,是一种抗血管生成的靶向药物。国家药品监督管理局于2018年批准安罗替尼作为治疗晚期或转移性非小细胞肺癌患者的靶向药物[5]。放疗是肺癌的重要治疗手段,抗血管生成靶向药物可以使肿瘤血管正常化,改变肿瘤内部氧合状态,从而增强放疗敏感性。因此,有必要探讨安罗替尼联合放化疗相较于单纯放化疗是否可以为局部晚期NSCLC患者带来生存受益。
1 资料与方法
1.1 病例资料选取2018年6月至2021年6月在郑州大学第一附属医院就诊的575例局部晚期非小细胞肺癌患者(其中60例采用同步放化疗联合安罗替尼方案、515例采用常规同步放化疗方案),利用倾向评分匹配(propensity score matching,PSM)方法以排除年龄、性别、基础疾病等非研究混杂因素的干扰,最终纳入60例同步放化疗联合安罗替尼的患者为观察组,60例采用常规同步放化疗方案的患者为对照组。2组基线特征比较差异无统计学意义(P>0.05),具有可比性。见表1。
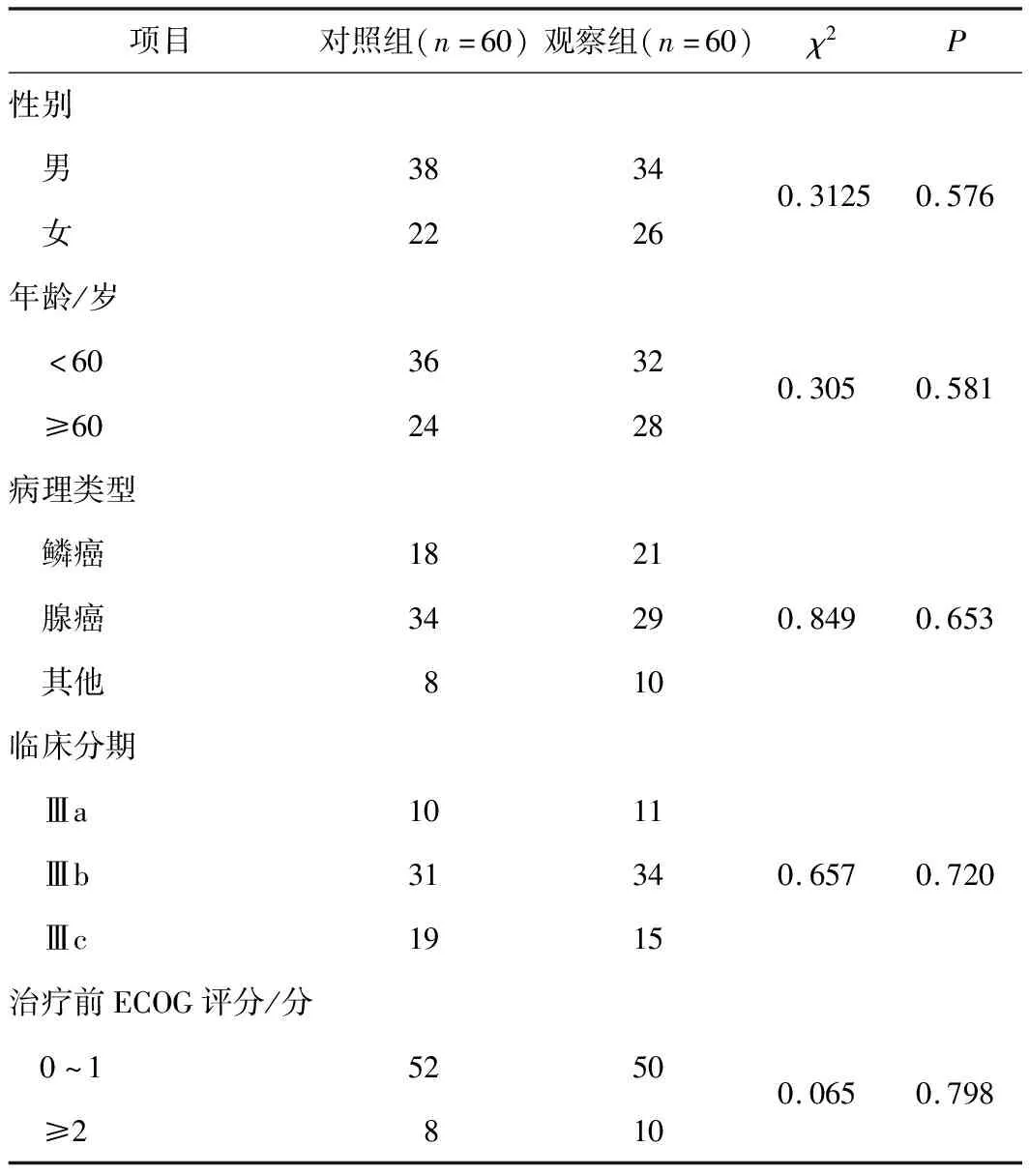
表1 2组患者基线特征比较
纳入标准:1)经组织病理学明确诊断外为鳞癌、腺癌、大细胞癌等非小细胞肺癌类型的患者;2)临床分期为局部晚期,包括Ⅲa、Ⅲb、Ⅲc期;3)病灶需进行根治性放疗;4)ECOG评分<2且预估生存期≥3个月;5)既往无肺癌相关治疗史。排除标准:1)无法耐受放疗或化疗;2)造血功能或心、肝、肾、肺功能异常患者;3)中央型肺癌或具有大咯血风险者;4)使用两种或两种以上降压药联合治疗仍无法控制的高血压患者;5)有症状的脑转移患者。
1.2 治疗方案同步放化疗方案:1)放疗。所有患者均采用全程适形调强放疗技术,总剂量60 Gy,每次2 Gy,5次每周,共30次,连续治疗6周;2)化疗。放疗期间同时给予化疗方案(顺铂+依托泊苷),顺铂剂量为50 mg/m2,第1、8、29、36天用药;依托泊苷剂量为50 mg/m2,第1~5天、第29~33天用药。观察组在对照组同步放化疗基础上口服安罗替尼片(正大天晴药业集团股份有限公司,国药准字H20180004,规格:12 mg/粒),每天餐后30 min口服1粒,1次/d,连续服用2周后再休息1周,3周为1个周期,根据患者反应,酌情调整剂量为8 mg/d或10 mg/d。
1.3 短期疗效及不良反应评估参照实体瘤疗效评价标准RECIST 1.1进行短期治疗疗效评价[6],评价时间为同步放化疗结束1个月后,分为完全缓解(complete response, CR):所有靶病灶消失≥4周,无新病灶出现;部分缓解(partial response,PR):所有目标病灶直径总和减少≥30%且至少维持4周,疾病进展(progressive disease,PD):靶病灶直径总和增加≥20%,出现新病灶和疾病稳定(stable disease, SD):介于PR和PD之间。以CR+PR+SD计算疾病控制率。不良反应评价:参照美国国家癌症研究所的不良事件常用术语标准评价[7]。
1.4 统计学处理采用SPSS 22.0和R语言进行数据分析,2组间患者的基线特征、短期疗效和不良反应等数据用百分数表示,比较用χ2检验,用Kaplan-Meier曲线和log rank检验进行生存分析,检验水准α=0.05。
2 结果
2.1 2组患者近期疗效比较安罗替尼联合同步放化疗组CR 6例、PR 37例、SD 16例、PD 1例,疾病控制率71.67%;单纯放化疗组CR 2例、PR 30例、SD 25例、PD 3例,疾病控制率53.33%。2组疾病控制率比较差异无统计学意义(χ2=5.707,P=0.136)。
2.2 2组患者生存分析比较随访时间为3~36个月,安罗替尼联合同步放化疗组中位总生存时间为25.7个月,长于单纯放化疗组的20.8个月,差异有统计学意义(P=0.002)。见图1。

图1 2组患者生存曲线比较
2.3 2组患者不良反应比较2组患者大多数不良反应为Ⅰ~Ⅱ度,及时调整安罗替尼用量及对症治疗后,都得到控制,不影响放化疗正常进行。安罗替尼联合同步放化疗组高血压和手足综合征发生率均高于单纯放化疗组(χ2=5.373,P=0.043;χ2=7.211,P=0.027)。见表2。
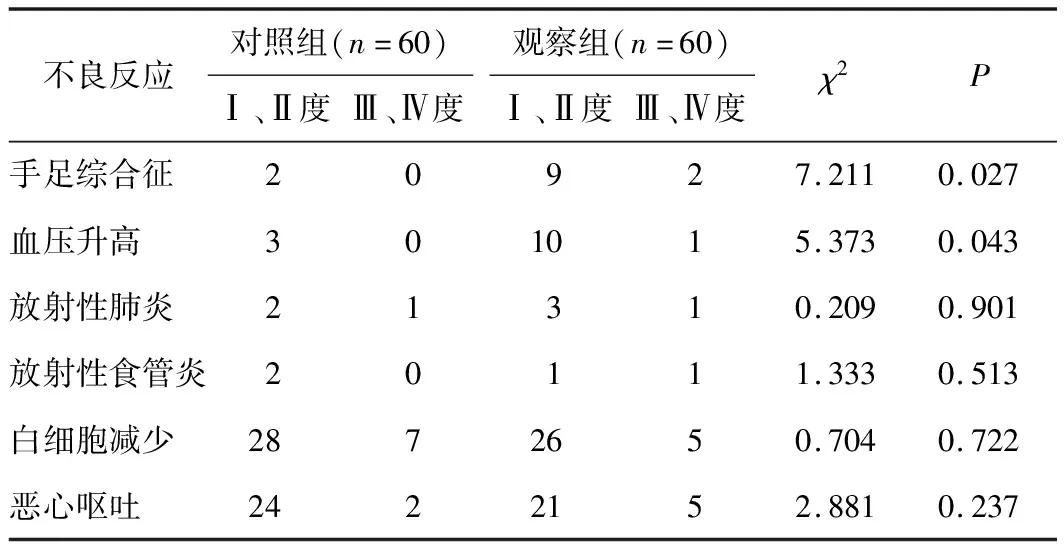
表2 2组患者不良反应发生率比较
3 讨论
非小细胞肺癌起病较隐匿,临床症状出现较晚,常常一经诊断即为局部晚期,甚至出现远处转移,丧失手术治疗的机会,5 a生存率不足20%。局部晚期非小细胞肺癌占确诊肺癌患者比例较高,且异质性较强,大部分患者丧失手术机会,推荐的治疗措施是同步放化疗方案[8],可有效提高非小细胞肺癌患者治疗的局部控制率并改善远期生存。肿瘤的发生、发展、扩散和转移需要充足的营养供应,与肿瘤内部丰富的血管生成有关。抗血管生成药物可以破坏已存在的血管,抑制新生血管,从而促进肿瘤血管正常化,提高肿瘤组织含氧量,提高肿瘤组织对放化疗的敏感性[9-10]。
VEGF是最强的血管生成刺激因子,在生理及病理条件下均可直接作用于血管内皮细胞从而促进肿瘤的增殖、转移和血管形成[11]。安罗替尼正是针对多个血管生成相关激酶,多方位抑制肿瘤血管生成的靶向药,尤其是VEGFR、PDGFR、FGFR对这3个受体的抑制作用,不同于其他靶向药只作用于相对单一的靶点,安罗替尼表现出了同时对这3条信号通路的抑制作用,可有效避免旁路激活[12]。Xie等[13]报道,相比较舒尼替尼等酪氨酸激酶抑制剂,安罗替尼对VEGFR-2/3靶点的抑制作用是其的20倍。同时安罗替尼为口服型药物,具有使用方便,不良反应较轻,患者依从性较好等优点。ALTER0303是一项大型、多中心的安罗替尼Ⅲ期研究,共有437例Ⅲb~Ⅳ期非小细胞肺癌患者入组,无论EGFR突变状态如何,安罗替尼均可延长总体生存期和病理缓解期[14]。Yuan等[15]报告了安罗替尼可以改善肿瘤微环境,从而提高放疗、免疫治疗的治疗效果。徐建平等[16]报告了安罗替尼在非小细胞肺癌中拮抗VEGF的表达可以增加放疗效果。这提示了安罗替尼与放化疗等手段综合治疗可能会起到更好的抗肿瘤效果。
本研究结果显示安罗替尼联合同步放化疗组和单纯放化疗组疾病控制率比较差异无统计学意义(χ2=5.707,P=0.136)。安罗替尼联合同步放化疗组中位总生存时间长于单纯放化疗组,差异有统计学意义(P=0.002)。这说明安罗替尼联合同步放化疗具有较好的临床疗效。本研究结果还显示,安罗替尼最常见的特异性不良反应是手足综合症和血压升高,联合应用不会增加肿瘤放化疗导致的不良反应。大多数患者出现不良反应为Ⅰ、Ⅱ度,及时给予对症治疗,均可恢复。Ⅲ、Ⅳ度不良反应较少,下调剂量及对症治疗后,绝大多数患者症状减轻,说明安罗替尼总体耐受性好,不会影响放化疗进程。在治疗过程中一定要重视不良反应的管理,加强对有高危因素的患者的宣教,才更有利于其坚持治疗,为患者带来获益[17]。
综上所述,安罗替尼联合同步放化疗方案较常规同步放化疗方案可更有效治疗局部晚期非小细胞肺癌,延长患者总体生存率,提高患者的生活质量,值得临床广泛应用。

